藤梨根药材中多糖的含量测定及不同来源样品质量评价
2016-10-15王亚琼温芝琪钟水生张华峰
王亚琼温芝琪钟水生张华峰
(1苏州市食品药品检验所,江苏 苏州 215104;2苏州大学药学院,215123)
藤梨根药材中多糖的含量测定及不同来源样品质量评价
王亚琼1温芝琪2钟水生1张华峰1
(1苏州市食品药品检验所,江苏 苏州 215104;2苏州大学药学院,215123)
目的:研究藤梨根药材中多糖的提取及含量测定方法,以评价藤梨根药材的质量。方法:采用水提醇沉法提取多糖,用苯酚-硫酸法,在485 nm处测定不同来源藤梨根多糖的含量。结果:原药材多糖含量为24.37~56.96 mg/g,商品药材多糖含量为8.53~22.49 mg/g,原药材中多糖含量明显高于市售饮片中多糖的含量,皮部多糖的含量是木部的2~4倍。结论:该方法简单,准确,重复性好,可作为藤梨根药材的质量控制方法。
藤梨根;多糖;苯酚-硫酸法;含量测定;来源;质量评价
多糖是藤梨根中的重要抗肿瘤成分,具有显著的生物学活性[1-3]。然而,目前关于藤梨根多糖含量的评价分析研究报道甚少。多糖的定量方法一般有苯酚-硫酸法,蒽酮-硫酸法及3,5-二硝基水杨酸比色法等。苯酚-硫酸法原理是糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛可与苯酚缩合成一种橙红色化合物,在一定范围内其颜色深浅与糖的含量成正比,且在485 nm左右波长处有最大吸收峰,故可用比色法在此波长下测定。由于苯酚-硫酸显色反应稳定性更好[4-6],方法较为简单,快速,因此本实验采用苯酚-硫酸法测定藤梨根药材中多糖的含量。
1 仪器、试剂及材料
1.1 仪器
DFY-300粉碎机(温岭市林大机械有限公司);标准药筛(辽宁省辽阳金属制品厂);电热恒温水浴锅(上海跃进医疗器械有限公司);Lambda 35紫外分光光度计(Perkin Elmer,USA);Sorvall ST 8台式离心机(Thermo,USA);AG245电子天平(METTLER,Switzerland)。
1.2 试剂
无水乙醇,苯酚及硫酸均为分析纯,购自国药集团化学试剂有限公司。超纯水(Millpore,USA)。
1.3 材料
D-无水葡萄糖(批号:110833-201205,中国食品药品检定研究院),3批藤梨根原药材分别产自安徽大别山,南京六合,福建宁德,由苏州市食品药品检验所鉴定为中华猕猴桃(Actinidia chinensis Planch.)的干燥根。其他商品药材均来源于市场。
2 方法与结果
2.1 供试品溶液制备
取供试药材细粉 2 g,精密称定,加超纯水60 mL沸水浴热回流,放冷后,3 500 rpm/min离心5 min,精密量取上清液2 mL,置15 mL离心管中,精密加入无水乙醇,摇匀,冷藏过夜,取出,7 000 rpm/min离心5 min,弃去上清液,沉淀加热水溶解,转移至25 mL量瓶中,放冷,加水至刻度,摇匀,即得。
2.2 对照品溶液的制备
取D-无水葡萄糖对照品适量,精密称定,加水制成每1 mL含90 μg的溶液,即得。
2.3 最大波长的确定
取适量对照品溶液及样品溶液测定全波长扫描图,如图1,因此选择485 nm为测定波长。
2.4 测定
精密量取供试品溶液1.0 mL,置10 mL具塞试管中,精密加入5%苯酚溶液1 mL(临用配制),摇匀,再精密加入硫酸5 mL,摇匀,置沸水浴中加热20 min,取出,置冰浴中冷却5 min,以相应试剂为空白,照紫外-可见分光光度法(《中国药典》(2015年版)四部通则 0401)[7],在 485 nm的波长处测定吸光度。

图1 全波长扫描图
2.5 多糖提取条件优化
根据文献报道[4-6],并结合实验的实际情况,针对浸提时间,浸提次数,醇沉倍数及时间进行考察,以确定提取多糖的最佳实验条件。
2.5.1 提取时间供试品按“2.1”方法分别浸提1,2,3,4,5,6 h后,按“2.4”方法测定,结果如图2,发现在3 h内,多糖含量呈递增趋势,但随时间延长,多糖的溶出达到平衡状态,因此浸提时间选择为3 h。
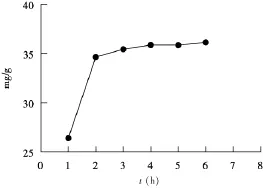
图2 提取时间考察
2.5.2 浸提次数供试品按“2.1”方法分别浸提1,2,3次,按“2.3”方法测定,结果发现 2次及 3次提取后多糖含量并无显著增加,1次已能将样品中的多糖基本提取完全。
2.5.3 醇沉倍数供试品按“2.1”方法分别以2,3,4倍体积的无水乙醇沉淀,按“2.4”方法测定,结果如图3,发现3倍体积的沉淀含量最大,因此选用3倍体积的无水乙醇沉淀多糖。
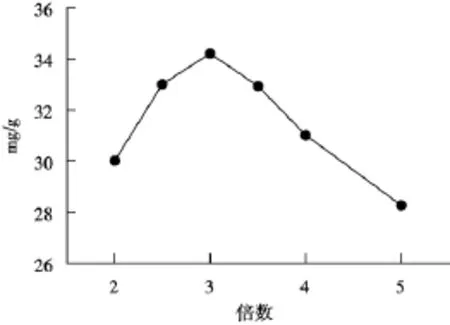
图3 醇沉倍数
2.5.4 醇沉时间供试品按“2.1”方法加入3倍体积的无水乙醇沉淀后分别于0,1,2,4,6,18 h后离心,按“2.4”方法测定,结果如图4,发现1小时后,沉淀的多糖量已达平衡。
2.6 稳定性
取3批供试液,于停止反应后0,0.5,1,2,4,6 h按“2.4”方法测定,结果如图5,发现供试液在冰浴中更加稳定,以1 h内完成测定为宜。
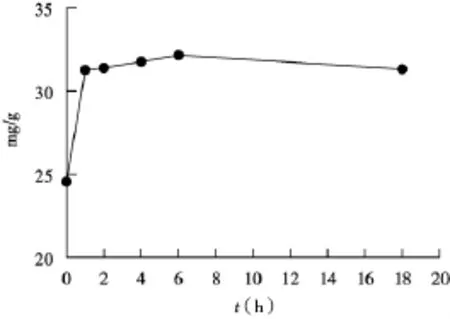
图4 醇沉时间

图5 供试液稳定性
2.7 线性关系的考察
精密量取对照品溶液0.2,0.4,0.6,0.8,1.0 mL,分别置10 mL具塞试管中,各加水补至1.0 mL,按“2.3”方法测定。以质量浓度C(mg/mL)为横坐标,吸光度A为纵坐标做标准曲线,得回归方程:
A=11.95C-0.048,
r2=0.999,表明在0.018 17~0.090 85 mg/mL浓度范围内呈良好线性。
2.8 精密度
精密量取高、中、低浓度对照品溶液(浓度分别为0.090 85,0.054 51,0.018 17 mg/mL)及样品溶液,按“2.4”方法测定,结果对照品RSD分别为0.27%(高),0.16%(中)及0.08%(低)。样品RSD 为0.54%。
2.9 重复性
取同一批样品6份制备供试液,按“2.4”方法测定,结果RSD为4.22%。
2.10 回收率
于苯酚-硫酸反应前样品溶液中分别加入适量D-无水葡萄糖,按“2.4”方法测定,结果见表1,高、中、低平均回收率分别为97.54%,100.32%及95.56%。
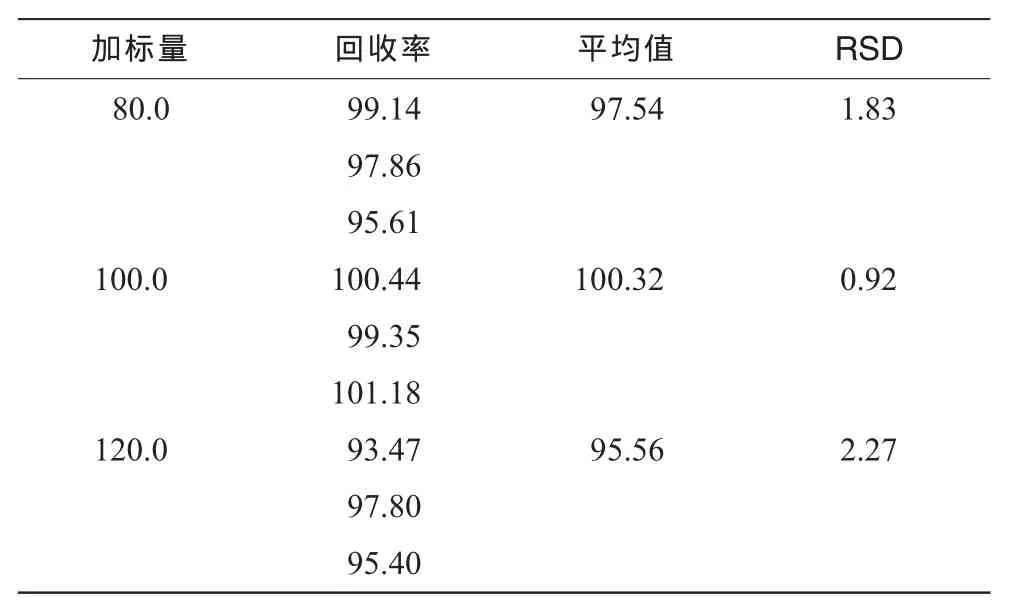
表1 分析方法回收率 (%)
2.11 样品测定
将收集的12批商品药材及3批自采原药材按“2.1”方法制备,“2.4”方法测定,结果如表2。
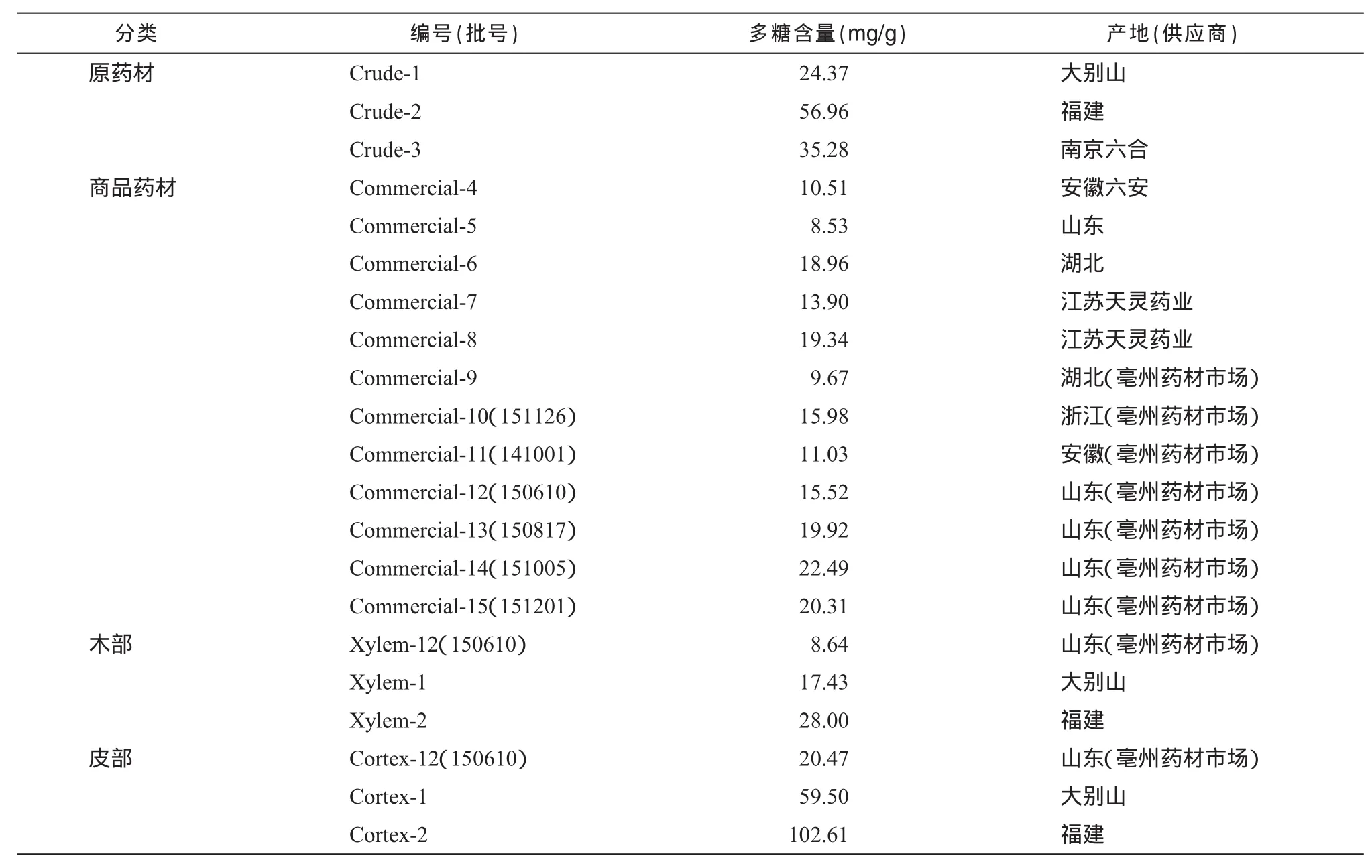
表2 样品多糖含量
3 讨论
3.1 苯酚-硫酸法是测定多糖常用的方法,但苯酚不稳定,需要临用现配,同时需要严格控制反应时间,精确到秒,反应结束后立即放入冰浴中保存待测。
3.2 藤梨根的商品药材和自采原药材有着较大的差别,由于藤梨根的根部较难挖取,商品药材往往采用的是靠近根茎的部位(地表附近),在木质部多数带有小孔,即根茎类药材特有的髓部。从测定结果可以看出商品药材的多糖含量普便偏低,同时,自采原药材的皮部与木部比例也普遍略高于商品药材,多糖的测定结果显示,皮部多糖的含量是木部的2~ 4倍。根据藤梨根的来源,根茎并非药用部位,进一步规范药材市场上藤梨根的药用部位来源,对于保证药材的质量和用药安全具有重要的意义。
[1]张昕.藤梨根多糖的分离纯化与活性研究[D].杭州:浙江大学,2010:58-60.
[2] 龙凯花,王小平,白吉庆,等.中药藤梨根抗肿瘤研究[J].中国现代中药,2013,15(10):846-849.
[3] 赫军,马秉智,赵铁,等.藤梨根的化学成分研究[J].中国药学杂志,2014,49(3):184-186.
[4] 郝旭亮,张永文.中药质量标准中建立多指标含量测定的必要性浅析[J].中国执业药师,2009,6(9):31-33.
[5] 钟方晓,任海华,李岩.多糖含量测定方法比较[J].时珍国医国药,2007,18(8):1916-1917.
[6] 张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[7] 国家药典委员会.中华人民共和国药典(2015年版)四部[M].北京:中国医药科技出版社,2015:38-40.
Determination of Polysaccharide Content in Radix Actinidiae Chinensis and Quality Evaluation of Samples from Various Origins
Wang Yaqiong1,Wen Zhiqi2,Zhong Shuisheng1,Zhang Huafeng1(1 Suzhou Institute for Food and Drug Control,Jiangsu Suzhou 215104,China;2 School of Pharmacy,Suzhou University,215123)
Objective:To investigate the method for extraction and content determination of polysaccharide in radix actinidiae chinensis so as to evaluate the quality of the drug material.Methods:The polysaccharide was extracted by water and precipitated by ethanol,and determined for polysaccharide content by phenol-sulfuric acid method at 485 nm. Results:The content of polysaccharide was 24.37~ 56.96 mg/g in crude drug substance,and 8.53~22.49 mg/g in commercial pieces.The content of polysaccharide in crude drug substance was significantly higher than that in commercial pieces,and was 2~4 times higher in cortex than in xylem.Conclusion:This method is simple,accurate and reproducible,which may be used for quality control of radix actinidiae chinensis.
Radix Actinidiae Chinensis;Polysaccharide;Phenol-sulfuric Acid Method;Content Determination;Origin;Quality Evaluation
10.3969/j.issn.1672-5433.2016.09.005
2016-04-27)
苏州市科技局科技计划项目(SYSD2013139,SYS201584)
王亚琼,女,主管中药师。主要从事中药质量评价相关问题研究。通讯作者E-mail:317888898@qq.com
