四通道色谱分离仪净化/气相色谱-质谱法测定烟叶中的多环芳烃
2016-10-13陆引罡甘信宏任文杰马文亭
马 军,滕 应,陆引罡,甘信宏,任文杰,马文亭
(1.贵州大学 农学院,贵州 贵阳 550025;2.中国科学院 南京土壤研究所 土壤环境与污染修复重点实验室,江苏 南京 210008;3.铜仁学院 材料与化学工程学院,贵州 铜仁 554300)
四通道色谱分离仪净化/气相色谱-质谱法测定烟叶中的多环芳烃
马军1,2,3,滕应2,陆引罡1*,甘信宏2,任文杰2,马文亭2
(1.贵州大学农学院,贵州贵阳550025;2.中国科学院南京土壤研究所土壤环境与污染修复重点实验室,江苏南京210008;3.铜仁学院材料与化学工程学院,贵州铜仁554300)
建立了同时检测新鲜烟叶中16种多环芳烃(PAHs)的四通道色谱分离仪净化/气相色谱-质谱(GC-MS)分析方法。样品经二氯甲烷索氏提取,四通道色谱分离仪净化,GC-MS选择离子监测模式(SIM)测定和外标法定量,重点考察了新鲜烟叶提取液的分离净化条件。结果表明:16种PAHs类化合物在10~1 000 μg/kg范围内定量离子的峰面积与质量浓度呈较好的线性关系(r>0.99)。仪器检出限(LOD)为0.35~1.75 μg/kg,方法检出限(MDLs)为1.01~2.87 μg/kg。在10,50,200 μg/kg 3个浓度水平下的加标回收率为81.0%~107.8%,相对标准偏差(RSD,n=6)为2.7%~8.0%。该方法简便、快捷、可操作性强、应用范围广,适合于烟草等作物中PAHs类化合物的分析检测。
四通道色谱分离仪;气相色谱-质谱;多环芳烃;净化;烟叶
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)可直接或通过降雨、降雪和降尘进入土壤,土壤承担了90%以上多环芳烃的环境负荷,使之成为多环芳烃的储藏库和中转站[1],最终影响农作物生长,导致农作物产量降低、品质下降[2]。而烟草是一种广泛种植的经济作物,是我国农民的重要收入来源。同时,烟叶在种植和烘烤加工过程中可能会形成多环芳烃类等持久性有机污染物,这些污染物又直接或间接的被烟叶吸收或积累,最终威胁人体健康。因此有必要建立能够快速准确检测烟叶中多环芳烃类污染残留的方法。
多环芳烃的提取净化及测定方法很多,提取方法有超声提取[3]和索氏提取[4],测定方法有气相色谱-质谱联用法(GC-MS)[5-8]和液相色谱法[9-10]。净化方法有浓硫酸磺化法[11]、硅胶层析柱净化法[12-13]、SPE柱净化法[14-18]、C18分散固相萃取法[19]、凝胶渗透色谱法[20]和中空纤维液相微萃取法等[21],其中浓硫酸磺化和硅胶层析柱净化法步骤繁琐,溶剂用量大且耗时耗力,溶剂暴露易给实验人员带来健康风险[19];SPE萃取小柱和C18分散固相萃取柱为一次性小柱,成本较高,也存在洗脱过程中溶剂暴露等问题;凝胶渗透色谱法和中空纤维液相微萃取的净化效果明显,但操作步骤较复杂,易增加实验误差,影响测定结果准确性,且实验用材料和设备均较昂贵。
针对上述净化过程中存在的问题,本文选用李清波等[22-23]自主研制的四通道色谱分离仪对烟叶提取液进行分离净化。该仪器采用程序控制的全密闭式工作环境,通过建立不同待测物的洗脱曲线,精确吸取溶剂并完成自动洗脱净化,从而减少溶剂挥发与暴露,降低偶然误差,实现待测物净化过程的标准化控制。本研究建立了四通道色谱分离/气相色谱-质谱测定烟叶中16种被美国环保署列为优先控制的PAHs的方法。该方法操作简单、灵敏可靠,可满足烟叶等作物中PAHs类化合物的检测与分析要求。
1 实验部分
1.1仪器与试剂
CHRO-400四通道色谱分离仪(赛次科技(大连)有限公司);SC-3610低速离心机(安徽 USTC Zonkia科技仪器有限公司);XW-80A涡旋震荡器(海门市其林贝尔有限公司);KQ-6OODB超声波清洗器(昆山市超声仪器有限公司);冷冻干燥机(FreeZone 2.5 Liter Freeze Dry Systems,Labconco Corp.USA);HH-6数显恒温水浴锅(国华电器有限公司);Rotavapor R-215旋转蒸发仪(BÜCHI Labortechnik AG,Switzerland);超纯水仪(Milli-Q Academic,美国Millipore公司);气相色谱-质谱联用仪(Agilent 7890A 5975C,美国Agilent公司)。

1.2实验方法
1.2.1标准溶液的配制将含有16种PAHs的浓度为100 mg/kg的标准母液用正己烷配制成10 mg/kg储备液,于4 ℃冰箱中保存。使用前配制成所需浓度的系列工作液。
1.2.2样品分析提取取新鲜烟叶置于冷冻干燥机中冷冻96 h后,用研钵研磨并过60目不锈钢筛,保存于棕色玻璃瓶中。称取1.000 0 g烟叶样品用滤纸包裹后于索氏提取管中,向茄型瓶中加入二氯甲烷溶液70 mL,于恒温水浴锅中(53 ℃)索氏提取24 h后,旋转蒸发(370 Pa,90 r/min,38 ℃)浓缩至干,用环己烷定容至2 mL待净化。
1.2.3提取液净化如图1所示,仪器背面有2个2 L棕色溶剂瓶盛装洗脱剂,玻璃色谱柱(长22.7 cm,直径10 mm,底部小孔直径5 mm)通过色谱柱安装口与导液管和收集瓶相连。工作过程密闭,机械控制,通过控制屏设定不同污染物洗脱曲线的压力和溶剂体积,可同时净化4个样品。色谱柱的装填顺序由下至上分别为筛板、5 g填料、2 g酸性硅胶(硅胶∶浓硫酸=2∶1,质量比)、1 g无水硫酸钠。仪器工作正压和负压分别设置为165 kPa和70 kPa,时间设置为25 s/次,用正己烷活化、平衡色谱柱4次(2 mL/次)。吸取0.5 mL提取液转移至色谱分离柱中,压强不变,时间设置为40 s/次,以正己烷-丙酮(4∶1)混合液洗脱6次(2 mL/次)。用带刻度的尾形瓶收集洗脱液,旋转蒸发(270 Pa,90 r/min,40 ℃)浓缩至少于1 mL,用正己烷定容至1 mL,过0.22 μm有机滤膜后装入棕色进样瓶,并保存于4 ℃冰箱中待测。
1.2.4GC-MS工作条件色谱条件:DB-5MS弹性石英毛细管柱(30 m×0.25 mm×0.25 μm);氦气(纯度>99.999%);流速为1 mL/min。升温程序:柱室初始温度为50 ℃,保持1 min,以25 ℃/min升至200 ℃,以8 ℃/min升至280 ℃,以1 ℃/min升至283 ℃,以2 ℃/min升至290 ℃,保持5 min。CTC自动以非脉冲不分流的方式进样1.00 μL,进样口温度保持250 ℃,选择SIM模式进行外标法定量分析,程序后运行温度设定为295 ℃。质谱条件:电子能量为70 eV;电子轰击(EI)离子源;离子源温度230 ℃;传输线温度260 ℃;质量扫描范围(m/z)为60~640 amu。
2 结果与讨论
2.1提取剂的选择
比较了正己烷、二氯甲烷和丙酮作为提取剂的提取效果。结果显示,以丙酮作提取剂时,回收率为75.3%~90.6%,但提取液有大量色素影响测定;以正己烷作提取剂时,提取液色素少,但提取效率低,回收率为63.5%~ 82.1%。而以二氯甲烷作提取剂时,提取效率高,回收率为82.7%~104.8%,且提取液色素少,后续的旋转蒸发浓缩耗时短。因此实验选择二氯甲烷作提取剂,能有效提取出烟叶中的PAHs类化合物。
2.2净化方法及色谱柱填料的优选
比较了层析柱(规格为:25 cm×10 mm;层析柱和四通道色谱柱中填料的装填保持一致)与四通道色谱分离仪对16种PAHs加标样品的洗脱净化效果(表1),洗脱剂均为正己烷-丙酮(4∶1)。结果表明:相比层析柱法,四通道色谱分离仪的洗脱回收率高,精密度好,溶剂用量少,耗时短。

表1 层析柱和四通道色谱分离仪净化方法比较(n=6)Table 1 Comparison of two purification methods(n=6)
实验还比较了3种填料类型对烟叶中16种PAHs回收率的影响情况。填料类型Ⅰ:酸性硅胶/色谱柱填料/无水硫酸钠(质量比2∶5∶1);填料类型Ⅱ:酸性硅胶/硅胶/无水硫酸钠(质量比2∶5∶1);填料类型Ⅲ:酸性硅胶/无水硫酸钠(质量比2∶6)。结果表明:选择填料类型Ⅰ时,回收率为87.3%~103.4%,能满足净化要求。
采用四通道色谱分离仪净化后烟叶样品的色谱图见图2,从图中可观察到样品的杂质峰较未净化样品显著减少,有利于准确定量。
2.3洗脱条件的选择
比较了正己烷、丙酮、正己烷-丙酮(4∶1) 3种洗脱剂的洗脱净化效果,结果表明以正己烷-丙酮(4∶1)作洗脱液时,其回收率为94.4%~106.3%,洗脱效率高,杂质少,效果最佳。因此选择正己烷-丙酮(4∶1)为洗脱剂。
在上述优化条件下,采用“1.2.4”GC-MS分析程序对标准溶液及某烟叶样品进行分离,各目标化合物能够得到有效分离(见图3)。
图316种PAHs标准液(A)及烟叶样品(B)的色谱图(1 mg/kg)
Fig.3Chromatograms of 16 kinds of PAHs(1 mg/kg) standard(A) and an tobacc sample(B) 1.Nap,2.Any,3.Ane,4.Flu,5.Phe,6.Ant,7.Fla,8.Pyr,9.Chr,10.BaA,11.BbF,12.BkF, 13.BaP,14.IP,15.DBA,16.BghiP
2.4线性范围与检出限
在优化条件下,选择目标化合物定量离子的峰面积(y)为纵坐标,相应的质量浓度(x,μg/kg)为横坐标,拟合16种PAHs的线性回归方程(表2)。结果显示,16种PAHs的线性范围均为10~1 000 μg/kg,相关系数(r)大于0.99,表明各化合物具有良好的线性关系。按3倍信噪比(S/N=3)计算仪器的检出限(LOD),得LOD为0.35~1.75 μg/kg。按照样品分析方法,准确吸取100 μL 1 000 μg/kg的16种PAHs混合标准液加入样品中,重复实验7次,计算方法检出限MDLs(MDLs=S×t(n-1,0.99),式中S为标准偏差,t(n-1,0.99)=3.143表示自由度为n-1、置信度为99%时的t值[25-26])。结果表明,16种PAHs的MDLs为1.01~2.87 μg/kg,方法的灵敏度能够满足烟叶中PAHs的分析要求。

表2 16种PAHs的线性范围、保留时间、回归方程、相关系数与检出限Table 2 Linear ranges,retention times,regression equations,coefficient correlations(r),limits of detection(LODs) and method detection limits(MDLs) of 16 PAHs
x:mass concentration of PAHs,μg/kg;y:peak area of PAHs
2.5精密度与准确度
按照本方法对烟叶样品进行10,50,200 μg/kg 3个水平的加标回收实验,每一浓度水平重复6次。结果表明,烟叶样品中16种PAHs的回收率为81.0%~107.8%,相对标准偏差(RSD)为2.7%~8.0%(见表3),方法的精密度与准确度能够满足烟叶样品中PAHs的分析测定要求。
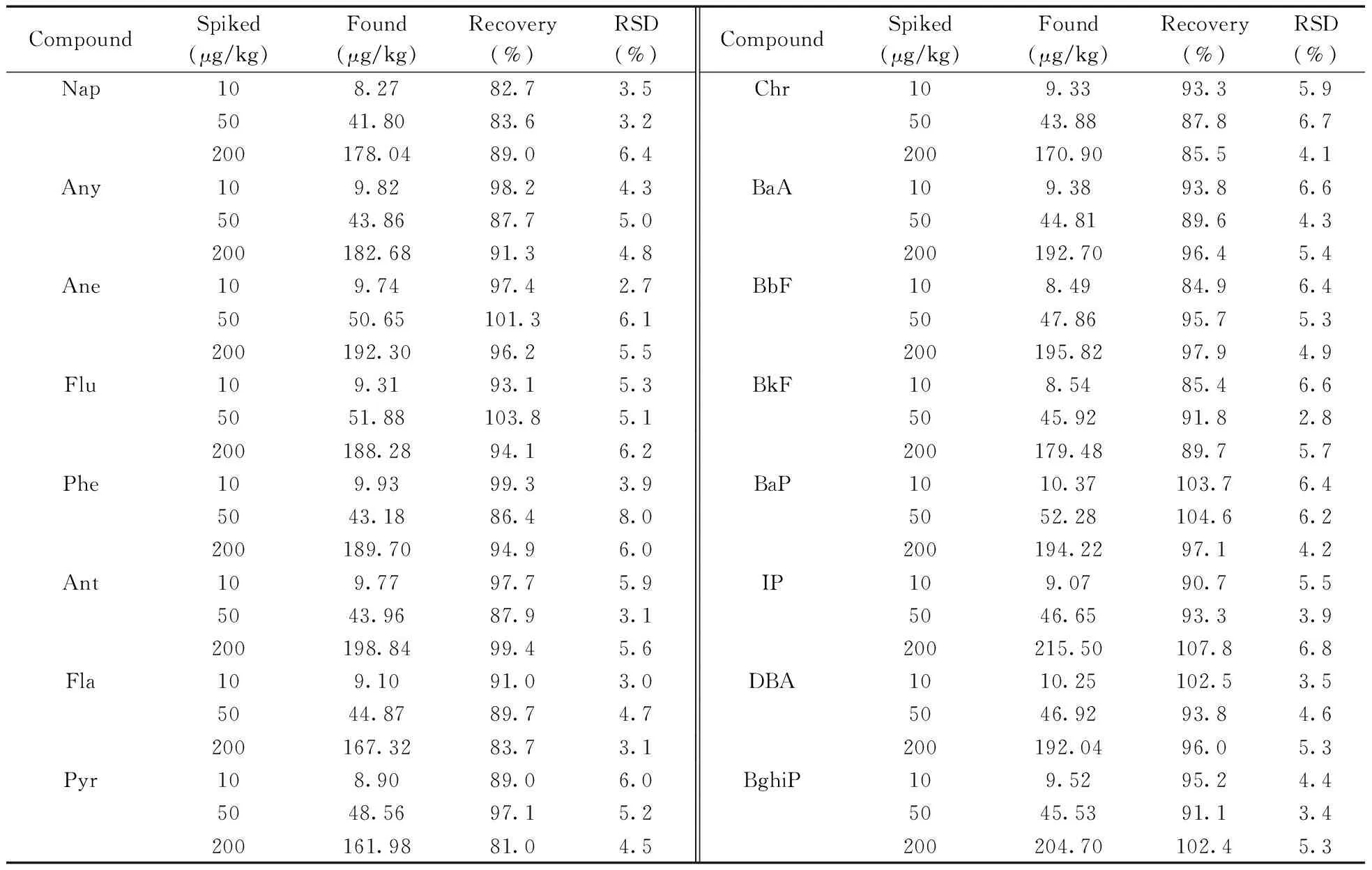
表3 烟叶样品中16种PAHs的加标回收率及相对标准偏差Table 3 Spiked recoveries and relative standard deviations(RSDs) of 16 PAHs in tobacco samples
2.6实际样品分析
采用本方法测定了采自贵州的10个新鲜烟叶样品,测定结果见表4。样品中16种PAHs 的总含量为130.01~840.40 μg/kg,其中苯并[a]芘的含量最高,为74.47~243.44 μg/kg。
表4烟叶中16种PAHs的含量
Table 416 PAHs contents in tobacco leafw/(μg·kg-1)
*no detected
3 结 论
本文建立了四通道色谱分离/气相色谱-质谱测定烟叶中多环芳烃的新方法。与传统的硅胶柱层析净化法相比,四通道色谱分离仪净化法具有洗脱率高、溶剂用量少、耗时短、精密度好等优点。该方法简便、快捷、灵敏度高,适合于烟草等作物中PAHs化合物的分析测定。
[1]Peng H,Wang W S.Environ.Monit.Chin.(彭华,王维思.中国环境监测),2009,25(2):61-62,68.
[2]Wang H C,Hu L L,Li M,Chen W F,Wang Y,Zhou J J.Chin.J.PlantEcol.(王海翠,胡林林,李敏,陈为峰,王莹,周佳佳.植物生态学报),2013,37(12):1123-1131.
[3]Sun R X,Ke C L,Lin Q,Shi F Q.J.Instrum.Anal.(孙闰霞,柯常亮,林钦,石凤琼.分析测试学报),2013,32(1):57-63.
[4]Bi H L,Zhang H Y,Sun C X,Rao Y,Su L K.J.Instrum.Anal.(毕鸿亮,张浩原,孙翠香,饶勇,苏流坤.分析测试学报),2007,26(4):530-532.
[5]Buczyńska A J,Geypensa B,Grieken R V,Wael K D.Microchem.J.,2015,119(3):83-92.
[6]Sánchez N E,Jesús S,Callejas A,ngela M,Bilbao R,María U A.Fuel,2013,107(5):246-253.
[7]Dong J,Li F,Xie K.J.Hazard.Mater.,2012,243(12):80-85.
[8]Céline L,Maurice M,Stéphane L C.Talanta,2015,131(1):386-394.
[9]Wang H J,Liu L,Liu Z H,Wu J W,Li Y,Yang Z J,Chen X Y,Chen Q Y,Li B,Yu S Y.Phys.Test.Chem.Anal.:Chem.Anal.(王宏菊,刘丽,刘志红,吴景武,李英,杨左军,陈向阳,陈麒宇,李彬,余淑媛.理化检验:化学分册),2009,45(5):546-548,551.
[10]Zheng X Y,He L J,Zhang K G,Jiang X M,Xiang G Q,Liu J P.J.Instrum.Anal.(郑小焱,何丽君,张凯歌,江秀明,向国强,刘建平.分析测试学报),2014,33(5):566-571.
[11]Cui Y H,Ju T Z,Cao J,Tao P.J.Agro-Environ.Sci.(崔艳红,巨天珍,曹军,陶澎.农业环境科学学报),2003,22(3):364-367.
[12]Tang L L,Tang X Y,Zhu Y G,Zheng M H,Miao Q L.Environ.Int.,2005,31(6):822-828.
[13]Ma L L,Chu S G,Wang X T,Cheng H X,Liu X F,Xu X B.Chemosphere,2005,58(10):1355-1363.
[14]Cao X L,Yang X Q,Liu S H.Chin.J.HealthLab.Technol.(曹小丽,杨晓倩,刘素华.中国卫生检验杂志),2013,23(12):2580-2582,2629.
[15]Zhang X,Liu X W,Luo M,Wang L,Li H,Wang D,Xu Y P.Environ.Chem.(张茜,刘潇威,罗铭,王璐,李红,王迪,徐亚平.环境化学),2011,30(4):771-777.
[16]Xu P J,Zhang T,Ren Y,Qi L,Yang W L,Huang Y R.J.Instrum.Anal.(许鹏军,张烃,任玥,齐丽,杨文龙,黄业茹.分析测试学报),2012,31(9):1126-1131.
[17]Li Z,Chen L,Gao H W,Yuan Y,Zhao J F.Environ.Chem.(李竺,陈玲,郜洪文,袁园,赵建夫.环境化学),2006,25(4):503-507.
[18]Siemers A K,Mänz J S,Palm W U,Ruck W K.Chemosphere,2015,122(3):105-114.
[19]Wang L,Jin F,Li M J,Liu M,Jiao B N,Shao H,Jin M J,Wang J.Chin.J.Anal.Chem.(王丽,金芬,李敏洁,刘明,焦必宁,邵华,金茂俊,王静.分析化学),2013,41(6):869-875.
[20]Wang J H,Guo C,Pang G F,Zhang Y B.J.Instrum.Anal.(王建华,郭翠,庞国芳,张艺兵.分析测试学报),2009,28(3):267-271.
[21]Ratola N,Alves A,Kalogerakis N,Psillakis E.Anal.Chim.Acta,2008,618:70-78.
[22]Li Q B,Luo Y M.ChinaPatent(李清波,骆永明.中国专利),200420054236.5.[2006-08-16].
[23]Li Q B,Luo Y M,Liu W X.ChinaPatent(李清波,骆永明,刘五星.中国专利),201110308122.3.[2012-06-20].
[24]Ma J,Teng Y,Lu Y G,Ren W J,Ma W T.Chin.J.Anal.Lab.(马军,滕应,陆引罡,任文杰,马文亭.分析试验室),2016,35(2):171-175.
[25]Huang Y J,Chen Y S,Luo Y M,Zhang H B,Song J.Environ.Chem.(黄玉娟,陈永山,骆永明,章海波,宋静.环境化学),2013,32(4):658-665.
[26]Ma J,Teng Y,Ma W T,Lu Y G.Phys.Test.Chem.Anal.:Chem.Anal.(马军,滕应,马文亭,陆引罡.理化检验:化学分册),2016,52(4):392-396.
Determination of 16 Polycyclic Aromatic Hydrocarbons in Tobacco(NicotianaTabacum L.) by Four-channel Chromatograph Purification Coupled with Gas Chromatography-Mass Spectrometry
MA Jun1,2,3,TENG Ying2,LU Yin-gang1*,GAN Xin-hong2,REN Wen-jie2,MA Wen-ting2
(1.College of Agriculture,Guizhou University,Guiyang550025,China;2.Key Laboratory of Soil Environment and Pollution Remediation,Institute of Soil Science,Chinese Academy of Sciences,Nanjing210008,China;3.Collge of Materials and Chemistry,Tongren University,Tongren554300,China)
A method for the simultaneous determination of 16 polycyclic aromatic hydrocarbons(PAHs) in tobacco by four-channel chromatograph purification coupled with gas chromatography-mass spectrometry(GC-MS) was developed.The tobacco samples were extracted by the method of soxhlet extraction with dichloromethane,and the extract was cleaned with four-channel purification chromatograph.The eluent were determined by GC-MS in SIM mode,and quantitated by a method of external standard.The procedure of separation and purification for fresh tobacco extraction was optimized.The results indicated the calibration curves of 16 PAHs had good linear relationships in the range of 10-1 000 μg/kg(r>0.99).The detection of limits(LODs) and method detection limits(MDLs) were 0.35-1.75 μg/kg and 1.01-2.87 μg/kg,respectively.The recoveries at three spiked concentration levels were in the range of 81.0%-107.8%with relative standard deviations(RSD,n=6) of 2.7%-8.0%.The method is suitable for the determination of PAHs in tobacco or other crops with easy operation,rapidness,high repeatability and strong practicability.
four-channel purification chromatograph;gas chromatography-mass spectrometry(GC-MS);polycyclic aromatic hydrocarbons(PAHs);purification;tobacco
2015-11-09;
2016-03-30
环保公益性行业科研专项项目(201109018)
陆引罡,博士,教授,研究方向:植物生理与遗传,Tel:13809418667,E-mail:agr.yglu@gzu.edu.cn
10.3969/j.issn.1004-4957.2016.08.007
O657.63;O625.15
A
1004-4957(2016)08-0968-06
