铝掺杂表面分子印迹聚合物修饰电极检测食品中罗硝唑残留
2016-10-13赵海青江梦银冯莹莹吴安乐詹晓珠
赵海青,江梦银,冯莹莹,吴安乐,詹晓珠,邓 健*
(1.南华大学 化学化工学院,湖南 衡阳 421001;2.福建省三明市农产品质量安全检验中心,福建 三明 365000)
铝掺杂表面分子印迹聚合物修饰电极检测食品中罗硝唑残留
赵海青1,江梦银1,冯莹莹1,吴安乐1,詹晓珠2,邓健1*
(1.南华大学化学化工学院,湖南衡阳421001;2.福建省三明市农产品质量安全检验中心,福建三明365000)
以罗硝唑(Ronidazole,RNZ)为模板,3-氨丙基三乙氧基硅烷为功能单体,Al(Ⅲ)为路易斯酸掺杂剂,用溶胶-凝胶法制备核壳型磁性分子印迹聚合物,借助磁力作用将其修饰于磁性玻碳电极表面,制得RNZ电化学印迹传感器。以透射电镜、红外光谱、X-射线衍射及电化学方法等对该传感器进行表征,并对影响传感器性能的主要参数进行优化。结果表明,相比基于非掺杂印迹聚合物和非分子印迹聚合物的传感器,铝掺杂印迹传感器对罗硝唑具有更强的结合能力和更高的识别选择性。用差分脉冲溶出伏安法进行定量测定时,RNZ的还原峰电流与其浓度在0.05~50.0 μmol/L范围内呈良好线性关系(r=0.997 3),检出限为0.015 μmol/L。对牛奶、鸡蛋中RNZ的回收率为88.6%~97.0%,相对标准偏差(RSD)为2.9%~4.6%。
罗硝唑;磁性表面分子印迹聚合物;差分脉冲溶出伏安法;铝掺杂
药物在食品动物、畜禽饲料或添加剂中的不合理使用以及滥用,可导致可食性动物组织中的药物残留。当人食用了兽药残留超标的动物性食品后,会在体内蓄积,产生过敏、畸形、癌症等严重后果。因此世界各国都制定了相关法规严格限用或禁用这类药物。罗硝唑(Ronidazole,RNZ)等硝基咪唑类药物属于禁用药物,但常在可食性动物组织中被检出[1-3]。因此食品动物、饲料及相关产品中RNZ的检测新方法正成为食品检验学的重要研究课题之一。目前,RNZ的测定方法主要有色谱法[4-5]和毛细管电泳法[6],这些方法虽然具有较高的灵敏度和准确度,但操作步骤繁琐、仪器设备昂贵,因此难以被广泛应用。近年来,电化学传感器凭借其灵敏、准确、简便、廉价、选择性高等特性,已成为分析化学领域的研究热点之一[7-8]。
本研究以RNZ为模板,3-氨丙基三乙氧基硅烷(APTES)为功能单体,Al(Ⅲ)为路易斯酸掺杂剂,用溶胶-凝胶法制备核壳型磁性分子印迹聚合物,并用该聚合物修饰磁性玻碳电极,构建RNZ电化学传感器,建立了差分脉冲溶出伏安法(DPSV)测定食品中RNZ残留的电分析新方法。该传感器在牛奶、鸡蛋等相关产品痕量RNZ的检测中,表现出良好的选择性、稳定性及重现性。
1 实验部分
1.1试剂与仪器
RNZ、甲硝唑、地美硝唑、四乙氧基硅烷(TEOS)、APTES均为分析纯;0.1 mol/L磷酸盐缓冲液(PBS,pH 3.0~7.0):由磷酸、磷酸二氢钾和磷酸氢二钠(均为0.1 mol/L)配制。25 mmol/L的RNZ储备液由无水乙醇配制。在电化学实验前,先取适量该储备液溶于一定体积的PBS中,得到所需浓度的RNZ供试液。实验用水为二次蒸馏水;牛奶和鸡蛋购于本地超市。
IR Prestige-21型傅立叶变换红外光谱仪(Shimadzu公司,日本);JEM-2010型透射电镜(JEOL,日本);BHV-55型振动样品磁力计(Riken,日本);Delta-320 型pH计(上海天美科学仪器有限公司);CHI660C电化学工作站(上海辰华仪器有限公司),采用常规三电极电解池,裸电极或表面修饰电极为工作电极,饱和甘汞电极(SCE)为参比电极,铂片电极为对电极。所有试验均在室温下进行。每次实验前,电解质溶液均需通氮(10 min)除氧。
1.2磁性表面分子印迹聚合物(MMIP)的制备
硅胶包裹的核壳型磁性纳米离子(Fe3O4@SiO2)按文献[8]方法制备。MMIP的制备按前期报道的方法略加以改良[9]。将0.400 0 g Fe3O4@SiO2超声分散于30 mL乙醇中,加入360.3 mg(1.8 mmol) RNZ和1.5 mL(6.4 mmol) APTES。搅拌20 min,再加入4.0 mL(17.9 mmol) TEOS、1.3 mL 1.0 mol/L(1.3 mmol) 三氯化铝溶液和1.0 mL 0.01 mol/L盐酸,搅拌下室温反应12 h。用磁铁分离所得产物,乙醇清洗,60 ℃真空干燥8 h。模板分子用甲醇-醋酸(9∶1,体积比)反复洗脱,直至洗涤液用DPSV法检测不出RNZ。最后将去除模板后的MMIP用甲醇洗除残留的醋酸,60 ℃干燥过夜。作为对比,用同样方法,在不加三氯化铝的条件下制备无Al(Ⅲ)掺杂的磁性表面分子印迹聚合物(Al-free-MMIP);在不加模板分子的条件下制备磁性非分子印迹聚合物(NIP)。
1.3罗硝唑-磁性表面分子印迹聚合物修饰电极的制备
磁性玻碳电极(MGCE)依次用0.3,0.05 μm Al2O3粉末和水的混合物打磨成光滑镜面,再分别用硝酸(1∶1)、丙酮和乙醇超声清洗5 min,用水洗涤,室温下晾干。将1.0 mg MMIP超声分散于1 mL乙醇-水(1∶1,体积比)中。取10 μL该悬浮液均匀滴涂于MGCE表面,空气中晾干,即制得磁性表面分子印迹聚合物修饰电极(MMIP/MGCE)。以同样方法制备无Al(Ⅲ)掺杂MMIP修饰电极(Al-free-MMIP/MGCE)和NIP修饰电极(NIP/MGCE)。
1.4电化学检测
以CHI660C电化学工作站为检测平台,采用常规三电极电解池,以MMIP/MGCE为工作电极、饱和甘汞电极为参比电极、铂片为对电极。测定前,将工作电极浸入5.0 mL RNZ供试液,室温缓慢搅拌预富集10 min后取出,用水洗去可能吸附的杂质,氮气干燥。然后将其放入5.0 mL 0.10 mol/L PBS(pH 3.0~7.0)中,用DPSV在0.0~-1.0 V范围扫描,脉冲宽度40 ms,电位增量4 mV,脉冲幅度50 mV。以RNZ的阴极还原峰电流强度结合校正曲线法对其进行定量分析。所有检测均在室温下进行。交流阻抗谱测试的工作电位为0.30 V,频率范围为10 mHz~100 kHz,振幅为5 mV。
1.5试样的制备
准确称取5.000 g奶粉或经均质处理的鸡蛋液,置于50 mL聚丙烯离心管中,加入15 mL 10%(质量分数)的三氯乙酸溶液,涡旋1 min,于3 500 r/min离心10 min。上清液过0.45 μm滤膜,滤液用水定容至50.0 mL待检。
2 结果与讨论
2.1分子印迹传感器的表征
2.1.1红外光谱表征纳米Fe3O4,Fe3O4@SiO2和MMIP的傅立叶变换红外光谱如图1所示。图1a中588 cm-1处呈现Fe—O的特征吸收峰[10-11]。图1b中1 096,795,470 cm-1为Si—O的特征峰[10,12-13],表明Fe3O4纳米粒子表面成功包覆了SiO2。图1c中1 560 cm-1处的N—H吸收峰和2 975 cm-1处的C—H 吸收峰说明氨丙基已成功接枝到Fe3O4@SiO2表面[14-15],1 068 cm-1处的Al—O吸收峰说明Al(Ⅲ)已成功掺杂到MMIP中[16]。
2.1.2透射电镜图、能谱图及磁特性分析图2A,B分别为Fe3O4@SiO2和MMIP的透射电镜图。由图可见清晰的核壳型结构,Fe3O4,Fe3O4@SiO2和MMIP的粒径分别约为60,100,125 nm。由此可计算出分子印迹层的厚度约为12 nm。相应的能谱图(C)表明铝离子已成功掺杂到MMIP中,与红外光谱分析结果相吻合。
磁滞回线分析结果表明,随着磁性组分所占比例逐步减少,饱和磁化强度由62.8 emu/g(Fe3O4)经25.5 emu/g(Fe3O4@SiO2)降至13.9 emu/g(MMIP),但MMIP足以被磁性电极吸引而稳固地粘附在电极表面[17]。
2.1.3电极的有效表面积用循环伏安法研究了MMIP/MGCE,Al-free-MMIP/MGCE,NIP/MGCE和裸电极的电活性表面积。以含有0.1 mol/L KCl的1.0 mmol/L K3Fe(CN)6为电化学探针,测定其在不同扫描速率下的循环伏安曲线。对于室温(25 ± 2) ℃下的可逆反应,电极的有效表面积可根据Randles-Sevcik公式进行估算[18]:Ip=(2.69×105)n3/2AD1/2v1/2C0,式中Ip为峰电流,n为反应中电子转移数,A为电极的有效表面积(cm2),D为扩散系数(cm2/s),v为扫描速率(V/s),C0为铁氰化钾的浓度(mol/L)。已知1.0 mmol/L铁氰化钾在0.1 mol/L KCl溶液中n=1,D=7.6×10-6cm2/s。根据Ip和v1/2线性关系的斜率可计算出相应电极的有效表面积。结果表明,MMIP/MGCE的有效表面积为0.065 5 cm2,是Al-free-MMIP/MGCE(0.0547 cm2)的1.20倍、NIP/MGCE(0.0504 cm2)的1.30倍、裸电极(0.030 3 cm2)的2.16倍,说明核壳型磁性纳米粒子的大比表面积和MMIP表面存在的印迹空穴显著增加了MMIP/MGCE的有效表面积。此外,Al(Ⅲ)掺杂也能增加电极的有效表面积。
2.1.4电化学阻抗谱分析考察了不同电极在2.0 mmol/L 铁氰化钾中测得的电化学阻抗谱图(见图3)。结果显示,裸电极的阻抗(曲线a)为1.8 kΩ。当磁性玻碳电极表面修饰MMIP后,阻抗增至4.1 kΩ(曲线b)。将MMIP/MGCE插入50 μmol/L RNZ溶液中富集10 min后,其电阻值增至5.8 kΩ(曲线c),这是因为RNZ分子占据其中的印迹空穴,阻碍了电解质溶液中探针分子向电极表面的转移。NIP/MGCE的电荷转移阻抗为12.5 kΩ(曲线d),明显高于MMIP/MGCE,说明致密而绝缘的NIP对电荷转移具有更大的阻碍作用。这些结果证明分子印迹传感器已成功制备。
2.1.5RNZ的循环伏安行为测试了50 μmol/L RNZ供试液在不同电极上的循环伏安行为(图4)。由图4A可见,裸电极(曲线a)、Al-free-MMIP/MGCE(曲线b)和MMIP/MGCE(曲线c)在-0.55 V处均有一不可逆的还原峰。在MMIP/MGCE上的还原峰电流(Ip=9.241 μA)是Al-free-MMIP/MGCE(Ip=6.390 μA)的1.45倍,是裸电极(Ip=3.932 μA)的2.35倍,说明印迹聚合物中掺杂铝能显著提高RNZ的富集效率。由于NIP/MGCE没有RNZ的特异性结合位点,故在NIP/MGCE上(曲线d)几乎无RNZ的峰电流信号。
同时研究了不同电位和扫描速率对MMIP/MGCE响应RNZ的影响。如图4B所示,在0.02~0.26 V/s的扫描速率范围内,Ip(μA)随着扫描速率v(mV/s)的增加而线性增加,其线性方程为Ip=2.555 3+15.787v(r=0.992 8),说明RNZ在MMIP/MGCE上的还原是不可逆的表面吸附控制过程。
图4不同电极在50 μmol/L RNZ中富集10 min的循环伏安图(A)以及MMIP/MGCE 在不同扫速下的循环伏安图(B)
Fig.4Cyclic voltammograms of different electrodes(A) after incubated in 50 μmol/L of RNZ solution for 10 min and cyclic voltammograms of MMIP/MGCE at different scan rates(B) A:bare MGCE(a),Al-free-MMIP/MGCE(b),MMIP/MGCE(c),NIP/MGCE(d);B:50 μmol/L of RNZ in phosphate buffer(pH 5.0), insert:linear relationship between scan rates and reduction peak currents
2.2实验条件的优化
2.2.1功能单体、交联剂及掺杂剂用量的选择影响印迹效果的关键因素是功能单体的种类及用量。由合适的功能单体与模板分子相互作用所形成的印迹位点,在模板被洗脱之后,仍能保持与模板分子互补的形状、大小及官能团空间分布,因而具有较强的识别和再结合模板分子的能力。本实验选用的APTES可与RNZ产生氢键相互作用;掺杂剂中的Al(Ⅲ)部分替换硅氧凝胶三维骨架中的Si(Ⅳ)[8],由此形成的路易斯酸中心与RNZ分子中含孤对电子的氧/氮原子产生配位相互作用。配位相互作用比氢键更具方向性,因而赋予传感器更高的识别选择性。以RNZ在MMIP/MGCE上的还原峰电流作为评价指标,采用单因素与正交试验相结合的方法对功能单体、交联剂和掺杂剂的用量进行优化。结果表明,RNZ、APTES、TEOS和三氯化铝的最优用量比(mmol)为1.8∶6.4∶17.9∶1.3。
2.2.2MMIP用量的选择保持MMIP悬浮液体积为10 μL,用DPSV法探讨MMIP浓度(0.1,0.5,1.0,1.5,2.0 mg/mL)与峰电流的关系。结果显示,增加MMIP悬浮液浓度,峰电流逐渐增大,在1.0 mg/mL 时峰电流达到峰值,之后逐渐降低。因此选择10 μL 1.0 mg/mL的MMIP悬浮液修饰MGCE,可使传感器获得最高的灵敏度。
2.2.3支持电解质种类与溶液pH值的选择以MMIP/MGCE为工作电极,探讨了不同种类不同浓度的支持电解质溶液的影响,包括pH 1.0~5.0的柠檬酸钠-盐酸缓冲液、pH 3.0~7.0 的PBS和pH 2.0~10.0 的Britton-Robinson(B-R)缓冲液。结果表明,相同浓度的RNZ在pH 5.0的0.10 mol/L PBS中响应值最大。因此选择pH 5.0的0.10 mol/L PBS作为支持电解质。
2.2.4富集时间与富集电位的选择考察了50 μmol/L RNZ供试液在MMIP/MGCE上的响应值随富集时间的变化。当富集时间在 4~10 min 范围内,峰电流随着富集时间的增加呈快速增加趋势,10 min 时达到最大,此后趋向稳定,说明印迹传感器表面的印迹位点与RNZ的结合已达饱和。当富集电位从0.20 V向-0.50 V移动时,峰电流无明显增加,说明富集电位的大小不影响富集效率。因此,实验选择在开路电位下富集10 min。
2.3分子印迹传感器的性能
2.3.1校正曲线、检出限与定量下限在优化实验条件下,按“1.4”方法用DPSV检测一系列不同浓度RNZ的标准液。结果表明,在0.05~50.0 μmol/L范围内RNZ的还原峰电流(Ip,μA)与其浓度(c,μmol/L)呈良好的线性关系,线性回归方程为Ip=0.170 5+0.021 1c,r=0.997 3,检出限(S/N=3)为0.015 μmol/L,定量下限(S/N=10)为0.050 μmol/L。
2.3.2MMIP/MGCE的选择性、重现性与稳定性按“1.4”方法分别测定不同浓度甲硝唑、地美硝唑与5.0 μmol/L RNZ的混合溶液,再比较该混合溶液与5.0 μmol/L RNZ标准溶液的峰电流响应值。结果表明,当甲硝唑、地美硝唑的浓度分别低于RNZ的5.0倍时,不会干扰RNZ的测定(由干扰物引起的误差小于5%),证明该RNZ传感器具有良好的选择性。
用6支同批次制备的MMIP/MGCE分别测定50.0 μmol/L RNZ标准液,相对标准偏差(RSD)为5.6%;用同一支电极连续5次测定50.0 μmol/L RNZ标准液,RSD为4.3%;取同一支电极,每3 d测定1次50.0 μmol/L RNZ标准液,测定间隙将电极在干燥条件下室温保存。15 d后该电极的信号为初始响应值的95.3%,30 d后降至85.0%。表明该传感器具有良好的重现性和稳定性。
2.4实际样品中RNZ的检测
按优化的实验方法测定牛奶和鸡蛋中的RNZ含量,并通过加标回收实验评价方法的准确性,结果见表1。牛奶和鸡蛋样品的回收率为88.6%~97.0%,RSD为2.9%~4.6%。
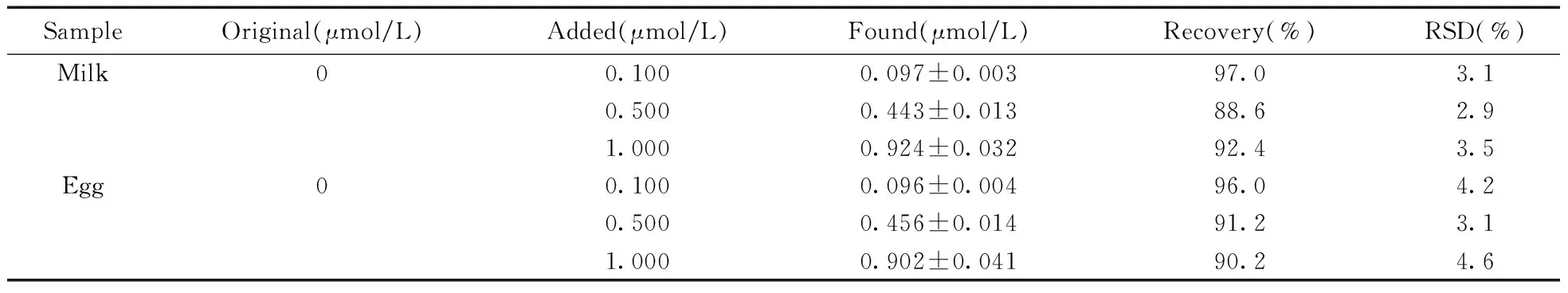
表1 牛奶和鸡蛋中RNZ的测定结果与加标回收率(n=3)Table 1 Determination results and spiked recoveries of RNZ in milk and egg samples(n=3)
3 结 论
本文以RNZ为模板,APTES为功能单体,TEOS为交联剂,三氯化铝为掺杂剂,制备了基于核壳型磁性表面分子印迹聚合物的RNZ传感器。Al(Ⅲ)掺杂在印迹聚合物的识别位点嵌入路易斯酸中心,由此形成的配位相互作用使印迹位点对模板分子具有更高的识别选择性和更强的再结合能力。将该传感器用于牛奶和鸡蛋中RNZ的残留量检测,方法的精密度、回收率和稳定性均可达到要求。
[1]Cristina M S,Zoraida S F,MaEsther T P,José Juan S R.Anal.Chim.Acta,2010,665:113-122.
[2]Wang Y,Zheng C Y,He F,Ye L H.FoodSci.(王扬,郑重莺,何丰,叶磊海,食品科学),2011,32(20):197-199.
[3]Li C Y,Wu M,Yan L J,Zeng S M,Xu D M,Zhou Y.J.FoodSaf.Qual.(黎翠玉,吴敏,严丽娟,曾三妹,徐敦明,周昱.食品安全质量检测学报),2012,3(1):18-22.
[4]Chen Z H,Huang W J,Liu X J,Fang J H.Phys.Test.Chem.Anal.:Chem.Anal.(陈张好,黄文静,刘小娟,方继辉.理化检验-化学分册),2014,50(2):184-186.
[5]Wan J C,Wang W J,Zhan C Z,Guo P.Phys.Test.Chem.Anal.:Chem.Anal.(万建春,王文君,占春瑞,郭平.理化检验-化学分册),2015,51(8):1168-1173.
[6]Maykel H M,Francisco J L,Carmen C B,Ana M,Garcia C.Talanta,2015,144:542-550.
[7]Hu C,Deng J,Xiao X,Zhan X,Xiao N,Ju S,Huang K.Electrochim.Acta,2015,158:298-305.
[8]Xiao N,Deng J,Cheng J,Ju S,Zhao H,Xie J,Qian D,He J.Biosens.Bioelectron.,2016,81:54-60.
[9]Liu W,Zhou F,Zhao X Y,Li Y,Wang X Y,Xu X M,Zhang Y W.J.Nanosci.Nanotechnol.,2014,14:3068-3072.[10]Hu C H,Deng J,Zhao Y B,Xia L S,Huang K H,Ju S Q,Xiao N.FoodChem.,2014,158:366-373.
[11]Wang X X,Yang J,Xie S Y,Chen Y,Liu F L,Shen H Y,Xia Q H.J.Instrum.Anal.(王新鑫,杨军,谢晟瑜,陈扬,刘芳伶,沈昊宇,夏清华.分析测试学报),2015,34(11):1213-1219.
[12]Chen D,Deng J,Liang J,Xie J,Huang K H,Hu C H.Anal.Methods,2013,5:722-728.
[13]Tang T,Tang C G,Zeng Y B,Li L,Pan Y D,Xu Q X,Xiao P X,Ye B Q.J.Instrum.Anal.(唐婷,汤传贵,曾延波,李蕾,潘样丹,徐启翔,肖平秀,叶冰青.分析测试学报),2015,34(11):1253-1258.
[14]Kong X,Gao R X,He X W,Chen L X,Zhang Y G.J.Chromatogr.A,2012,1245:8-16.
[15]Gao R X,Kong X,Wang X,He X W,Chen L X,Zhang Y K.J.Mater.Chem.,2011,21:17863-17871.
[16]Goldstein D N,Mccormick J A,George S M.J.Phys.Chem.C,2008,112:19530-19539.
[17]Ouyang R,Lei J P,Ju H X.Nanotechnology,2010,21:1-9.
[18]Liu L Y,Ma Z,Zhu X H,Zeng R H,Tie S L,Nan J M.Anal.Methods,2016,8(3):605-613.
Aluminum Doped Surface Imprinted Polymer Modified Electrode for Determination of Ronidazole Residue in Food
ZHAO Hai-qing1,JIANG Meng-yin1,FENG Ying-ying1,WU An-le1,ZHAN Xiao-zhu2,DENG Jian1*
(1.College of Chemistry and Chemical Engineering,University of South China,Hengyang421001,China;2.Sanming Supervision & Testing Center for Quality and Safety of Agro-products,Sanming365000,China)
An electrochemical sensor for the determination of ronidazole(RNZ) was developed based on a magnetic glassy carbon electrode modified with Al(Ⅲ) doped core-shell magnetic surface molecularly imprinted polymer(MMIP),which was prepared via the sol-gel method using RNZ as template,3-aminopropyltriethoxysilane as functional monomer,orthosilicate as cross-linker,and Al3+as dopant to generate Lewis acid sites in the silica matrix for the metal coordinate interactions with the template RNZ.The component,morphology of MMIP and the performance of the as-prepared sensor were characterized by transmission electron microscopy,Fourier transform infrared spectroscopy,powder X-ray diffraction and the electrochemical methods.Various factors affecting the response behavior of the sensor were studied and optimized.Because of the aluminum doping,the imprinted sensor exhibits the best recognition ability and affinity for RNZ in comparison with the aluminum free MMIP and the non-imprinted one.Under the optimal experimental conditions,the peak currents by differential pulse stripping voltammetry were found to vary linearly with RNZ concentrations in the range of 0.05-50.0 μmol/L with a detection limit of 0.015 μmol/L.This sensor was successfully employed to detect RNZ in milk powder and egg samples with recoveries of 88.6%-97.0%and relative standard deviations of 2.9%-4.6%.
ronidazole(RNZ);magnetic surface molecularly imprinted polymer;differential pulse stripping voltammetry;aluminum doping
2015-12-21;
2016-03-04
南华大学研究生科研创新项目(2015XCX16);湖南省科技厅项目(2013FJ3028)
邓健,硕士,教授,研究方向:食品分析,Tel:0734-8282375,E-mail:jdeng_usc@163.com
10.3969/j.issn.1004-4957.2016.08.011
O657.1;TQ460.72
A
1004-4957(2016)08-0993-06
