双去甲氧基姜黄素与姜黄素的药代动力学比较
2016-10-11张景勍蒋心惠胡雪原
陈 静, 张景勍, 杨 梅, 蒋心惠, 胡雪原*
(1.重庆医科大学 药物高校工程研究中心,重庆 400016;2.重庆市长寿区中医院,重庆 401220)
双去甲氧基姜黄素与姜黄素的药代动力学比较
陈 静1, 张景勍1, 杨 梅2, 蒋心惠1, 胡雪原*1
(1.重庆医科大学 药物高校工程研究中心,重庆 400016;2.重庆市长寿区中医院,重庆 401220)
考察了SD大鼠口服灌喂给予双去甲氧基姜黄素和姜黄素药代动力学特征。将雄性SD大鼠12只随机分为2组,分别灌服双去甲氧基姜黄素和姜黄素混悬液后,于不同时间点大鼠眼底静脉丛取血,HPLC法测定血浆中双去甲氧基姜黄素和单体姜黄素的浓度,DAS 2.1.1药动学软件计算药动学参数。结果显示,双去甲氧基姜黄素和单体姜黄素的主要药动学参数Tmax为0.75 h 和0.25 h;Cmax为(62.90±2.64)μg/L和(61.64±4.30)μg/L;AUC0~72 h为(281.75±3.61)μg/(L·h)和(171.79±32.18)μg/(L·h);AUC0~∞为(291.31±15.15)μg/(L·h)和(190.46±43.81)μg/(L·h)。表明双去甲氧基姜黄素和单体姜黄素相比有更好的生物利用度。
双去甲氧基姜黄素;姜黄素;药代动力学
姜黄中的有效成分姜黄素类化合物为姜黄属植物姜黄、郁金、莪术等干燥根茎的主要活性物质,主要含有3种主成分:单体姜黄素(curcumin,CurI,质量分数 70%); 脱甲氧基姜黄素(demet-hoxycurcumin,CurII,质量分数15%);双脱甲氧基姜黄素 (bisdemethoxycurcumin,CurIII, 质量分数10%),具有降血脂[1-2]、抗氧化[3]、清除自由基、消炎、抗肿瘤[4-6]等效果。同时姜黄素也是一种天然的、安全无毒的可食用色素,被广泛应用于食品工业[7],被认为是最有开发价值的食用天然色素之一,亦是联合国粮农组织(FAO)和世界卫生组织(WHO)所规定的使用安全性很高的天然色素之一。但姜黄素也有它的不足之处,它的极性较小,水溶性差,使其生物利用度较低。CurIII是CurI的天然衍生物,它们具有相似的药理药性,并且CurIII在结构上比CurI少两个甲氧基,其极性、亲水性、水溶性均比CurI大[8],因此CurIII可能比CurI有更高的生物利用度。本课题从理化性质、体外释放、药代动力学特征方面对二者进行对比研究,为临床研究和新药设计提供理论基础和方法。
1 材料与方法
1.1 材料
1.1.1 仪器与设备 Agilent 1100型液相色谱仪,美国Agilent公司制造;AB 204 S电子分析天平,瑞士 Mettler Toledo仪器公司制造;KQ2200B型超声波清洁器,江苏昆山市超声仪器有限公司制造;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂制造;激光粒度仪,英国Malvern公司制造;HL-1型恒流泵,上海青浦沪西仪器厂制造;THZ-82型水浴恒温振荡器,金坛市荣华仪器制造有限公司制造;TGL-16B台式高速离心机,上海安亭科学仪器厂制造;QL-901型旋涡混合器,海门市其林贝尔仪器制造有限公司制造;PHS-3C型pH测定仪,上海精科仪器有限公司制造;Milli-Q Biocel A-10型超纯水制备系统,美国Millipore公司制造。
1.1.2 药品与试剂 姜黄素(纯度>99%),作者所在实验室自制;双去甲氧基姜黄素(纯度>99%),作者所在实验室自制;尼群地平(纯度99.5%),陕西师诺生物科技有限公司产品;乙醇、乙腈、乙酸乙酯、冰醋酸、盐酸、磷酸二氢钾,均为国产分析纯。
1.1.3 实验动物 清洁级SD大鼠12只,雄性,体质量(250±20)g,由重庆医科大学实验动物中心提供,许可证号CQLA(渝)2012-1003。
1.2 方法
1.2.1 CurIII,CurI混悬液的制备 分别精密称取CurIII和CurI置于玻璃研钵中,研磨1.5 h后,称取研磨后的药物,先加入1~2滴无水乙醇作为润湿剂,然后再加入质量分数0.5%的CMC-Na超声混匀,制备淡黄色CurIII和CurI的混悬液,备用。
1.2.2 CurIII,CurI的理化性质 测定 CurIII和CurI的油水分配系数,并用马尔文粒径测定仪测定CurIII和CurI的平均粒径、Zeta电位。
1.2.3 CurIII,CurI体外释放行为的考察 采用动态透析法考察CurIII,CurI的体外释药行为,分别以含体积分数20%乙醇和质量分数0.5%SDS的pH 1.2的HCl溶液(0.1 mol/mL)和pH 6.8的磷酸盐缓冲液为释放介质,释放介质体积为100 mL,分别取1 mL的CurIII、CurI混悬液置于透析袋中,密闭置于恒温水浴振荡器中,在37℃下以100 g的速度搅拌。分别于 1、2、4、6、8、10、12、24、48、72、96、120、144、168 h取出1 mL释放介质,同时补充等温等体积的释放介质。测定所取样品的CurIII、CurI浓度,得到累积释药百分率。
1.2.4 血浆样品的采集 取健康雄性SD大鼠12只,体质量(250±20)g,随机分为两组,每组6只,分别灌喂CurIII混悬液和CurI混悬液(相当于给药量CurIII与CurI 50 mg/kg)。给药前禁食12 h,自由饮水。分别在给药后5、10、15、30、45 min,1、1.5 h等时间点于大鼠眼底静脉丛取血,肝素化后6 000 g离心10 min,吸取上清液,置于-20℃冰箱冷藏保存备用。
1.2.5 色谱条件
1)CurIII色谱条件[9-10]:Hypersil ODS色谱柱250 mm×4.6 mm,5 μm;流动相乙腈-体积分数5%冰醋酸溶液(体积比45∶55),体积流量:1 mL/min,柱温30℃,测定波长417 nm,内标 尼群地平,进样量20 μL。
2)CurI色谱条件[9-10]:Hypersil ODS色谱柱250 mm×4.6 mm,5 μm;流动相乙腈-体积分数5%冰醋酸溶液(体积比45∶55),体积流量1 mL/min,柱温30℃,测定波长426 nm,内标 尼群地平,进样量20 μL。
1.2.6 血浆样品预处理 取血浆样品200 μL置于2 mL的离心管,加入内标尼群地平工作液100 μL,再加入乙酸乙酯1.0 mL,漩涡2 min后,12 000 g离心10 min,转移上层有机相于另一离心管中,用氮气吹干仪吹干。最后用100 μL流动相复溶,取复溶液20 μL进样检测。
1.2.7 方法学考察
1)方法专属性:在此样品处理方法和色谱条件下,测定空白血浆、空白血浆+对照品+内标、血浆样品,考察方法的专属性。
2)标准曲线的建立:分别精密称取 CurIII 10.0 mg、CurI 10.0 mg、内标尼群地平(NT)5.0 mg,用少量甲醇溶解后,转移至100 mL的棕色容量瓶中定容,摇匀即得CurIII工作溶液100 μg/mL、CurI工作溶液100μg/mL、尼群地平内标工作液100 μg/mL,于4℃冰箱保存。临用时吸取CurIII、CurI工作溶液适量用甲醇稀释成质量浓度为0.5 μg/mL对照品溶液。取200 μL空白血浆于2 mL的离心管中,加入适量CurIII(500 ng/mL)对照品溶液,再加入100 μL尼群地平工作液,制备CurIII质量浓度为15,70,105,140,175,210,245 ng/mL的标准系血浆样品。按照1.2.6项下处理后进样分析,得CurIII的标准曲线。同法操作得到CurI的标准曲线。
3)精密度实验:取200 μL空白血浆,分别精密加入CurIII或CurI对照溶液,使其配成70、140、210 ng/mL的低、中、高3种质量浓度的标准血浆样品各5份,按1.2.6项下样品预处理方法,在1.2.5项色谱条件下,于一日内各测定5次,计算3种质量浓度的日内精密度;同一条件下每日测定一次,连续测定5 d,计算3种质量浓度的日间精密度。
4)回收率实验:取200 μL空白血浆,分别精密加 CurIII或 CurI对照溶液配制质量浓度为 70、140、210 ng/mL的标准血浆样品各3份,按1.2.6项下处理后进样分析。按标准曲线计算血浆中CurI或CurIII的浓度,以测定浓度与实际浓度的比率,求平均回收率。
1.2.8 数据处理方法 CurIII和CurI血药浓度-时间曲线采用DAS2.1.1软件进行非室模型 (统计矩)拟合,得到药代动力学参数。Cmax为给药后的最大血药浓度,Tmax为给药后血药浓度达峰时间,t1/2为末端消除半衰期,MRT为体内平均滞留时间,CL为清除率,血药浓度—时间曲线下面积 AUC(0-t)由梯形法计算得到。
2 结果与分析
2.1 CurIII、CurI油水分配系数测定结果
测定得到CurIII、CurI油水分配系数比值的对数值lgP分别为0.74±0.09,1.57±0.20。lgP值越小,水溶性越好,反之,水溶性越差,说明CurIII的水溶性比CurI好。
2.2 CurIII,CurI粒径及Zeta电位测定结果
通过马尔文粒径测定仪测定CurIII和CurI的平均粒径、Zeta电位分别为511.0 nm和831.9 nm,-56.5 mV和-74.5 mV。
徐清等[11]在混悬剂物理稳定性研究报道中称,Zeta电位的绝对值 >60 mV表示稳定性极强,>30 mV表示稳定性良好。谢向阳等[12]报道称,混悬液的Zeta电位绝对值超过30 mV才能维持稳定。本实验中所测定的CurIII和CurI的平均Zeta电位分别为-56.5 mV和-74.5 mV,其绝对值均>30 mV,表明该分散体系稳定性良好。
2.3 CurIII,CurI体外释放行为
CurIII、CurI的体外释放曲线见图1。可知,在相同条件下 CurIII的释放速率比 CurI更快,说明CurIII比CurI的溶解度大,药物的吸收更好。
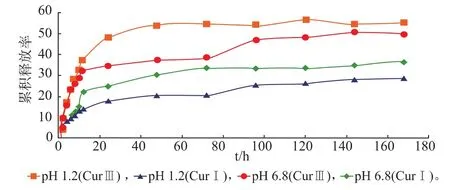
图1 CurIII,CurI在pH 1.2及pH 6.8释放介质中的体外释放行为Fig.1 Release of CurIII and CurI in release medium at pH 1.2 and pH 6.8
采用相似因子评价法,以相似因子f2为评价指标,比较释放曲线相似程度。计算公式
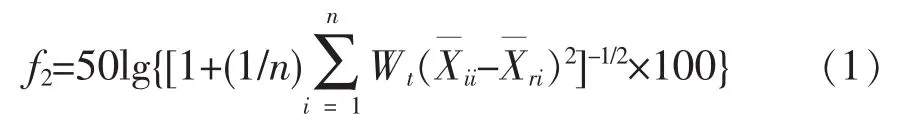
式(1)中:f2为相似因子;为t时刻参比制剂的累积释放率;为t时刻受试制剂累积释放率;n为有效取样点个数;Wt为权重,本实验设为1。当f2值介于0~50之间时,即可认为两条曲线有显著性差异;介于50~100之间时,即说明两条曲线为无显著性差异;f2值越接近100,相似程度也就越高。将实验得到的释放曲线使用上述公式进行两两拟合,计算得到相似因子f2,结果见表1。在不同pH时,CurIII、CurI两条曲线均存在显著性差异。
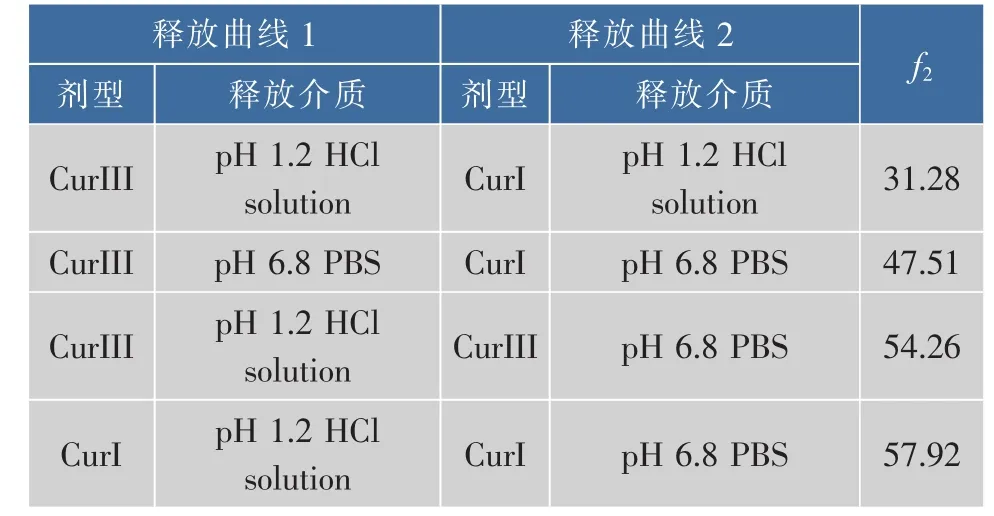
表1 CurIII,CurI在不同释放介质中释放曲线的f2比较Table1 f2of drug release curve in vitro on different released medium of CurIII and CurI
2.4 方法学考察
2.4.1 方法专属性 分别测定空白血浆、空白血浆+对照品+内标、血浆样品,表明血浆内源性物质及其他杂质在CurI、CurIII、NT的出峰位置无干扰,结果见图2、图3。

图2 关于CurI的HPLC色谱图Fig.2 High performance liquid chromatograms
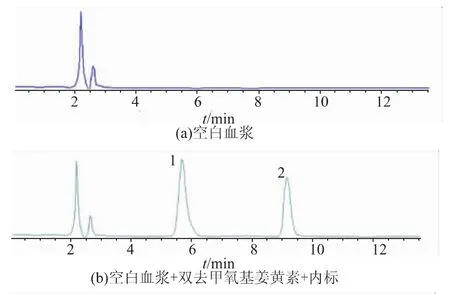
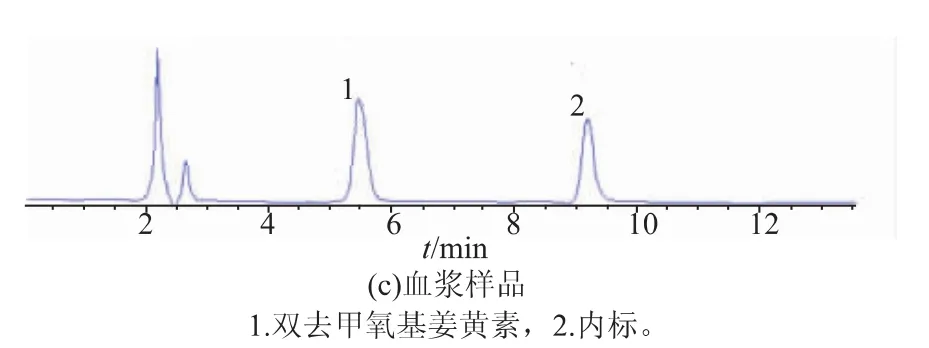
图3 关于CurIII的HPLC色谱图Fig.3 High performance liquid chromatograms
2.4.2 标准曲线的建立 以CurIII与尼群地平的峰面积比(Y)对CurIII质量浓度(C)线性回归,得回归方程
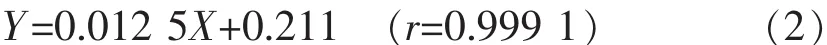
同理可得CurI的线性回归方程
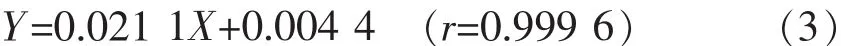
CurIII和CurI质量浓度在15~245 ng/mL内与峰面积的线性关系良好。
2.4.3 精密度实验 测定得到CurI的日内精密度的RSD分别为2.15%、1.86%、1.07%(n=5),CurIII的日内精密度的RSD分别为1.64%、2.05%、0.69% (n=5);CurI的日间精密度的RSD分别为2.28%、1.72%、0.82%(n=5),CurIII的日间精密度的RSD分别为2.52%、1.96%、1.27%(n=5)。符合生物样品分析方法的测定要求。
2.4.4 回收率实验 测定得到CurI的平均回收率分别为99.23%、99.72%和99.57%,CurIII的平均回收率分别为99.35%、99.61%和99.76%,表明本方法回收率符合含量测定方法要求。
2.5 血药浓度和药动学参数
分别以CurIII和CurI的血药质量浓度为纵坐标,时间t为横坐标作图,得到血药质量浓度—时间曲线,大鼠灌服CurIII和CurI混悬液的平均血药质量浓度—时间曲线见图4。
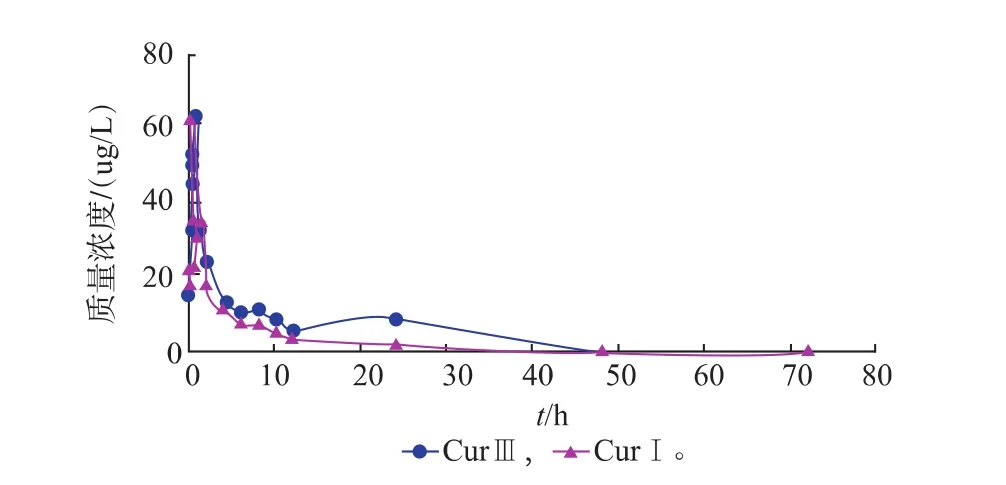
图4 CurIII,CurI的血药质量浓度—时间曲线Fig.4 Mean plasma concentration-time profiles of CurIII and CurI suspension after oral administration
药动学数据采用DAS2.1.1软件对所得实验数据进行非室模型(统计矩)拟合,CurIII和CurI主要药动学参数见表2。可知,CurIII的 AUC0~72 h为(281.75±3.61) μg/(L·h),CurI的 AUC0~72h为(171.79±32.18)μg/(L·h),CurIII是CurI的1.64倍;同样,CurIII的AUC0~∞是CurI的1.53倍;并且还可以看出CurIII的Tmax、MRT0~72 h分别是CurI的3倍、1.59倍;CurIII与CurI的Cmax无显著性差别。
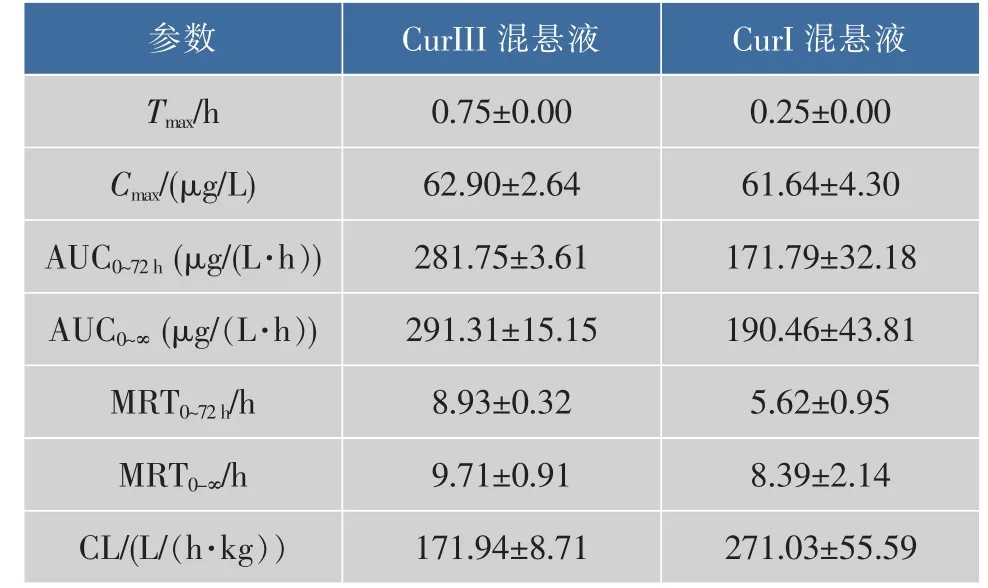
表2 SD大鼠口服CurIII和CurI混悬液的主要药动学参数Table2 Main pharmacokinetic parameters of SD rats after po CurIII and CurI suspensions
3 结语
姜黄色素在水中的溶解度较小,实验中通过对CurIII、CurI油水分配系数的测定,证实了其水溶性差,但 CurIII的 lgP值是CurI的 0.47倍,说明CurIII的水溶性比CurI好,分析原因可能是由于CurIII作为CurI的天然衍生物,比CurI少2个甲氧基,其极性、亲水性、水溶性均大于CurI。
实验中考察了CurIII、CurI的体外释放行为,由图可知,CurIII在pH1.2的HCl溶液比在pH6.8的磷酸盐缓冲液中的累计释放率大,说明CurIII在胃肠道的释放比CurI更好,口服生物利用度比CurI更高;同时在不同pH时,CurIII、CurI两条曲线之间的相似因子均小于50,表明CurIII与CurI体外释放曲线存在显著性差别,说明CurIII释放行为比CurI更好,有利于药物的吸收。
药动学拟合结果表明,CurIII的AUC0~72h、AUC0-∞是CurI的1.64倍、1.53倍,表明CurIII较CurI有更高的生物利用度,而较朱庆华课题组[13]总姜黄素的AUC(145.90 μg/(L·h))有较大的提高,可能是由于作者所在课题组使用的是姜黄素及去甲氧基姜黄素单体,单体较混合物有更好的生物利用度;同时CurIII的Tmax、MRT0~72 h、CL分别是CurI的3倍、1.59倍、0.63倍,说明CurIII达峰时间较CurI更长,体内滞留时间较CurI更长,消除率较CurI更低,生物利用度较CurI更高,为其临床研究奠定了理论基础。
[1]MOHAMMADI A,SAHEBKAR A,IRANSHAHI M,et al.Effects of supplementation with curcuminoids on dyslipidemia in obese patients:a randomized crossover trial[J].Phytother Res,2013,27(3):374-379.
[2]黄燕芬,洪行球,袁小凤.姜黄素酯化物抗平滑肌细胞增殖和调血脂作用研究[J].浙江中医药大学学报,2008,32(4):440-442. HUANG Yanfen,HONG Xingqiu,LIU Yan.Effects of ramification of curcumin esterified by succinic anhydride on anti-proliferation of bovine VSMC and regulating the lipids in hyperlipidemic mice induced by high lipid diet[J].Journal of Zhejiang University of Traditional Chinese Medicine,2008,32(4):440-442.(in Chinese)
[3]MAGRO M,CAMPOS R,BARATELLA D,et al.A magnetically drivable nanovehicle for curcumin with antioxidant capacity and MRI relaxation properties[J].Chemistry,2014,37(20):11913-11920.
[4]KIM T D,FUCHS J R,SCHWARTZ E,et al.Pro-growth role of the JMJD2C histone demethylase in HCT-116 colon cancer cells and identification of curcuminoids as JMJD2 inhibitors[J].Am J Transl Res,2014,6(3):236-247.
[5]何利兵,王险峰,王红胜,等.姜黄素衍生物体外抑制结肠癌细胞增殖侵袭作用[J].中国癌症杂志,2013,23(1):17-25. HE Libing,WANG Xianfeng,WANG Hongsheng,et al.Inhibitory effeets of curcumin derivatives on proliferation and invasion of hum an colon cancer cell line Lovo and SW 480[J].China Oncology,2013,23(1):17-25.(in Chinese)
[6]LV Z D,LIU X P,ZHAO W J,et al.Curcumin induces apoptosis in breast cancer cells and inhibits tumor growth in vitro and in vivo[J].Int J Clin Exp Pathol,2014,7(6):2818-2824.
[7]袁鹏,陈莹,肖发,等.姜黄素的生物活性及在食品中的应用[J].食品工业科技,2012,33(14):371-375. YUAN Peng,CHEN Ying,XIAO Fa,et,al.The bioactivities of curcumin and its application in foods[J].Science and Technology of Food Industry,2012,33(14):371-375.(in Chinese)
[8]姚滢,黄燕芬.二脱甲氧基姜黄素对体外HepG2 Caspase-3活性的影响[J].中华中医药学刊,2014,32(3):493-495.YAO Yin,HUANG Yanfen.Effect of B Isdemethyoxycurcumin on Caspase-3 of HepG2 in vitro[J].Chinese Archives of Traditional Chinese Medicine,2014,32(3):493-495.(in Chinese)
[9]罗见春,何丹,尹华峰,等.姜黄素磷脂复合物的药代动力学评价[J].第二军医大学学报,2014,35(7):754-757. LUO Jianchun,HE Dan,YIN Huafeng,et,al.Pharmacokinetics evaluation of curcumin-phospholipid complex [J].Acta Petrologica Sinica,2014,35(7):754-757.(in Chinese)
[10]郑毅,郑施施,王增寿.姜黄素-PLGA纳米粒提高口服给药生物利用度的研究[J].中国现代应用药学,2014,31(6):717-721. ZHENG Yi,ZHENG Shishi,WANG Zengshou.Enhancement of oral bioavailability of curcumin loaded PLGA nanoparticles[J]. Chin J Mod Appl Pharm,2014,31(6):717-721.(in Chinese)
[11]徐清,黄琴琴,王永禄,等.纳米混悬剂物理稳定性的研究进展[J].中国医药工业杂志,2012,43(2):148-152. XU Qing,HUANG Qinqin,WANG Yonglu,et,al.Progress in physical stability of nanosuspensions[J].Chinese Journal of Pharmaceuticals,2012,43(2):148-152.(in Chinese)
[12]谢向阳,陈晨,廖祥儒,等.纳米混悬剂物理稳定性的研究进展[J].国际药学研究杂志,2011,38(5):369-374. XIE Xiangyang,CHEN Chen,LIAO Xiangru,et,al.Physical stability of nanosuspensions:research advances[J].J Int Pharm Res,2011,38(5):369-374.(in Chinese)
[13]朱庆华,刘彩霞,陈婧,等.总姜黄素在大鼠体内的药动学研究[J].天津中医药大学学报,2008,27(4):266-268. ZHU Qinghua,LIU Caixia,CHEN Jing,et,al.In vivo pharmaco kinetics study of total curcumine in rats[J].Journal of Tianjin University of Traditional Chinese Medicine,2008,27(4):266-268.(in Chinese)
Comparative Study of Pharmacokinetics Between Monomer Bisdemethoxycurcumin and Curcumin
CHEN Jing1, ZHANG Jingqing1, YANG Mei2, JIANG Xinhui1, HU Xueyuan*1
(1.Medicine Engineering Research Center,Chongqing Medical University,Chongqing 400016,China;2.Chongqing Changshou Medicine Hospital,Chongqing 401220,China)
To evaluate the pharmacokinetics of bisdemethoxycurcumin (CurIII)and curcumin (CurI)in SD rats by oral administration.Twelve male rats were random divided into two groups and were orally administrated of CurIII and CurI suspension,the blood samples were collected and of CurIII and monomer CurI concentration in blood was determined by HPLC.The data were processed by DAS 2.1.1 software to calculate the pharmacokinetic parameters.The pharmacokinetic parameter of CurIII and monomer CurI were calculated as follows:Tmax0.75 and 0.25 h,Cmax(62.90±2.64)μg/L and(61.64±4.30)μg/L,AUC0~72 h(281.75±3.61)μg/(h·L)and(171.79±32.18)μg/(h·L),AUC0~∞(291.31±15.15)μg/(h·L)and(190.46±43.81)μg/(h·L),respectively.Compared with monomer CurI,CurIII has better bioavailability.
bisdemethoxycurcumin,curcumin,pharmacokinetics
R 91;R 93
A
1673—1689(2016)08—0890—06
2015-03-04
胡雪原(1971—),女,河南固始人,理学硕士,副教授,主要从事药物合成研究。E-mail:xueyuanhu96@126.com
