猴头菌细胞壁多糖的提取和其结构特征
2016-10-11李巧珍刘艳芳颜梦秋
唐 川, 吴 迪, 杨 焱*, 李巧珍, 刘艳芳, 周 帅, 颜梦秋
(1.国家食用菌工程技术研究中心,上海市农业科学院 食用菌研究所,南方食用菌资源利用农业部重点实验室,上海201403;2.上海师范大学 生命与环境科学学院,上海200234)
猴头菌细胞壁多糖的提取和其结构特征
唐 川1,2, 吴 迪1, 杨 焱*1, 李巧珍1, 刘艳芳1, 周 帅1, 颜梦秋1
(1.国家食用菌工程技术研究中心,上海市农业科学院 食用菌研究所,南方食用菌资源利用农业部重点实验室,上海201403;2.上海师范大学 生命与环境科学学院,上海200234)
以猴头菌子实体残渣为试验材料,研究了残渣粉粹时间及提取用溶剂对其细胞壁多糖提取得率和结构特征的影响。研究发现粉碎时间延长可增加水溶性细胞壁多糖的得率,但多糖含量会降低,粉粹时间对水溶性细胞壁多糖的绝对重均分子质量分布及单糖组成影响较大,最佳粉碎时间为15 min。NaOH浓度的增加可提高碱溶性细胞壁多糖的得率和含量,但免疫活性降低,最适的NaOH浓度为0.5 mol/L。粉碎水提、碱提两种方式得到的细胞壁多糖均能够显著刺激小鼠巨噬细胞释放NO,具有较好的体外免疫活性;比较水溶性细胞壁多糖与碱溶性细胞壁多糖的结构差异,发现水溶性细胞壁多糖绝对重均分子质量远大于碱溶性细胞壁多糖。碱溶性细胞壁多糖只含有葡萄糖,而水溶性细胞壁多糖还含有一定量的半乳糖,且葡萄糖与半乳糖之间的摩尔比值约为4∶1。优选获得了猴头菌细胞壁多糖的高效制备方法,明确了猴头菌水溶性与碱溶性细胞壁多糖结构特征间的差异。
猴头菌;细胞壁多糖;提取方式;结构特征;巨噬细胞
猴头菌(Hericium erinaceus)子实体含有丰富的多糖类物质,具有明显的抗肿瘤、提高免疫力、降血糖、降血脂等活性,临床上用于治疗神经衰弱、胃炎及胃溃疡等疾病[1]。目前针对猴头菌多糖的研究和利用主要集中在水溶性胞内多糖,相关的制备工艺已有很多报道[2-3]。同时,常规水提多糖后的猴头菌子实体残渣量非常可观,含有丰富的细胞壁多糖,这部分多糖通常没有继续提取利用而被丢弃[4],其具有很大的研究开发价值。研究表明,细胞壁多糖通常是β构型的葡聚糖,可分为水溶性、碱溶性与碱不溶性葡聚糖[5],而且多以β-1,3或β-1,6方式连接,这部分葡聚糖具有很强的免疫活性。目前细胞壁中的β-葡聚糖通常采用热水和碱液提取,这两种方法所得多糖具有不同的相对分子质量及分子构象[5],提取方法不同亦导致多糖的生理活性存在差异[6-7]。现在对于酵母菌细胞壁多糖的研究较多,主要采用冷冻研磨[5]、酸碱法及高温[8]等方法提取,而食用菌细胞壁多糖的研究较少,有关猴头菌细胞壁多糖具体的提取工艺及结构特征尚未见报道。本文作者通过对提取完胞内多糖的猴头菌残渣进行水提、碱提的部分条件优化,研究了粉碎时间及提取溶剂对细胞壁多糖的得率、多糖含量及体外免疫活性的影响。在此基础上,对水溶性和碱溶性细胞壁多糖的相对分子质量及单糖组成等结构特征进行比较,明确不同提取方法对猴头菌细胞壁多糖的影响。以期得到一种高效的猴头菌细胞壁多糖的制备方法,为猴头菌多糖的深度开发利用提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
用新鲜的猴头菌子实体,撕成碎块经沸水反复浸提至水提液基本无苯酚-硫酸反应为止,60℃烘干,再用体积分数95%的乙醇浸泡5 d,挥发干乙醇,烘干即得到猴头菌残渣。
葡聚糖标准品和单糖标准品,Sigma-Aldrich公司产品;DMEM培养基、RPMI 1640培养基、胎牛血清、胰酶,Gibco公司产品;青霉素、链霉素,Amersco公司产品;细菌脂多糖(1ipopolysaccharide,LPS),Sigma公司产品。PBS配制:含0.14 mol/L NaCl,0.004 mol/L Na2HPO4,0.002 7 mol/L KCl,0.002 mol/L KH2PO4,调pH至7.4,用蒸馏水定容至 1 L,备用。其它试剂均为国产分析纯。RAW264.7细胞株(小鼠巨 噬 细 胞 株):ATCC (American Type Culture Collection),编号SC2150。
1.2 仪器与设备
DJ-10A中药粉碎机,上海淀久中药机械制造有限公司制造;Synergy HT酶标仪,Bio-TEK公司制造;R210型旋转蒸发仪,BUCHI公司制造;Allegra 25R Centrifuge离心机,Beckman公司制造;Waters e2695型高效液相系统,Waters公司制造;八角度激光光散射仪及黏度检测器,Wyatt公司制造;ICS2500型离子色谱仪,Dionex公司制造。
1.3 猴头菌细胞壁多糖提取方式的确定
1.3.1 粉碎水提细胞壁多糖的条件优化 分别称取30 g粉碎不同时间(5、10、15、20、30 min)的猴头菌残渣粉末,参照文献[9]提取条件,即以料液比1∶20(g/mL)加入蒸馏水,100℃提取2 h,2次,过滤,合并滤液,15 317 g离心15 min,得到猴头菌多糖提取液。提取液按浓缩比(子实体干质量∶粗提液体积(g/mL))1∶5浓缩,加入一定量的乙醇,使乙醇体积分数达到70%,4℃静置12 h,15 317 g离心15 min,收集沉淀,蒸馏水溶解,透析后(3 500 Da,3 d)冻干,即获得水溶性细胞壁多糖,依粉碎时间的不同依次命名为 HPCW5、HPCW10、HPCW15、HPCW20、HPCW30,对照组为水提的胞内多糖HPW。
1.3.2 碱提细胞壁多糖的条件优化 称取30 g粉碎15 min的水提胞壁多糖后的猴头菌残渣,以料液比1∶20(g/mL)加入不同浓度的(0.1、0.5、1 mol/L)NaOH溶液,参照文献[10]选择4℃浸提2 h,2次,过滤,15 317 g离心15 min,得到猴头菌多糖提取液。提取液用6 mol/L盐酸低温中和,按浓缩比1∶5浓缩,加入一定量的乙醇使乙醇体积分数达到70%,4℃静置12 h,15 317 g离心15 min,收集沉淀,蒸馏水溶解,透析后(3 500 Da,3 d)冻干,即获得碱溶性细胞壁多糖,依碱浓度由低到高分别命名为HPCB0.1、HPCB0.5、HPCB1。
1.3.3 水溶性与碱溶性细胞壁多糖的制备 在最优的粉碎时间下,按1.3.1的方法得到水溶性猴头菌细胞壁多糖;粉碎水提后的残渣再在最佳的碱浓度下,按1.3.2的方法得到碱溶性猴头菌细胞壁多糖。
1.4 分析方法
1.4.1 粗多糖的多糖得率和多糖含量测定

式(1)中:r为多糖得率,mc为粗多糖的质量(g),mz为子实体残渣的质量(g)。
以D-葡萄糖为对照品,采用苯酚-硫酸法测定多糖组分中的多糖含量[11]。
1.4.2 HPSEC-MALLS-RI联用分析多糖相对分子质量分布 采用Waters 2695型高效液相系统配TSK PWXL6000型与TSK PWXL4000型串联色谱柱,以及2414型示差折光检测器;以DAWN8+型激光检测器分析粗多糖的相对分子质量分布。参照文献[12],选取流动相为0.15 mol/L NaNO3和0.05 mol/L NaH2PO4·2H2O溶液(pH 7.0,含质量分数0.02%叠氮钠),浓度为0.5 mol/L,恒定色谱柱温为35℃,激光检测器光源波长选用623.8 nm,多糖在溶液中的折光指数增量(dn/dc)按照0.146 mL/g计算。用流动相将粗多糖配成3 mg/mL溶液,12 000 g离心20 min后取上清液,进行HPSEC-MALLS-RI分析。最后使用Astra(version 6.1.1,Wyatt Technology,Santa Barbara,CA)数据分析软件对光散射数据进行采集和分析,计算相对分子质量。
1.4.3 单糖组成分析 采用高效阴离子交换色谱法测定猴头菌细胞壁多糖的单糖组成,取2 mg多糖样品加入2 mol/L的三氟乙酸 (TFA)3 mL,在110℃油浴中水解4 h。水解后用氮吹仪吹干,并多次加入甲醇,反复吹干至无酸味即可。水解产物用超纯水溶解,离心,稀释后以离子色谱测定水解产物中的单糖组成。
1)标准品:D-Gal、D-Glc、D-Ara、L-Fuc、L-Rha、D-Man、D-Xyl、D-Fru、Rib、D-GluA和D-GalA混标。
2)色谱条件:CarboPac PA-20阴离子交换柱(150 mm×3 mm i.d.),进样量25 μL,体积流量0.45 mL/min,柱温 30℃,流动相为超纯水和0.25 mol/L的NaOH[13]。
1.4.4 体外刺激巨噬细胞释放NO的活性 称取一定量的猴头菌细胞壁多糖样品,在无菌条件下用PBS配成6 mg/mL的溶液,12 000 g离心30 min,于无菌操作台将上清液转入灭菌管中,再用PBS将样品稀释至不同作用浓度,参照文献[14]测定巨噬细胞RAW264.7产生NO的产量。
2 结果与分析
2.1 粉碎时间对水提的猴头菌细胞壁多糖的影响
2.1.1 多糖得率及含量 对经多次提取已检测不出提取液中多糖存在的猴头菌残渣进行不同时间粉碎后,按1.3.1方法进行再次提取,制备水溶性细胞壁多糖。由图1可知,粉碎有助于细胞壁多糖的溶出,随着粉碎时间的延长,多糖得率呈增大趋势,粉碎15 min后增长趋势有所降低;而多糖质量分数呈降低趋势,在30 min时达到最低为62.44%。
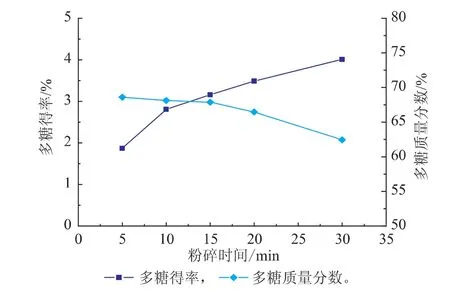
图1 水提猴头菌细胞壁多糖得率及质量分数Fig.1 Yields and contents of cell wall polysaccharides by water extraction from Hericium erinaceus fruit bodies
2.1.2 相对分子质量分布 采用HPSEC-MALLSRI联用对水提的猴头菌细胞壁多糖进行HPLC分析,发现粉碎不同时间的猴头菌,经沸水提取的细胞壁多糖峰形差异较大(图2)。高效液相图谱主要含有3个峰,峰1的重均分子质量在1.0×107~3.0×107g/mol之间,峰2的重均分子质量在3.0×106g/mol左右,峰3的重均分子质量在2.0×105~9.0×105g/mol,进一步表明猴头菌水溶性细胞壁多糖为大分子多糖,重均分子质量均大于2.0×105g/mol。而对照组水提的胞内多糖 (HPW),重均分子质量主要集中在5.0×104g/mol,可以看到猴头菌水溶性细胞壁多糖的重均分子质量远大于胞内多糖。在0~10 min随着粉碎时间的延长,峰1所占的比例呈增大趋势,即大分子量多糖增多;当粉碎时间达到15 min以后,细胞壁多糖的相对分子质量(M=Mrg/mol)分布无显著差异。

图2 水提的猴头菌细胞壁多糖的高效液相图谱Fig.2 HPLC chromatograms of cell wall polysaccharides by water extraction from Hericium erinaceus fruit bodies
2.1.3 单糖组成 对粉碎不同时间后水提的猴头菌细胞壁多糖进行酸水解,结果发现不同粉碎时间沸水提取的细胞壁多糖的单糖组成差异较大(表1)。水提的猴头菌细胞壁多糖主要由半乳糖、葡萄糖组成,并含有岩藻糖及葡萄糖醛酸。与对照组胞内多糖比较,粉碎水提的细胞壁多糖中葡萄糖与半乳糖的比率明显降低。随着粉碎时间的延长,半乳糖与葡萄糖之间的摩尔比差异不明显,在1∶4~1∶6。其中水溶性猴头菌细胞壁多糖含有较多的半乳糖,这与胞内多糖相差明显,且与以往报道的细胞壁多糖主要是由葡聚糖组成有所不同。
2.1.4 刺激巨噬细胞释放NO的产量 对粉碎不同时间后沸水提取的猴头菌细胞壁多糖进行体外刺激巨噬细胞RAW264.7产生NO的试验结果表明(图3),粉碎不同时间后水提的细胞壁多糖均具有较好的刺激巨噬细胞的活性。随着粉碎时间的延长,体外免疫活性有所降低,粉碎时间15 min后,体外免疫活性差异不明显。

表1 水提的猴头菌细胞壁多糖的单糖组成及摩尔比Table1 Mole ratios of monosaccharide of cell wall polysaccharides by water extraction from Hericium erinaceus fruit bodies
比较粉碎不同时间水提的细胞壁多糖得率、多糖质量分数、相对分子质量分布等理化性质及体外免疫活性,综合考虑经济因素,选择最优粉碎时间15 min,此时细胞壁多糖得率及多糖质量分数分别达到3.16%和67.88%。

图3 水提的猴头菌细胞壁多糖对RAW264.7巨噬细胞释放NO的影响Fig.3 Effect of cell wall polysaccharides by water extraction from Hericium erinaceus fruit bodies on the NO release by RAW264.7 macrophages
2.2 NaOH浓度对碱提细胞壁多糖的影响
2.2.1 多糖得率及多糖质量分数 采用不同浓度的NaOH对水提取细胞壁多糖的粉碎残渣继续提取,由表2可知,NaOH浓度对碱提的细胞壁多糖得率及多糖质量分数影响显著,随着NaOH浓度的增加,多糖得率及多糖质量分数均呈增大趋势,但当NaOH浓度从0.5 mol/L上升至1 mol/L时多糖质量分数上升幅度很小,趋于稳定。

表2 碱提猴头菌细胞壁多糖得率及多糖质量分数Table2 Yields and contents of cell wall polysaccharides by alkaline extraction from Hericium erinaceus fruit bodies
2.2.2 刺激巨噬细胞释放NO的产量 对不同NaOH浓度提取的猴头菌细胞壁多糖刺激巨噬细胞RAW264.7产生NO的比较研究发现(图4),碱提的细胞壁多糖也表现出较好的体外免疫活性,但随着NaOH浓度的增加,体外刺激巨噬细胞的活性呈降低趋势,尤其NaOH浓度在1 mol/L时活性下降了50%以上,可能原因是高浓度的NaOH破坏了细胞壁多糖的结构,使其免疫活性降低。综合考虑多糖得率、多糖含量及体外免疫活性等指标,选择使用0.5 mol/L NaOH提取猴头菌细胞壁多糖,此浓度下提取的多糖不仅具有很好的体外免疫活性,同时多糖质量分数也较高,达到64.35%。
2.3 水溶性细胞壁多糖与碱溶性细胞壁多糖结构特征比较
目前提取细胞壁多糖的方法主要采用直接碱液提取或粉碎后碱液提取,得到的细胞壁多糖基本都是碱溶性的,水溶性细胞壁多糖的提取有所忽略,使得细胞壁多糖的研究不够全面。故研究中先对猴头菌残渣粉碎15 min,沸水提取水溶性细胞壁多糖,水提后残渣再通过0.5 mol/L NaOH溶液提取碱溶性细胞壁多糖。多糖的得率及多糖质量分数分别到达3.16%、67.88%和2.54%和64.35%。
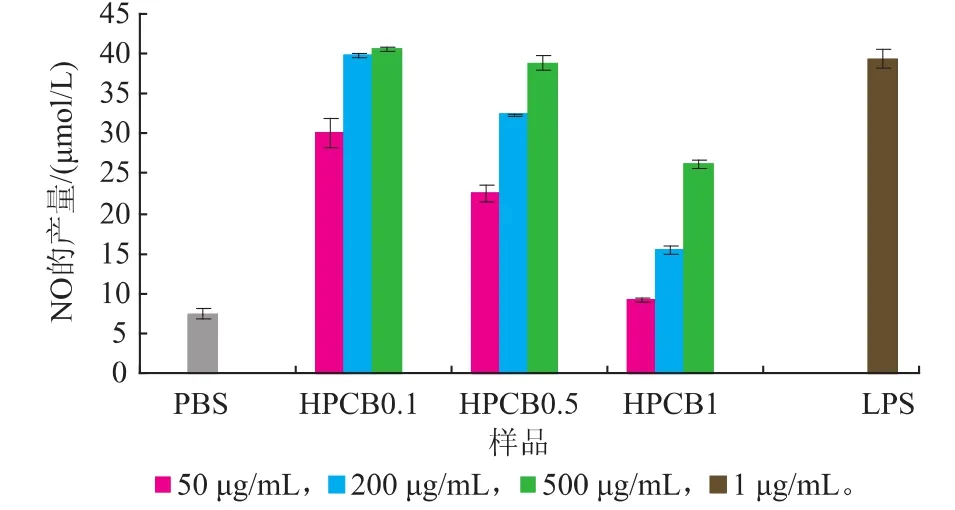
图4 碱提的猴头菌细胞壁多糖对RAW264.7巨噬细胞释放NO的影响Fig.4 Effect of cell wall polysaccharides by alkaline extraction from Hericium erinaceus fruit bodies on the NO release by RAW264.7 macrophages
对水溶性及碱溶性的猴头菌细胞壁多糖的相对分子质量分布(图5(a))、单糖组成(图5(b))等结构特征进行研究,发现它们有较大的差异。高效液相图谱分析结果表明,水溶性细胞壁多糖,主要含有 3个峰,重均分子质量分别为 2.190×107、2.843×106、6.516×105g/mol;碱溶性细胞壁多糖,也含有 3个峰,重均分子质量分别为 2.976×106、4.658×105、1.262×105g/mol,表明细胞壁多糖的相对分子质量均大于10万。同时可以看到,水溶性与碱溶性的细胞壁多糖的HPLC图谱3个峰出峰时间相差不大,但重均分子质量大小差异显著,表明两种方法提取的细胞壁多糖的分子构象存在很大差异[15],可能与Leung M Y K报道的水溶性β-葡聚糖为三股螺旋结构,碱液提取破坏了三股螺旋结构,使β-葡聚糖变为单股螺旋或无规则卷曲结构有关[16]。单糖组成分析表明,水溶性细胞壁多糖为杂多糖,主要由葡萄糖、半乳糖组成,两者间物质的量比值约为4∶1;碱溶性细胞壁多糖为葡聚糖,这与以往报道的细胞壁多糖为葡聚糖结果一致。
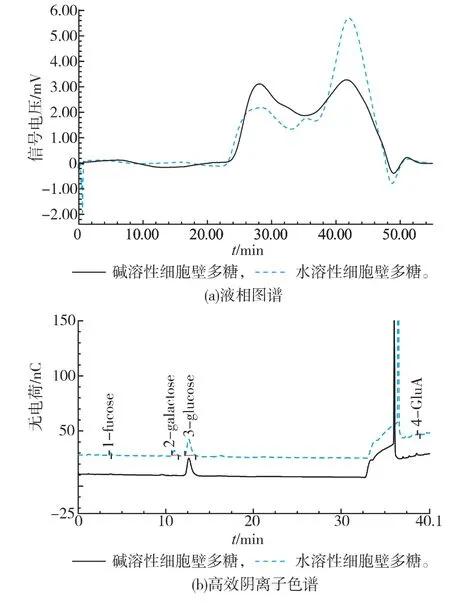
图5 猴头菌水溶性与碱溶性细胞壁多糖的液相图谱及高效阴离子色谱图Fig.5 HPLC and HPAEC chromatograms of watersoluble and alkaline-soluble cell wall polysaccharides from Hericium erinaceus fruit bodies
3 结语
研究了粉碎时间对水提的细胞壁多糖和NaOH浓度对碱提的细胞壁多糖的多糖得率、含量、理化特征及体外免疫活性的影响。结果表明,最佳的粉碎时间为15 min,最适的NaOH浓度为0.5 mol/L。在此基础上,对水溶性细胞壁多糖与碱溶性细胞壁多糖的结构特征进行比较,发现水溶性细胞壁多糖主要由半乳糖、葡萄糖组成,碱溶性细胞壁多糖只含葡萄糖,且两者具有不同的分子构象。结果进一步表明,水溶性及碱溶性细胞壁多糖均具有较好的体外刺激巨噬细胞释放NO的活性。故对于猴头菌细胞壁多糖的提取可以采用粉碎水提及水提残渣再碱提的方法进行深入提取,所得多糖具有得率高、多糖含量高及生物活性好的特点。
目前很少有水溶性细胞壁多糖的相关报道,Leung M Y K制备了金针菇水溶性细胞壁活性多糖,但其预处理相对复杂[16]。通过对猴头菌残渣采用粉碎水提的方法制备水溶性细胞壁多糖,随着粉碎时间的延长,水溶性细胞壁多糖的净得率呈增大趋势,且较大相对分子质量多糖增多,粉碎使得细胞壁破坏,有助于细胞壁多糖的提取。对于粉碎水提后的残渣再通过碱提的方法来制备碱溶性细胞壁多糖,该方法有别于通常采用的残渣直接用碱提取细胞壁多糖[4],它将水溶性与碱溶性细胞壁多糖明确区分开来。故而通过粉碎水提、水提后再碱提的方法,可以充分提取猴头菌中的细胞壁多糖,为细胞壁多糖的深度开发,提供了一定的理论基础。
[1]杨焱,周昌艳,王晨光,等.猴头菌多糖调节机体免疫功能的研究[J].食用菌学报,2000,7(1):19-22. YANG Yan,ZHOU Changyan,WANG Chenguang,et al.Studies on immunoregulatory function of Hericium erinaceus polysaccharide[J].Acta Edulis Fungi,2000,7(1):19-22.(in Chinese)
[2]朱美静.猴头菌多糖的提取及理化性质的研究[D].无锡:江南大学食品学院,2006.
[3]蒋俊,罗珍,刘艳芳,等.醇沉条件对猴头菌多糖得率和品质的影响[J].食用菌学报,2011,18(2):57-61. JIANG Jun,LUO Zhen,LIU Yanfang,et al.Effect of precipitation conditions on the yield and quality of Hericium erinaceus polysaccharides[J].Acta Edulis Fungi,2011,18(2):57-61.(in Chinese)
[4]林华娟,秦小明.猴头菇子实体碱溶性葡聚糖的分离纯化[J].食用菌学报,2006,13(2):61-64. LIN Huajuan,QIN Xiaoming.Isolation and purification of an alkali-soluble glucan from fruit bodies of Hericium erinaceu[J]. Acta Edulis Fungi,2006,13(2):61-64.(in Chinese)
[5]LEUNG M Y K,LIU C,KOON J C M,et al.Polysaccharide biological response modifiers[J].Immunol Lett,2006,105:101-114.
[6]杨阳,刘承初,贾薇,等.灰树花多糖的超滤分离及免疫活性研究[J].食品科学,2008,29(9):277-280. YANG Yang,LIU Chenchu,JIA Wei,et al.Study on ultrafiltration separation and immunocompetence of polysaccharides from Grifola frondosa[J].Food Sci,2008,29(9):277-280.(in Chinese)
[7]王元凤,金征宇.不同溶剂分级提取的茶多糖的组成及降血糖活性[J].天然产物研究与开发,2006,18(5):813-817. WANG Yuanfeng,JIN Zhengyu.Composition of tea polysaccharides by different solvent extraction and their hypoglycemic effects[J].Nat Prod Res Dev,2006,18(5):813-817.(in Chinese)
[8]王静,戴军,陈尚卫,等.提取酵母细胞壁中β-D-葡聚糖的新方法[J].食品与发酵工业,2011,37(1):189-193. WANG Jing,DAI Jun,CHEN Shangwei,et al.New methods for extraction of β-glucan from yeast cell walls[J].Food Fermn Ind,2011,37(1):189-193.(in Chinese)
[9]李巧珍.产活性多糖猴头菌株筛选及其生长过程中代谢产物的研究[D].重庆:西南大学,2012.
[10]DONG Qun,JIA Lianmeng,FANG Jinian.A β-D-glucan isolated from the fruiting bodies of Hericium erinaceus and its aqueous conformation[J].Carbohydr Re,2006,341(6):791-795.
[11]贾联盟,刘柳,董群,等.猴头菇子实体中的主要多糖成分[J].中草药,2005,36(1):10-12. JIA Lianmeng,LIU Liu,DONG Qun,et al.Main polysaccharide fractions isolated from fruiting bodies of Hericium erinaceus[J]. Chinese Traditional and Herbal Drugs,2005,36(1):10-12.(in Chinese)
[12]LIU Yanfang,ZHAO Yuan,YANG Yan,et al.Structural characteristics and hypoglycemic activity of polysaccharides from Coprinus comatus[J].Bioactive Carbohydrates and Dietary Fibre,2013,2(2):164-169.
[13]ZHANG A Q,FU L,SUN P L,et al.Isolation and structural characterization of a water-soluble polysaccharide from Hericium erinaceus[J].Mycosystema,2010,29(6):911-917.
[14]蒋俊,杨焱,罗玺,等.猴头菌多糖不同脱色方法的研究[J].天然产物研究与开发,2013,25(9):1180-1184. JIANG Jun,YANG Yan,LUO Xi,et al.Study on different decolorization methods of Hericium erinaceus polysaccharide[J].Nat Prod Res Dev,2013,25(9):1180-1184.(in Chinese)
[15]刘佳,陈玲,李琳,等.小麦A、B淀粉凝胶质构特性与分子结构的关系[J].高校化学工程学报,2011,25(6):1033-1038. LIU Jia,CHEN Ling,LI Lin,et al.Relationship between texture properties and molecular structure of A,B-type wheat starch[J]. J Chem Eng of Chinese Univ,2011,25(6):1033-1038.(in Chinese)
[16]LEUNG M Y K,FUNG K P,CHOY Y M.The isolation and characterization of an immunomodulatory and anti-tumor polysaccharide preparation from Flammulina velutipes[J].Lmmunopharmacology,1997,35:255-263.
Extraction and Structural Characteristics of Cell Wall Polysaccharides from Hericium erinaceus
TANG Chuan1,2, WU Di1,, YANG Yan*1LI Qiaozhen1, LIU Yanfang1, ZHOU Shuai1, YAN Mengqiu1
(1.National Engineering Research Center of Edible Fungi,Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences,Key Laboratory of Resources and Utilization of Edible Fungi(South),Ministry of Agriculture,Shanghai201403,China; 2.College ofLife and EnvironmentalSciences,ShanghaiNormal University,Shanghai 200234,China)
Effects of pulverizing time and extraction solvents on yields and structural characteristics of cell wall polysaccharides from Hericium erinaceus residue were studied.Results showed that the yields of water-soluble cell wall polysaccharides increased but the polysaccharide contents decreased with the prolonged pulverizing time.The pulverizing time also had significant effects on the molecular distribution pattern and the monosaccharide composition of polysaccharides,and the optimal time was 15 min.The increase of NaOH concentration raised the yields and contents but reduced the immune activities of alkali-soluble cell wall polysaccharides,and the optimal NaOHconcentration was 0.5 mol/L.Both water-and alkaline-soluble polysaccharides significantly stimulated murine macrophages to release NO,indicating a potent immune activity in vitro.But the molecular weights of water-soluble cell wall polysaccharides were much larger than those of alkali-soluble ones.The later contained glucose only,while the former also contained a certain amount of galactose and the ratio of glucose to galactose was approximately 4∶1.This study established a method to obtain cell wall polysaccharide from Hericium erinaceus,and elucidated the structural difference between water-and alkali-soluble cell wall polysaccharides.
Hericium erinaceus,cell wall polysaccharide,extraction method,structural properties,macrophages
Q 539;R 284.2
A
1673—1689(2016)08—0871—07
2014-12-07
上海市农业科学院青年科技基金项目(沪农青年科技2012(04))。
杨 焱(1970—),女,新疆乌鲁木齐人,工学博士,研究员,主要从事食药用菌活性成分的分离纯化及功能产品的开发研究。
E-mail:yangyan@saas.sh.cn
