Colletotrichum lini ST-1静息细胞转化DHEA制备7α,15α-diOH-DHEA的工艺
2016-10-11尹思淇史劲松许正宏
尹思淇, 李 聪, 吴 燕, 李 会, 史劲松, 许正宏
(江南大学 药学院,江苏 无锡 214122)
Colletotrichum lini ST-1静息细胞转化DHEA制备7α,15α-diOH-DHEA的工艺
尹思淇, 李 聪, 吴 燕, 李 会*, 史劲松, 许正宏
(江南大学 药学院,江苏 无锡 214122)
利用亚麻刺盘孢(Colletotrichum lini ST-1)静息细胞转化去氢表雄酮,制备三羟基雄甾烯酮,通过单因素优化确定了最佳摇瓶转化条件:细胞质量浓度为12 g/L,pH值为6.5,装液量为30 mL/250 mL,转速为220 r/min,温度为30℃。在上述条件下,底物投料质量浓度为10 g/L时,转化48 h,产物摩尔得率为38.5%,较生长细胞提高了21.0%。在上述工作基础上,尝试了静息细胞连续批次转化,最终通过两批次的连续转化,在底物累计投料质量浓度为18 g/L时,转化78 h,产物的累积质量浓度高达12.1 g/L,产物摩尔得率可达60.5%。
亚麻刺盘孢;去氢表雄酮;三羟基雄甾烯酮;静息细胞;批次转化
静息细胞是指一类可以进行有氧非生长代谢的细胞,通常将培养好的细胞悬浮于不含营养物质或只含碳源(如葡萄糖)的转化液中,然后添加底物进行生物催化反应。这种转化方式弥补了传统发酵转化的诸多不足[1-2],便于对反应条件进行控制;减少了反应过程干扰因子,保证了催化反应的高效性和专一性;有利于产物的分离纯化。目前,静息细胞法已经被应用于天然化合物的特定位点催化、有机化合物的不对称反应、药物前体化合物的生物合成及药物活性成分的筛选及新药研究等多个领域[3-4]。
去氢表雄酮(DHEA)可用于合成多种甾体激素类药物的中间体,具有抗衰老及蛋白质同化作用,其代谢产物能够促进机体的免疫应答[5]。DHEA通过生物转化作用,在C7位和C15位分别加入一个氧原子,生成具有重要医用价值和市场价值的甾体激素药物三羟基雄甾烯酮。三羟基雄甾烯酮(7α,15α-diOH-DHEA)是合成新型口服避孕药“优思明”主要成分屈螺酮的关键中间体[6]。“优思明”是全球销量第一的女用口服避孕药,具有高效、低毒、无副作用等优点,全球需求量大,市场前景广阔。Colletotrichum lini是现有文献报道中可以催化底物DHEA生成7α,15α-diOH-DHEA转化能力最强的菌株,目前主要采用生长的全细胞进行转化,转化效率低(仅 60%左右),底物投料质量浓度低于8 g/L[7-8]。以实验室诱变得到的一株C.lini ST-1为研究对象[9],研究以静息细胞法制备7α,15α-diOHDHEA的工艺过程,从而进一步提高其转化效率。
1 材料与方法
1.1 实验菌株
亚麻刺盘孢(C.linli ST-1),由作者所在实验室通过复合诱变方法筛选得到。
1.2 培养基
1)斜面固体培养基(g/L):马铃薯 200,葡萄糖20,琼脂20;自然pH,121℃灭菌20 min。
2)种子培养基(g/L):葡萄糖 15,酵母粉 15,玉米浆3,豆饼粉10;自然pH,121℃灭菌20 min。
3)发酵培养基(g/L):葡萄糖15,酵母粉 15,玉米浆3;自然pH,121℃灭菌20 min。
4)转化培养基 (g/L):Na2HPO4·12H2O 22.56,NaH2PO4·2H2O 21.37。
1.3 菌体的培养
从斜面挑取适量菌丝接入含有100 mL种子培养基的500 mL的锥形瓶中,于220 r/min,30℃摇床条件下培养72 h。将培养好的一级种子以体积分数10%的接种量转接至新的种子培养基中进行二次活化,摇床条件220 r/min,30℃,培养24 h。
1.4 生长细胞转化
以体积分数10%的接种量将二级种子液转接至30 mL/250 mL的转化培养基中,于220 r/min,30℃摇床培养。当培养24 h后,准确称取10 g/L的DHEA于培养基中进行转化,每隔6 h取样检测。
1.5 静息细胞的制备与转化
以体积分数10%的接种量将二级种子液转接至30 mL/250 mL的转化培养基中培养24 h(摇床条件220 r/min,30℃)。离心收集菌丝体,用事先配制的磷酸钠缓冲液洗涤菌体2遍,离心 (8 000 r/ min,10 min)收集菌体。准确称取3.5 g湿质量的菌体,投入含有30 mL磷酸钠缓冲液的250 mL的摇瓶中 (细胞干质量12 g/L),同时添加10 g/L的DHEA和质量浓度2 g/dL的吐温80进行转化,摇床条件为220 r/min,30℃。转化过程中每隔6 h取样检测。
1.6 静息细胞批次转化
准确称取3.5 g湿质量的菌体投入含有30 mL磷酸钠缓冲液(pH 6.5,0.2 mol/L)的250 mL的摇瓶中(细胞干质量12 g/L),同时添加10 g/L的DHEA 和2 g/dL的吐温80进行转化。摇床条件为220 r/ min,30℃,转化过程中每隔6 h取样检测。当底物转化率达到90%时,结束第一批次的转化。转化液离心后倒出上清液,将菌体重新置于新的磷酸钠缓冲液中,重新添加4~10 g/L的底物和1 g/dL的吐温80进行第二批次的转化,转化条件相同。第三批次的转化条件同第二批次。
1.7 薄层层析检测产物
用移液器吸取500 μL的转化液,用等体积的乙酸乙酯进行萃取,充分振荡10 min,用移液器吸取2.5 μL上清液点样,然后在展开剂(氯仿-甲醇体积比=15∶1)中展开10~15 min,用显色剂(浓硫酸-乙醇体积比=1∶1)进行显色,105℃加热2 min。
1.8 高效液相检测产物
转化结束后取800 μL转化液,用800 μL乙酸乙酯反复萃取5~6遍。合并萃取过程的上清液,浓缩得到底物和产物的混合物,复溶于8倍体积的乙腈中,用0.22 μm有机滤膜过滤除杂,采用HPLC定量分析。分析条件:安捷伦C18反相柱 (4.6 mm×250 mm,5 μm),流动相(乙腈-水体积比=7∶3),柱温30℃,体积流量0.5 mL/min,进样量10 μL,紫外检测波长 206 nm。产物摩尔得率(7α,15α-diOH-DHEA)的计算公式如下:

式(1)中:X为液相测得的产物质量浓度,g/L;c为投加的底物质量浓度,g/L;M为底物与产物的摩尔质量,g/moL。文中产物特指7α,15α-diOH-DHEA,不包含副产物。
2 结果与讨论
2.1 菌龄对静息细胞转化的影响
静息细胞的转化过程主要依赖胞内酶的活力,而菌体的不同生长阶段,其生理活性和酶表达水平有非常大的差异。因此,以不同生长阶段的菌体制备成静息细胞来转化DHEA(10 g/L),菌体质量浓度为10 g/L,在30℃,220 r/min摇床条件下转化24 h,检测其产物的摩尔得率,结果如表1所示。随着菌体培养时间的增加,产物的摩尔得率增加明显;在菌体培养到24 h时,产物摩尔得率最高为34.3%;当菌体培养时间超过24 h时,产物摩尔得率又出现了下降。因此选择培养时间为24 h的菌体进行转化。

表1 菌龄对产物摩尔得率的影响Table1 Effect of mycelia age on molar product yield
2.2 静息细胞转化的条件优化
2.2.1 细胞质量浓度对转化的影响 考察了不同的细胞质量浓度对产物摩尔得率的影响,底物投料质量浓度为10 g/L,220 r/min,30℃摇床条件下转化48 h(见图1)。由图1可以看出,当细胞质量浓度为12 g/L时,产物的摩尔得率最高,而当细胞质量浓度继续升高时,产物摩尔得率呈下降趋势。因此,反应过程细胞质量浓度应控制在12~14 g/L之间。
2.2.2 pH值对转化的影响 考察了不同pH值对产物摩尔得率的影响,结果如图2所示。实验结果显示,pH值对产物摩尔得率的影响较大,且酸性环境较碱性环境更有利于反应的进行,当pH值为6.5时,产物的摩尔得率最高。分析其原因,pH值对酶活性的影响较大,弱酸性的条件下,酶的活性较高。因此,选择转化的最适pH值为6.5。

图1 细胞质量浓度对产物摩尔得率的影响Fig.1 Effect of cell concentration on molar product yield

图2 pH值对产物摩尔得率的影响Fig.2 Effect of pH on molar product yield
2.2.3 溶氧对转化的影响 DHEA羟基化过程需要氧的参与[10],因此转化过程的溶氧水平与7α,15αdiOH-DHEA的产量有着密切的联系。在摇瓶转化过程中装液量和转速是影响溶氧的两个主要因素,考察了250 mL的摇瓶转化过程中不同装液量及转速对产物摩尔得率的影响,如图3和图4所示。

图3 装液量对产物摩尔得率的影响Fig.3 Effect of liquid volume on molar product yield
由图3可知,在250 mL的锥形瓶中装液量为30 mL时,产物的摩尔得率最高;当装液量过高或者过低时,产物摩尔得率出现了不同程度的降低。分析其原因,装液量太大会影响氧分子传递,使反应过程溶氧降低,限制转化的进行;而装液量太小,相同的转速下菌体振荡幅度太大,剪切力过大容易造成菌丝体断裂。因此,选择最适转化的装液量为30 mL/250 mL。

图4 转速对产物摩尔得率的影响Fig.4 Effect of rotation speed on molar product yield
由图4可知,转速的变化对产物摩尔得率的影响很明显,当转速为220 r/min时,产物摩尔得率最高;转速在160~220 r/min,随着转速的增加,产物摩尔得率也逐渐增加;转速超过220 r/min时,产物摩尔得率开始下降。分析其原因,在一定范围内转速的增加有利于溶氧的提高,也利于氧分子的传递,可以促进转化的进行;而转速过大时,高转速产生的强剪切力会对转化过程的菌体造成损伤,不利于转化进行。因此,选择最适转速为220 r/min。
2.2.4 温度对转化的影响 由图5可以看出,温度变化对产物摩尔得率的影响非常大,当温度超过35℃,转化过程受到明显抑制,而在30℃时可以得到最高的产物摩尔得率。分析其原因,酶对反应温度非常敏感,温度过高,酶活受到抑制,而低温亦不利于转化进行。因此,选择最适反应温度为30℃。

图5 温度对产物摩尔得率的影响Fig.5 Effect of temperature on molar product yield
2.2.5 转化过程分析 在上述转化条件优化的基础上,对比了静息细胞转化和传统生长细胞转化的曲线。如图6所示,利用静息细胞转化DHEA的产物摩尔得率较生长细胞的产物摩尔得率要高,在转化48 h后,产物摩尔得率提高了21.0%,表明静息细胞可用于DHEA的转化生产,且较生长细胞存在一定的优势。
2.3 静息细胞批次转化
霉菌较长的生长和转化周期是限制其工业应用的一个重要因素,静息细胞转化较生长细胞转化的另一个优势是细胞的可重复利用。由于转化过程底物的溶解度非常小,所以在底物投料的同时添加2 g/dL的吐温80作为底物助溶剂。图7是底物投料质量浓度10 g/L时,添加2 g/dL的吐温80助溶后的转化曲线。由图7可知,在转化进行到30 h时,底物的利用率已达到90%,且产物摩尔得率也趋于平稳,此时可进行第二批次转化。

图6 静息细胞和生长细胞的转化曲线比较Fig.6 Conversion curves with resting cells and growing cells

图7 优化后的转化曲线Fig.7 Conversion curves after optimization
DHEA的水溶性较差,产物在增加了两个羟基后亲水性得到改善,因此转化液离心后上清液中的主要成分为7α,15α-diOH-DHEA,若此时取出菌体重新置于新的转化体系中进行转化,既可以提高菌体的利用率,同时也有利于解除产物的反馈抑制。考虑到底物对菌体的毒性,在批次转化过程中产物得率会出现明显的降低,因此需要逐批降低底物的投料质量浓度并适当延长转化时间。
如表2所示,在第二批次转化过程中,随着底物质量浓度的增加,产物摩尔得率出现了明显的下降,底物投料质量浓度为10 g/L时,转化48 h,产物摩尔得率不足30%;投料质量浓度为8 g/L时,转化相同的时间,产物积累的质量浓度最高为4.5 g/L,故将8 g/L作为第二批次的底物投料质量浓度。
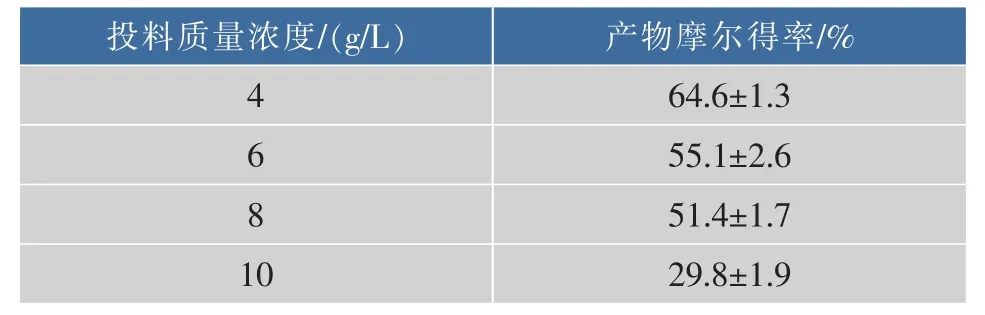
表2 第二批次投料质量浓度对转化的影响Table2 Effect of substrate concentration on the second batch conversion
第三批次投料质量浓度对转化的影响如表3所示。

表3 第三批次投料质量浓度对转化的影响Table3 Effect of substrate concentration on the third batch conversion
菌丝体在进行第三批次转化时,投料质量浓度为2 g/L时,产物摩尔得率已低于50%;投料质量浓度增加到8 g/L,产物积累质量浓度不足1 g/L。综合考虑生产效益,宜选用静息细胞两批次转化,投料质量浓度为第一批次10 g/L(30 h),第二批次8 g/L(48 h),最终产物累计质量浓度可达12.1 g/L。
3 结语
通过对C.lini ST-1静息细胞转化DHEA的反应条件(包括细胞浓度、pH值、装液量、转速和温度)进行单因素优化,产物摩尔得率较生长细胞提高了21.0%,表明了C.lini ST-1静息细胞可用于DHEA的转化生产。在上述条件优化的基础上,考察了静息细胞的批次转化,得到了最佳的批次转化条件,最终在总投料质量浓度为18 g/L时,产物的累积质量浓度达到了12.1 g/L,产物摩尔得率达到了60.5%,是目前文献报道的最高水平。综上,静息细胞转化不仅可以提高产物的摩尔得率,而且可以提高菌体的利用效率。
[1]杨大娇,任天宝,王风芹,等.静息细胞在发酵工业中的研究进展[J].食品与发酵工业,2013,39(8):187-191. YANG Dajiao,REN Tianbao,WANG Fengqin,et al.The research progress of resting cell fermentation production of industry[J]. Food and Fermentation Industries,2013,39(8):187-191.(in Chinese)
[2]易奎星,杨亚力,杨顺楷,等.静息细胞连续两批次生物催化生产氢化可的松[J].生物加工过程,2005,3(4):40-44. YI Kuixing,YANG Yali,YANG Shunkai,et al.Bioconversion of compound S into hydrocortisone using a novel process of two-run sequence bioconversion by the mycelium of Curvularia lunata AS 3.4381 [J].Chinese Journal of Bioprocess Engineering,2005,3(4):40-44.(in Chinese)
[3]王丹,张强,李旺,等.酵母静息细胞催化丙酮酸乙酯不对称还原制(S)-乳酸乙酯[J].催化学报,2011,32(6):1035-1039. WANG Dan,ZHANG Qiang,LI Wang,et al.Asymmetric reduction of ethyl pyruvate catalyzed by yeast resting cells to(S)-ethyl lactate[J].Chinese Journal of Catalysis,2011,32(6):1035-1039.(in Chinese)
[4]顾亚云,陈建华.静息细胞转化制备6-脱氧-6-氨基 (N-羟乙基)-α-L-呋喃山梨糖的研究 [J].化学与生物工程,2013,30 (7):47-50. GU Yayun,CHEN Jianhua.Synthesis of 6-(N-Hydroxyethyl)amino-6-deoxy-α-L-sorbofuranose by transformation with resting cells[J].Chemistry and Bioengineering,2013,30(7):47-50.(in Chinese)
[5]MAHUAD C,BAY M L,FARRONI M A,et a1.Cortisol and dehydroepiandrosterone affect the response of peripheral blood mononuclear cells to mycobacterial antigens during tuberculosis[J].Scandinavian Journal of Immunology,2004,60(6):639-646.
[6]LI H,FU Z Z,LI H,et al.Improvement of the steroid dihydroxylation efficiency from dehydroepiandrosterone using a substrate pre-induction biotransformation process[J].Biotechnology and Bioprocess Engineering,2013,18(3):486-490.
[7]ROMANO A,ROMANO D,RAGG E,et al.Steroid hydroxylations with Botryodiplodia malorum and Colletotrichum lini[J]. Steroids,2006,71(6):429-434.
[8]LOBASTOVA T G,GULEVSKAYA S A,SUKHODOLSKAYA G V,et al.Dihydroxylation of dehydroepiandrosterone in positions 7α and 15α by mycelial fungi[J].Applied Biochemistry and Microbiology,2009,45(6):617-622.
[9]李传鹏,李会,吴燕,等.复合诱变选育高效转化DHEA为7α,15α-diOH-DHEA的菌株及其转化工艺优化[J].生物工程学报,2014,30(1):147-156. LI Chuanpeng,LI Hui,WU Yan,et al.Optimization of hydroxylating DHEA to 7α,15α-diOH-DHEA by compound mutation and fermentation optimization[J].Chinese Journal of Biotechnology,2014,30(1):147-156.(in Chinese)
[10]KRISTAN K,RIZNER T L.Steroid-transforming enzymes in fungi[J].The Journal of Steroid Biochemistry and Molecular Biology,2012,129(1):79-91.
Bioconversion of Dehydroepiandrosterone to 3β,7α,15α-Trihydroxy-5-Androsten-17-One by Colletotrichum lini ST-1 Resting Cells
YIN Siqi, LI Cong, WU Yan, LI Hui*, SHI Jingsong, XU Zhenghong
(School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,Jiangsu,China)
The bioconversion of dehydroepiandrosterone (DHEA)to 3β,7α,15α-trihydroxy-5-androsten-17-one by Colletotrichum liniST-1 resting cells was investigated.The optimal transformation parameters in flasks were cell concentration 12 g/L,pH 6.5,liquid volume 30 mL/250 mL,rotational speed 220 r/min and temperature 30℃,which resulted in a molar product yield of 38.5%for 7α,15α-diOH-DHEA that was 20.1%higher than that from growing cells.Based on these conditions,two-batch bioconversion for 78 h with resting cells at a total substrate concentration of 18 g/L resulted in a concentration of 12.1 g/L and a molar product yield of 60.5%for 7α,15αdiOH-DHEA.
Colletotrichum lini ST-1;dehydroepiandrosterone;3β,7α,15α-trihydroxy-5-androsten-17-one;resting cells;batch conversion
Q 815
A
1673—1689(2016)08—0801—05
2015-03-11
国家863计划重大项目(2011AA02A211)。
李 会(1983—),女,河北唐山人,工学博士,副教授,硕士研究生导师,主要从事生物制药研究。E-mail:lihui@jiangnan.edu.cn
