β-胡萝卜素催化异构化及9-顺式β-胡萝卜素制备工艺研究
2016-10-10闫红晓孙清瑞张连富
闫红晓, 孙清瑞,2, 李 东, 张连富*,3
(1.江南大学 食品学院,江苏 无锡214122;2.黑龙江八一农垦大学 食品学院,黑龙江 大庆163319;3.江南大学国家功能食品工程技术研究中心,江苏 无锡 214122;4.淮阴工学院 生命科学与化学工程学院,江苏 淮安223001)
β-胡萝卜素催化异构化及9-顺式β-胡萝卜素制备工艺研究
闫红晓1, 孙清瑞1,2, 李 东2,4, 张连富*1,3
(1.江南大学 食品学院,江苏 无锡214122;2.黑龙江八一农垦大学 食品学院,黑龙江 大庆163319;3.江南大学国家功能食品工程技术研究中心,江苏 无锡 214122;4.淮阴工学院 生命科学与化学工程学院,江苏 淮安223001)
β-胡萝卜素异构体中,9-顺式异构体具有更高的生理活性。通过碘掺杂二氧化钛纳米催化剂在乙酸乙酯中非均相催化全反式β-胡萝卜素异构化,制备高顺式构型占比的β-胡萝卜素。经液相-离子阱质谱联用仪分析,证实催化产物主要为15-顺式、13-顺式、9,13-双顺式、全反式和9-顺式等5种β-胡萝卜素异构体。以9-顺式β-胡萝卜素相对含量为评价指标,在单因素试验基础上,采用正交试验设计优选出制备高9-顺式β-胡萝卜素异构体的最优条件为:温度75℃,时间90 min,底物质量浓度1 mg/mL,催化剂添加量1.2 mg/mg(基于β-胡萝卜素),此时,9-顺式β-胡萝卜素异构体质量分数达到25.02%,总顺式异构体的质量分数为47.41%。反应过程中β-胡萝卜素的降解率为12.6%。结论:碘掺杂二氧化钛纳米催化剂催化全反式β-胡萝卜素异构化适用于高9-顺式β-胡萝卜素的制备,此制备工艺简单且成本较低。
β-胡萝卜素;异构体;HPLC-APCI-MS;异构化
目前市场上存在的β-胡萝卜素有天然和合成两类产品,主要以合成的产品为主,合成的β-胡萝卜素几乎全部为反式,而天然的β-胡萝卜素产品因其较高含量的顺式异构体,在人体内的吸收率是合成β-胡萝卜素的10倍左右[1]。β-胡萝卜素的抗氧化性及抗癌性能与其顺反异构情况有关[2]。有学者研究表明,9-顺-β-胡萝卜素的抗氧化性比全反式强[3-4],而且富含9-顺式的天然β-胡萝卜素能抑制动脉粥样硬化[5-6],降低癌症患病率[7-8],但合成的β-胡萝卜素没有抑制动脉粥样硬化恶化的效果[5],也不能降低癌症患病率[7-10],同时对心血管疾病也没有抑制效果[10]。再者,天然产物的各个异构体在生物体内的协同作用是其表现出显著生物学功能的重要保障[11]。现有研究结果表明,9-顺-β-胡萝卜素在特殊培养的盐生杜氏藻中含量最高[6],达到40%左右,总顺式达到50%左右,但其顺式异构体种类比较少,除了全反式和9-顺式以外,只含有少量13-顺式异构体[12]。以培养盐生杜氏藻的方法来生产9-顺含量较高的β-胡萝卜素,不仅需要提供强辐射,较高的温度,高盐度,高溶氧等各种条件,而且分离提纯较为繁琐,成本很高[11]。因此,寻求一种操作简单且成本较低的制备异构体种类丰富且9-顺含量较高的β-胡萝卜素的技术尤为必要。
以类胡萝卜素为原料,通过异构化处理来制备高顺式构型占比类胡萝卜素的常见方法有热致异构化技术和光致异构化技术[13-17]。但这些技术普遍存在操作复杂、周期长、9-顺式β-胡萝卜素含量低等缺点。例如,光致异构化技术技术中,需要特殊的反应装置;反应规模难以扩大;如果以单质碘为催化剂,一则单质碘易升华损失,二则反应后去除较难,产品的安全性没有保障,同时不可避免增加了生产成本。
江南大学食品学院发明了碘掺杂二氧化钛纳米催化剂在有机相中无需光作用即可非均相催化反式类胡萝卜素构型转化的技术,解决了均相催化反应中的含碘化合物催化剂分离困难、不能重复利用、产品中碘残留量超标等问题。作者着重探讨了该技术在催化β-胡萝卜素异构化领域的应用,通过碘掺杂二氧化钛纳米催化剂制备异构体种类丰富且9-顺式含量较高的β-胡萝卜素,以期提高其抗氧化活性和生理活性,并在前人研究的基础上[18-24],对β-胡萝卜素的顺反异构体进行分离鉴定,这对提高合成的β-胡萝卜素产品的应用价值和拓宽其应用领域具有十分重要的意义。
1 材料与方法
1.1 试验材料与试剂
β-胡萝卜素晶体(≥96%):嘉兴天和诚生物科技有限公司产品;β-胡萝卜素标品(≥98%):美国Sigma公司产品;碘掺杂纳米催化剂(各元素组成I:Ti:O:C=1.1:30.8:66.6:1.5):实验室自制;乙酸乙酯:分析纯,国药集团化学试剂有限公司产品;甲醇,乙腈,甲基叔丁基醚:色谱纯,美国天地试剂有限公司产品。
1.2 仪器与设备
DF-101S集热式磁力加热搅拌器:常州迈科诺仪器有限公司产品;TG18G离心机:盐城凯特实验仪器有限公司产品;LC3000高效液相色谱仪,北京创新通恒科技有限公司产品;液相色谱-离子阱质谱联用分析仪:Waters 2695泵和Waters 2996二极管阵列检测器(PAD):Waters公司产品;质谱仪(包括APCI源):Bruker Esquire 6000,Bruker公司产品。
1.3 色谱和质谱条件
色谱条件:采用C30柱结合高效液相分析,液相条件:色谱柱:Waters YMC C30柱 (5 um,250 mm×4.6mm);流动相:A相:V(甲醇)∶V(乙腈)=25∶75,B相:甲基叔丁基醚100%;梯度条件:0~20 min,A相由100%减少到50%,20~30 min,A相保持50%;样品处理溶剂:乙酸乙酯;流量:1 mL/min;柱温:25℃;进样量:20 μL;DAD光谱扫描范围:250~600 nm。
质谱条件:离子源为 APCI(+);扫描范围为 m/ z:310~650;离子源蒸发温度:400℃;雾化气压力:45 psi;干燥气流量:5.0 L/min;干燥气温度:300℃;雾化电流为3.8 μA。
1.4 试验方法
1.4.1 β-胡萝卜素顺反异构体的分离鉴定 样品制备方法:称取20 mg β-胡萝卜素晶体溶于20 mL乙酸乙酯溶液中,并加入一定量的催化剂,避光,加热回流反应一定时间后冷却,离心(8 000 r/min)除去催化剂,样品在零下18℃中存放备用。
β-胡萝卜素的全反式结构在HPLC上与标准品对照进行鉴定,其他顺式异构体由液质联用的检测结果和其光谱结果来判断。
1.4.2 高含量9-顺β-胡萝卜素制备工艺的优化
称取一定量β-胡萝卜素晶体溶于20 mL乙酸乙酯溶液中,并加入一定量的催化剂,避光,加热回流反应一定时间,反应结束后取样,利用HPLC在1.3的条件下,以面积归一化法,在波长450 nm处检测样品中β-胡萝卜素各异构体的相对质量分数。
温度对异构化的影响:反应温度分别选定为:50、55、60、65、70、75、78℃,时间为120 min,底物质量浓度为1 mg/mL,催化剂添加量为1 mg/mg,测定产物中各异构体的含量。
时间对异构化的影响:反应温度75℃,反应时间分别选定为30、60、90、120、150、180 min,底物质量浓度为1 mg/mL,催化剂添加量为1 mg/mg,测定产物中各异构体的含量。
底物浓度对异构化的影响:反应温度75℃,反应时间120 min,底物质量浓度分别选定为0.25、0.50、0.75、1、1.25 mg/mL,催化剂添加量为1 mg/mg,测定产物中各异构体的质量分数。
催化剂添加量对异构化的影响:反应温度75℃,反应时间120 min,底物浓度为1 mg/mL,催化剂添加量分别选定为0.2、0.4、0.6、0.8、1、1.2 mg/mg,测定产物中各异构体的含量。
根据单因素实验结果,选择影响异构体含量的各主要因素做正交实验,采用L9(34)设计正交试验,确定最佳制备工艺条件。
1.4.3 标准曲线的制作 准确称取10 mg β-胡萝卜素标品溶于乙酸乙酯中,并定容到100 mL作为储备液,分别吸取储备液1,2,3,4,5,6,7,8 mL于不同的容量瓶中,定容到10 mL,得到质量浓度为10,20,30,40,50,60,70,80 μg/mL的系列标准溶液,以标准溶液的质量浓度为横坐标,以液相谱图中全反式β-胡萝卜素峰面积为纵坐标作图,绘制的β-胡萝卜素标准曲线如下图所示。
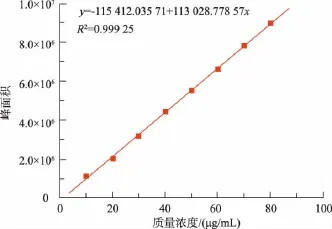
图1 β-胡萝卜素标准曲线Fig.1 Standard curve of β-carotene
由图1可知,得到的标准曲线在10~80 μg/mL浓度范围内线性良好。
1.4.4 降解率的计算 降解率用A表示。

其中,C0为反应前反应液中β-胡萝卜素的质量浓度,C为反应后反应液中β-胡萝卜素的质量浓度。
2 结果与讨论
2.1 β-胡萝卜素顺反异构体的分离鉴定
全反式β-胡萝卜素(样品1)和经异构化处理后的β-胡萝卜素(样品2)的分离效果如图2所示。
由图2可知,对两个样品的色谱图进行对照,可以判定,4号峰应是全反式β-胡萝卜素,样品2的色谱图说明,至少分离得到了5个峰。
样品2分离得到的5个峰代表的是5种极性相近的物质,为了鉴定它们,对样品2进行了正离子模式的HPLC-APCI-MS分析,检测结果如图3所示,其中包括总离子流量图和β-胡萝卜素母离子[M+H+](m/z=537)的提取图。由图3可知,样品2的1 到5号峰都能提取到β-胡萝卜素的母离子,表明这几种物质的相对分子质量与β-胡萝卜素相同,为进一步确定这些峰的归属,研究同时对响应较强的2号峰,4号峰,5号峰进行质谱分析,结果如图4所示。由前文知,4号峰为全反式β-胡萝卜素,同时,图4表明这几种物质与全反式基本相似,所以分离得到的5个峰可能是β-胡萝卜素的顺反异构体。
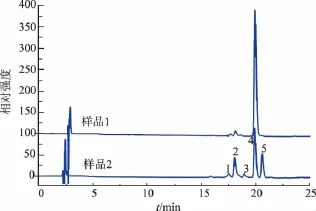
图2 β-胡萝卜素样品1和样品2的HPLC色谱图Fig.2 HPLC chromatograms of 1 and 2 β-carotene samples
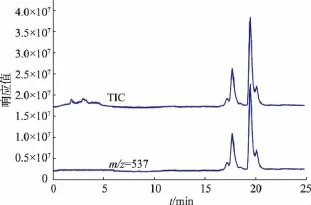
图3 样品2的APCI-MS检测图Fig.3 APCI-MS coupling for identification of sample 2
已有学者利用Q值判定顺式异构体种类[17-20]。顺式异构体的吸收光谱不仅含有主要吸收峰外,还会在330~340 nm间出现一个吸收峰,这被称为“顺式峰”。此顺式峰的吸光度与主峰的吸光度的比值,即被定义为Q值[25-26]。1~5号峰的光谱特征图如图5所示。
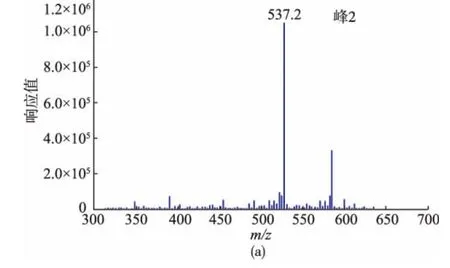
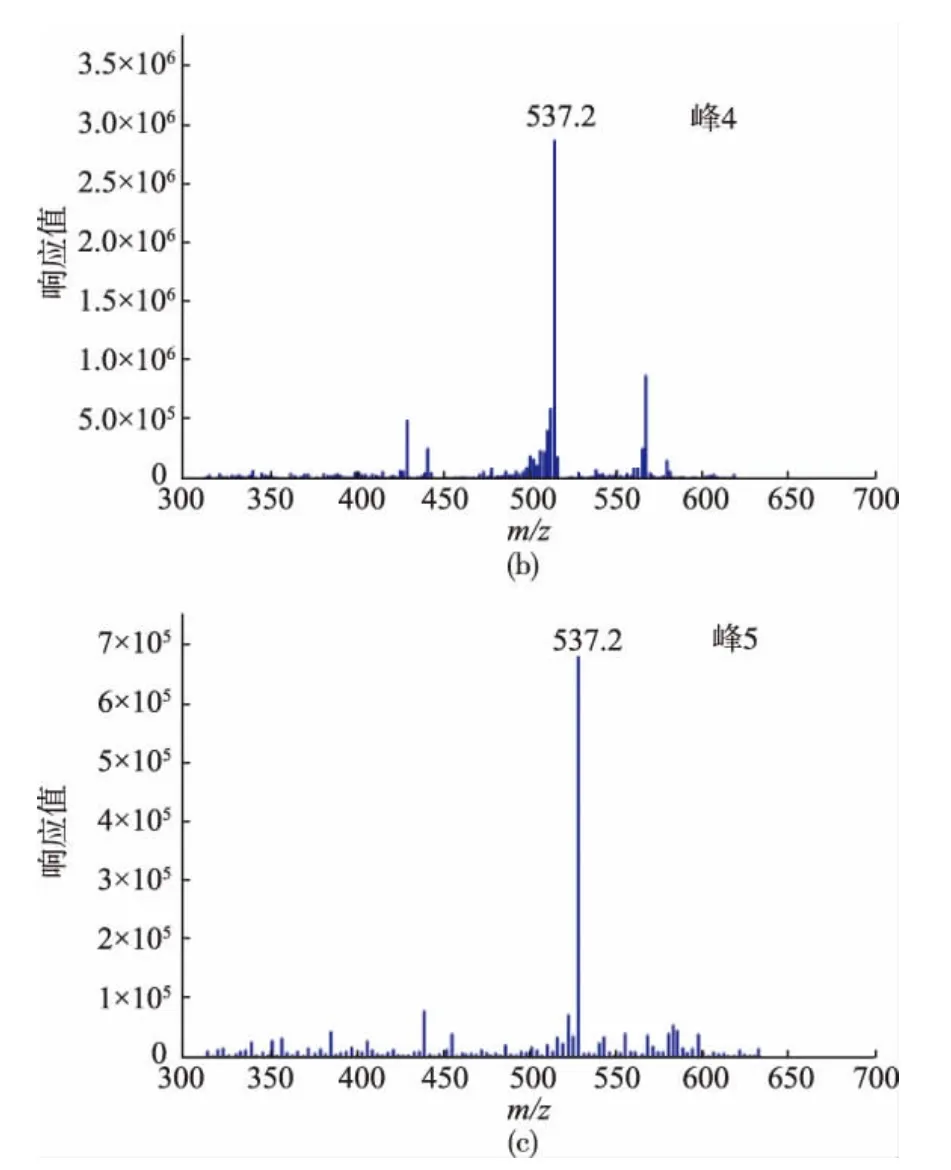
图4 样品2中主要峰(2号,4号和5号)的质谱图Fig.4 Positive ion APCI mass spectra of peaks 2,4 and 5 of sample 2
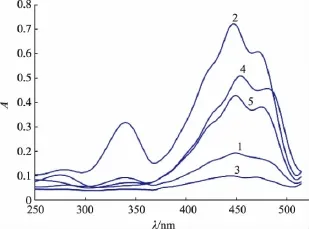
图5 样品5个峰的光谱特征图Fig.5 Spectral overlays of peaks 1-5 of sample 2
由图5可知,5种物质的光谱特征相似,说明它们结构类似。结合质谱检测结果,判定它们为β-胡萝卜素异构体。1~5号峰的Q值计算结果如表1所示,与前人报道的Q值进行比较,结果表明,1~5号峰经鉴定依次为15-顺式、13-顺式、9,13-双顺式、全反式和9-顺式β-胡萝卜素异构体。
2.2 高含量9-顺-β-胡萝卜素制备工艺优化
2.2.1 催化剂种类的筛选 在光照条件下,β-胡萝卜素全反式异构体被碘催化诱导可形成顺式异构体[23]。作者尝试采用单质碘、碘化钾、碘掺杂二氧化钛纳米催化剂,在避光条件下催化全反式β-胡萝卜素形成顺式异构体,反应中保持这3种催化剂中单质碘的质量相同。

表1 β-胡萝卜素顺反异构体的鉴定Table1 Identification of β-carotene isomers
由图6可知,与β-胡萝卜素晶体相比,样品(B,C,D,E)中9-顺式异构体含量和总顺式异构体含量都有所提高,单质碘及碘掺杂二氧化钛纳米催化剂催化的样品(D,E)的9-顺式异构体含量和总顺式异构体含量明显高于仅加热处理及碘化钾催化的样品(B,C)。虽然碘单质和碘掺杂二氧化钛纳米催化剂的催化效果基本相同,但一方面单质碘易升华,另一方面碘单质不能回收重复使用以及反应后需要使用还原剂来除去碘[27]。而碘掺杂二氧化钛纳米催化剂具有易于与反应液分离且可重复利用的优点,这为顺式β-胡萝卜素异构体工业生产提供了可能。

图6 催化剂种类的筛选Fig.6 Screening of catalyst types
2.2.2 温度 由图7中A图可知,随着反应温度的升高,β-胡萝卜素中9-顺式异构体和总顺式异构体含量随之升高,但在超过75℃之后,9-顺和总顺含量有所下降,这是因为乙酸乙酯的沸点在78℃左右,当反应温度在溶剂沸点左右时,反应液沸腾,较多的全反式β-胡萝卜素在反应液面的器皿壁上因溶剂快速挥发而析出,这样就等同于异构化反应的反应物减少,使平衡朝逆反应方向进行,所以会抑制顺式异构体的生成。故初步选择75℃为最佳反应温度。
2.2.3 时间 由图7(b)可知,随着时间的延长,β-胡萝卜素中的9-顺式异构体和总顺式异构体的质量分数随之升高,但在超过120 min后,9-顺式异构体和总顺式异构体含量几乎没有变化,这是因为,随着时间的延长,到120 min左右时,异构化反应趋于平衡,各个异构体的质量分数基本保持不变。故初步选择120 min为最佳反应时间。
2.2.4 底物浓度 由图7(c)可知,随着底物质量浓度的增大,β-胡萝卜素中的9-顺式异构体和总顺式异构体的质量分数变化不大,方差分析表明,各水平间差异不显著(P>0.05),但是当底物质量浓度达到1.25 mg/mL时,反应结束冷却时会有部分β-胡萝卜素晶体析出,因不同异构体在溶剂中溶解度不同,故不仅会影响溶液中各异构体质量分数测定,而且也会给后续分离催化剂带来困难,由于底物质量浓度越大,反应效率也随之增大,故初步选择1 mg/mL为最佳底物质量浓度。
2.2.5 催化剂加量 由图7中D图可知,随着催化剂加量的增大,β-胡萝卜素中的9-顺式异构体和总顺式异构体的含量随之升高,但当催化剂加量达到1.2 mg/mg时,总顺式的质量分数有所降低。可能的原因是催化剂的平均孔径为2.2 nm,部分空间体积小的顺式异构体被过量的催化剂较多吸附,导致总顺式含量降低。故初步选择1mg/mg为最佳催化剂加量。

图7 各条件对β-胡萝卜素异构化的影响Fig.7 Effects of different factors on the isomerization of β-carotene.Each value represents the mean±SD (n=3)
2.2.6 正交试验设计 β-胡萝卜素异构化的正交试验因素水平表见表1,由于反应温度在78℃时,会导致β-胡萝卜素晶体析出,故温度水平设计如表1,正交试验结果及极差分析见表2,对正交试验结果进行方差分析,结果见表3。
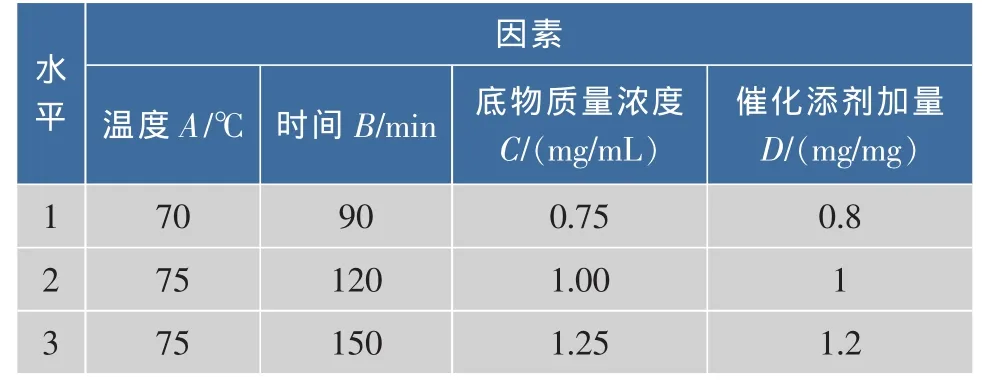
表1 因素与水平设计Table1 Design of factors and levels
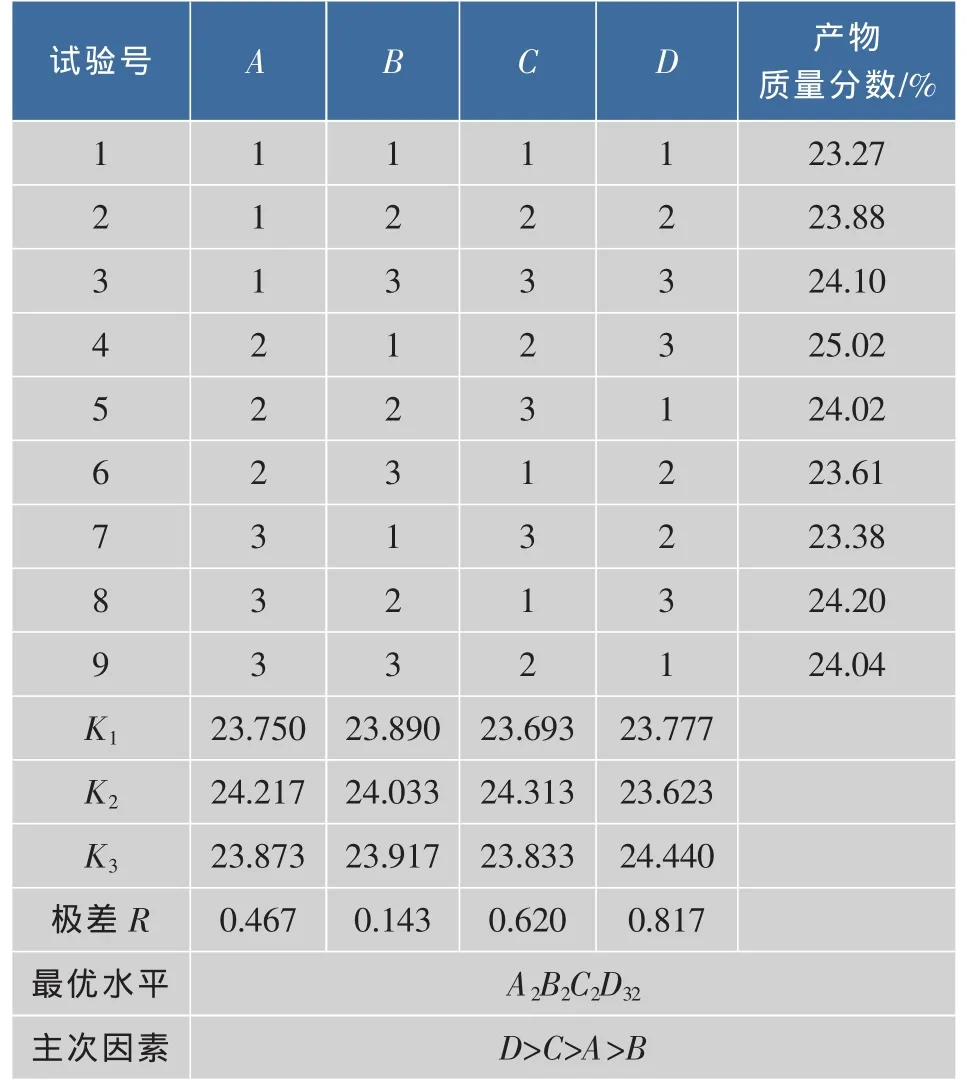
表2 正交试验结果Table2 Results of orthogonal experiments
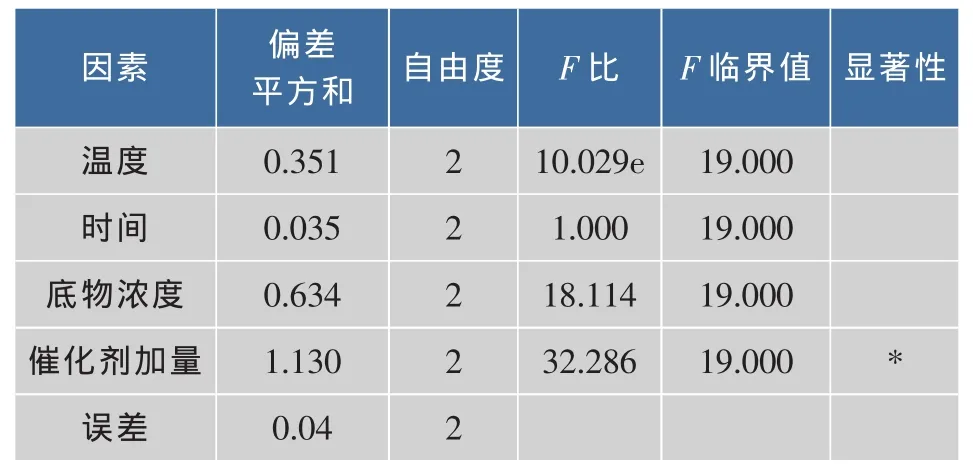
表3 正交试验方差分析结果Table3 Results of variance analysis
极差分析结果表明,4种因素对异构化影响大小依次为催化剂加量>底物质量浓度>温度>时间,方差分析结果表明,催化剂加量对9-顺式异构体质量分数的具有显著影响(P<0.05)。异构化工艺的最优试验条件为A2B2C2D3,由于正交表中不存在此组合,故需做验证试验,验证试验结果表明9-顺式异构体的含量为24.81%,低于正交试验4的结果,故异构化工艺的最优条件为A2B1C2D3,即温度为75℃,时间为90 min,底物质量浓度为1 mg/mL,催化剂加量为1.2 mg/mg。在该条件下,9-顺式β-胡萝卜素异构体相对含量达到25.02%。总顺式异构体的相对质量分数为47.41%。与盐生杜氏藻制备相比,总顺质量分数基本相同,9-顺质量分数为其一半以上,但异构体种类比其多两倍以上。
2.3 降解率的计算
依据1.4.3及1.4.4的方法,在9-顺式β-胡萝卜素异构体最佳制备工艺条件下,β-胡萝卜素降解率经计算为12.6%。
因各β-胡萝卜素异构体的摩尔消光系数不同,利用全反式β-胡萝卜素为标准品计算的β-胡萝卜素降解率结果偏高。
3 结语
碘掺杂二氧化钛纳米催化剂催化全反式β-胡萝卜素异构化,所得产品中至少含有5种β-胡萝卜素异构体,分别为15-顺-,13-顺-,9,13-双顺-,全反式-,9-顺-β-胡萝卜素。
以碘掺杂二氧化钛纳米催化剂催化制备9-顺式β-胡萝卜素异构体的最优条件为:温度75℃,时间为90 min,底物质量浓度为1 mg/mL,催化剂添加量为1.2 mg/mg(基于β-胡萝卜素质量),此时,9-顺式β-胡萝卜素异构体相对质量分数达到25.02%。总顺式异构体的相对质量分数为47.41%。
以碘掺杂二氧化钛纳米催化剂催化制备9-顺式β-胡萝卜素异构体的方法具有操作简单,成本低等特点,这有望实现顺式β-胡萝卜素异构体工业化生产。
[1]王庆利,黄志明,周力.天然β-胡萝卜素的成份分析[A].营养与保健食品发展论坛论文集[C].杭州:浙江省科学技术协会,2004.
[2]LESELLIER E,GURDALE K,TCHAPLA A.Separation of cis/trans isomers of beta-carotene by supercritical fluid chromatography[J].Journal of Chromatography A,1999,844(1-2):307-320.
[3]CEREZO J,ZUNIGA J,BASTIDA A,et al.Antioxidant properties of beta-carotene isomers and their role in photosystems:insights from Ab initio simulations[J].J Phys Chem A,2012,116(13):3498-3506.
[4]LEVIN G,YESHURUN M,MOKADY S.In vivo antiperoxidative effect of 9-cis beta-carotene compared with that of the all-trans isomer[J].Nutrition and Cancer-an International Journal,1997,27(3):293-297.
[5]HARARI A,HARATS D,MARKO D,et al.A 9-cis beta-carotene-enriched diet inhibits atherogenesis and fatty liver formation in LDL receptor knockout mice[J].Journal of Nutrition,2008,138(10):1923-1930.
[6]YE Z W,JIANG J G,WU G H.Biosynthesis and regulation of carotenoids in Dunaliella:Progresses and prospects[J]. Biotechnology Advances,2008,26(4):352-360.
[7]HEINONER O P,ALBANES D.The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers[J].New England Journal of Medicine,1994,330(15):1029-1035.
[8]JAYAPPRIYAN K R,RAJKUMAR R,Venkatakrishnan V,et al.In vitro anticancer activity of natural β-carotene from Dunaliella salina EU5891199 in PC-3 cells[J].Biomedicine&Preventive Nutrition,2013,3(2):99-105.
[9]BLUMBERG J,BLOCK G.The Alpha-tocopherol,beta-carotene cancer prevention study in finland[J].Nutrition Reviews,1994,52(7):242-245.
[10]OMENN G S,GOODMAN G E,THORNQUIST M D,et al.Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease[J].New England Journal of Medicine,1996,334(18):1150-1155.
[11]惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:336.
[12]BEN-Amotz A,LERS A,AVRON M.Stereoisomers of beta-carotene and phytoene in the alga dunaliella bardawil[J].Plant Physiol,1988,86(4):1286-1291.
[13]仇丹,吴月婵,金兴江,等.类胡萝卜素几何异构化反应的研究进展[J].食品科技,2010,35(11):257-261. QIU Dan,WU Yuechan,JIN Xingjiang,et al.Advance in isomerization of carotenoids[J].Food Science and Technology,2010 (11):257-261.(in Chinese)
[14]李杰.β-胡萝卜素异构化反应的研究[D].杭州:浙江大学,2006.
[15]KNOCKAERT G,PULISSERY S K,LEMMENS L,et al.Isomerisation of carrot beta-carotene in presence of oil during thermal and combined thermal/high pressure processing[J].Food Chemistry,2013,138(2-3):1515-1520.
[16]张环伟.番茄红素异构化及立体异构体分离方法研究[D].无锡:江南大学,2010.
[17]QIU D,CHEN Z R,LI H R.Effect of heating on solid beta-carotene[J].Food Chemistry,2009,112(2):344-349.
[18]仇丹,陈志荣,李浩然.β-胡萝卜素异构体的定性分析[J].食品科学,2008,29(4):50-53. QIU Dan,CHEN Zhirong,LI Haoran.Qualitative analysis of β-carotene isomers[J].Food Science,2008,29(4):50-53.
[19]INBARAJ B S,CHIEN J T,CHEN B H.Improved high performance liquid chromatographic method for determination of carotenoids in the microalga Chlorella pyrenoidosa[J].J Chromatogr A,2006,1102(1-2):193-199.
[20]YI J,LI Y,ZHONG F,et al.The physicochemical stability and in vitro bioaccessibility of beta-carotene in oil-in-water sodium caseinate emulsions[J].Food Hydrocolloids,2014,35:19-27.
[21]CHEN J P,TAI C Y,CHEN B H.Improved liquid chromatographic method for determination of carotenoids in Taiwanese mango (Mangifera indica L.)[J].Journal of Chromatography A,2004,1054(1-2):261-268.
[22]TSUKIDA K,SAIKI K.Separation and determination of cis/trans-β-carotenes by high-performance liquid chromatography[J]. Journal of Chromatography,1982,245:359-364.
[23]惠伯棣,李京,裴凌鹏,等.C30-HPLC-PDA分离与鉴定β,β-胡萝卜素几何异构体[J].食品科学,2006,27(10):252-255. HUI Bodi,LI Jing,PEI Lingpeng et al.Separation and Identification of β,β-carotene Geometrical Isomers by C30-HPLC-PDA [J].Food Science,2006,27(10):252-255.(in Chinese)
[24]LIU S,LIN J,YANG D.Determination of cis-and trans-α-and β-carotenoids in Taiwanese sweet potatoes(Ipomoea batatas (L.)Lam.)harvested at various times[J].Food Chemistry,2009,116(3):605-610.
[25]CHEN B H,CHEN Y Y.Stability of chlorophylls and carotenoids in sweet potato leaves during microwave cooking[J].Journal of Agricultural and Food Chemistry,1993,41(8):1315-1320.
[26]VECCHI M,ENGLERT G,MAURER R,et al.Separation and characterization of the cis-isomers of β-carotene[J].Helvetica Chimica Act,1981,64(8):2746-2758.
[27]刘星明,袁先友.碘催化剂在精细有机物合成中的研究进展[J].湖南科技学院学报,2008,29(4):55-58. LIU Xingming,YUAN Xianyou.Development on the catalysis of iodine in fine organic synthesis[J].Journal of Hunan University of Science and Engineering,1981,64(8):2746-2758.(in Chinese)
Catalytic Isomerization of β-Carotene and Preparation of 9-Cis β-Carotene
YAN Hongxiao1, SUN Qingrui1,2, LI Dong2,4, ZHANG Lianfu*1,3
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Food College,Heilongiiang Bayi Agricultural University,Daqing 163319,China;3.National Engineering Research Center for Functional Food,Jiangnan University,Wuxi 214122,China;4.School of Life Science and Chemical Engineering,Huaiyin Institute of Technology,Huaian 223001,China)
Among all β-carotene isomers,9-cis-β-carotene may be the most active one.The study first catalyzed the isomerization of β-carotene using the iodine doped Tio2 nano catalyst in an ethyl acetate system.HPLC-APCI-MS analysis showed the products contained 15-cis-,13-cis-,9,13-cis-,all-trans-and 9-cis-β-carotenes.On the basis of single factor and orthogonal experiments,the optimal parameters to produce 9-cis-β-carotene were determined to be reaction temperature 75℃,time 90 min,β-carotene concentration 1 mg/mL and catalyst dosage 1.2 mg/mg β-carotene,whichresulted in a concentration of 25.02%for 9-cis-β-carotene and a concentration of 47.41%for all cis-isomers with a β-carotene degradation rate of 12.6%.Therefore,catalyzing the β-carotene isomerization with the iodine doped Tio2 nano catalyst was a simple and low cost method for the production of a high content of 9-cis-β-carotene.
β-carotene,isomers,HPLC-APCI-MS,isomerization
S 641.2
A
1673—1689(2016)07—0739—08
2014-12-30
国家“十二五”科技支撑计划项目(2012BAD33B05)。
张连富(1967—),男,河北唐山人,工学博士,教授,主要从事功能性食品研究。E-mail:lianfu@jiangnan.edu.cn
