人胰岛素原基因在大肠杆菌中的可溶性表达及分离纯化研究
2016-10-10沈加斌李鑫雨郑海燕
沈加斌, 徐 攀, 李鑫雨, 张 立, 郑海燕, 雍 彬
(四川师范大学 生命科学学院,四川 成都 610101)
人胰岛素原基因在大肠杆菌中的可溶性表达及分离纯化研究
沈加斌, 徐 攀, 李鑫雨, 张 立, 郑海燕, 雍 彬*
(四川师范大学 生命科学学院,四川 成都 610101)
根据NCBI中的人胰岛素原基因序列及大肠杆菌密码子偏爱性设计特异引物,PCR扩增得到人胰岛素原基因,构建该基因的原核表达质粒pET32-PI,重组质粒转化大肠杆菌BL21 (DE3)。对重组菌进行温度和IPTG浓度优化,发现重组菌在30℃和终浓度为0.6 mmol/L的IPTG条件下表达效果最好且没有包涵体,经SDS-PAGE和Westem blot检测,表达蛋白的相对分子质量与理论相对分子质量一致且具有胰岛素的免疫原性,证明胰岛素原基因得到了正确表达。对重组菌进行流加发酵,发酵液离心收集菌体,破菌后上清液过亲和层析柱和离子交换柱分离纯化目的蛋白,透析后的样品用肠激酶和羧肽酶酶切,利用亲和柱去除融合蛋白与His标签,最终分离胰岛素样品,利用免疫酶标法,l mL样品测得活性92 μIU,证明实验所得样品具有人胰岛素活性。
人胰岛素原;大肠杆菌;发酵;分离纯化
糖尿病(Diabetes Mellitus,DM)是由于体内胰岛素相对或绝对分泌不足,或因胰岛素的生物效应降低,而引起糖、脂肪和蛋白质代谢异常的一种慢性终身性疾病[1-3]。20世纪80年代起重组DNA技术开始用于人胰岛素的生产,目前人胰岛素基因可在大肠杆菌、枯草芽孢杆菌、链球菌、毕赤酵母及小鼠中表达,而主要的表达系统有两个:大肠杆菌表达系统和酵母表达系统[4-10]。在酵母系统中胰岛素的产量较低且成本高昂,大肠杆菌中表达产物有时容易形成包涵体,但是通过密码子优化、降低培养温度、添加促溶标签及更换诱导剂等条件可以减少包涵体生成,而且其生产成本较低、背景清楚等优点使得大肠杆菌依然是胰岛素表达的理想宿主,因此对于胰岛素原基因序列及表达条件的优化对于胰岛素工业化生产具有重要的意义。作者对人胰岛素原基因进行密码子优化,合成人胰岛素原基因寡核苷酸片段,通过片段连接和PCR扩增得到人胰岛素原基因,将优化基因与原核表达载体pET32(a+)连接转化大肠杆菌BL21(DE3),重组菌经过培养温度和IPTG浓度的优化,明显降低了包涵体的产生,并通过亲和层析和离子交换层析分离得到目的蛋白,酶切和纯化后对得到的重组胰岛素活力进行了测定。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养基 大肠杆菌菌株E.coli JM109、E.coli BL21(DE3):购自北京天根生物科技公司;质粒 pET32a(+):购自Novagen公司;质粒pMD18-T:购自大连宝生物公司;LB培养基(组分g/ L):NaCl 10 g,蛋白胨10 g,酵母粉5 g,pH值7.0。种子培养基(组分g/L):蛋白胨1 g,酵母粉0.5 g,NaCl 1 g,氨苄青霉素 0.1 mg;发酵培养基(组分g/ L):蛋白胨1 g,Yeast Extract 0.5 g,Na2HPO4·12H2O 17.5 g,KH2PO43 g,NaCl 0.5 g,NH4Cl 1 g,葡萄糖10 g,MgSO4·7H2O 0.5 g,微量元素溶液 2.5 mL;补料培养基:葡萄糖 600 g,MgSO4·7H2O 17 g,微量元素溶液 2.5 mL;微量元素溶液:FeCl3·6H2O 27 g,ZnCl2·4H2O 2 g,CaCl2·6H2O 2 g,NaMoO4·2H2O 2 g, CuSO4·5H2O 1.9 g,H32BO30.5 g,CoCl2·6H2O 2 g,MnSO4·H2O 2.5 g。
1.1.2 主要仪器和试剂 5415D离心机、5810R冷冻离心机:购自德国Eppendorf公司;UV-250 IPC分光光度计:购自日本岛津公司;凝胶成像系统:购自德国UVP公司;TC-25/H PCR仪:购自杭州大和热磁电子有限公司;5L BIOFLOⅢ生物发酵罐:购自美国NBS公司;超声细胞粉碎器:购自美国Heat Sys-Ultrasonics公司;限制性核酸内切酶Kpn I、EcoR I,DNA聚合酶 rTaq,核酸相对分子质量Marker DL2000: 购自大连宝生生物公司;T4 Polynucleotide Kinase、T4 DNA Ligase:购自美国NEB公司;鼠抗insulin抗体:购自美国NEB公司;碱性磷酸酶标记的羊抗鼠二抗及碱性磷酸酶显色底物:购自美国KPL公司;PVDF膜:购自美国Milliopore公司;质粒提取试剂盒、PCR纯化试剂盒、胶回收试剂盒:购自美国Omega Bio-tek公司;其他化学试剂(进口或国产分析纯)成都化学试剂公司。
1.2 方法
1.2.1 引物设计 根据Genebank中公布的人胰岛素原基因的序列 (Accession number:BT006808)为模板,同时利用Java Codon Adaptation Tool软件[13]中的大肠杆菌氨基酸密码子的偏嗜性对人胰岛素基因进行密码子优化,利用优化后的序列和pET32a (+)载体序列进行引物设计,共合成14条引物用于该基因的合成(见表1)。
1.2.2 引物磷酸化与连接反应 将合成的14条引物片段分别取1 μL加入EP管中,使用T4 Polynucleotide Kinase在37℃温育1.5 h进行磷酸化反应,将以上磷酸化的引物片段用PCR纯化试剂盒纯化,纯化后的片段使用T4 DNA Ligase在16℃下连接过夜并再次纯化,得到DNA连接片段。
1.2.3 人胰岛素原基因克隆 以连接后的片段为模板,根据该基因的序列设计引物,引物序列如下所示:PIF1E:5’-GTCGGTACCGACGACGACGACA AGTTCGTTAACCAGCACCTG-3’,PIR7E:5’-TAAG AATTCTTATTAGTTGCAGTAGTTTTCCAG-3’。通过PCR的方法进行人胰岛素原基因的扩增,PCR反应条件如下:94℃预变性3 min,94℃变性 30 s,56℃退火30 s,72℃延伸25 s,72℃延伸7 min,反应后放置于4℃保存。将以上PCR反应后的产物,经1 g/dL琼脂糖凝胶电泳鉴定后,琼脂糖凝胶回收PCR产物与pMD18-T载体连接,转化大肠杆菌JM109感受态细胞,并使用氨苄抗性的LB平板进行筛选,挑取单菌落进行PCR与酶切验证,并送至北京六合华大基因公司进行测序,最终得到pMD18-T-PI质粒。

表1 磷酸化反应所用引物Table1 Sequence of the primers used in phosphorylation reaction
1.2.4 表达载体构建 pMD18-T-PI与pET32(+)载体分别用KpnI和EcoR I进行双酶切,37℃酶切3~4 h,1 g/dL琼脂糖电泳鉴定酶切产物,对目的基因片段和载体片段进行胶回收和纯化,使用T4 DNA Ligase对酶切后的PI基因片段和pET32(+)载体片段进行连接,连接后的产物转化大肠杆菌BL21(DE3),获得转化子,对转化子进行菌液PCR验证。
1.2.5 人胰岛素原基因的诱导表达及 Western Bloting验证 挑取阳性菌株E.coli BL21/pET32-PI接种于2 mL含有氨苄的LB液体培养基中,在37℃、250 r/min摇床中培养12 h,将500 μL菌液接入含有50 mL液体LB培养基的三角瓶中,分别在37、32、30、28和25℃等5个温度条件下进行培养,当A600 nm为0.6左右时进行蛋白诱导表达,研究温度对PI基因表达的影响。在30℃培养条件下,分别使用终浓度为0.2、0.4、0.6、0.8 mmol/L的IPTG(异丙基-β-D硫代半乳糖苷)诱导,分析诱导剂浓度对PI基因表达的作用,确定最适诱导剂浓度。将IPTG诱导表达的菌体及破菌后上清和沉淀的样品经SDS-PAGE电泳转移至PVDF膜后,用鼠抗人胰岛素单克隆抗体作为一抗,磷酸酶(Ap)标记的羊抗豚鼠IgG作为二抗,进行Western Blotting印迹分析。
1.2.6 流加发酵 挑取阳性克隆菌落至40 mL种子培养基中培养,温度37℃,振荡培养12 h。然后再转接于400 mL种子培养基中,接种后培养直至pH和溶解氧均突然急剧上升,表示葡萄糖已耗尽,开始进入补料分批培养阶段,此时按指数流加模式流加补料培养基,然后将温度降到30℃,加入终浓度为0.6 mmol/L的IPTG诱导培养,补料速度以维持大肠杆菌的比生长速率为0.1 h-1左右为准。诱导3~4 h后离心收菌。使用美国NBS公司BIOFLOⅢ5 L工作体积发酵罐发酵。起始工作体积4 L,温度:生长期为37℃,诱导期为30℃;自动流加体积分数28%的氨水使pH值控制在7.0;溶氧(DO)保持在30%左右,补料速度按照下面公式估算[14]
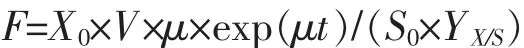
其中F为补料速度(mL/h),X0为补料时细胞干重(g/L),V为补料初期的体积(L),μ为比生长速率(h-1),t为时间 (h),S0为补料液中葡萄糖的质量浓度(g/L),YX/S为大肠杆菌对葡萄糖的产率(g/g)。通过试验,对于以上参数初始补料时约为X0=2.6 g/L,V=3 L,S0=0.5 g/L,YX/S=0.36 g/g,u=0.3 h-1。
从发酵开始,每隔1 h取样,测定其A600 nm,同时用GOD-POD法测定葡萄糖浓度。另外无菌取样,用灭菌的LB液体培养基做适当的稀释,接种于不含氨苄的LB平板,37℃培养过夜,然后从上面随机挑取100个单克隆接种在含氨苄的LB平板上,37℃培养过夜,记数菌落数,按照下面公式计算质粒稳定性。质粒稳定性(%)=(含氨苄的LB平板菌落数/ 100)×100
1.2.7 蛋白纯化 将5 L发酵罐发酵后收集的菌体取适量加入Tris-HCl缓冲液 (20 mmol/L NaCl,20 mmol/L Tris-HCl,1 mmol/L MDTT)中,分别用最高压力45 MPa破菌6次、最高压力55 MPa破菌5次和最高压力65 MPa破菌4次,处理菌液,将沉淀和上清一起进行SDS-PAGE电泳,找出破菌的最合适的压力和次数。将破菌后的样品首先进行亲和层析,用5倍以上柱体积起始缓冲液 (pH 7.8,20 mmol/L Tris-HCl)平衡层析柱,以l mL/min流速上样,依次用10、30、50、100 mmol/L咪唑洗脱,洗脱时用紫外检测仪在线检测,收集洗脱峰;将亲和柱纯化后的样品液以l mL/min的流速过离子交换柱,连接紫外检测仪在线检测,分别用含 0.1、0.2、0.3、0.4、0.5 mol/L NaCl的20 mmol/L Tris-HCl作为洗脱缓冲液阶梯洗脱,连接紫外检测仪在线检测,收集洗脱峰。
1.2.8 成熟胰岛素制备及活力测定 酶切反应:将酶切缓冲液 (25 mmol/L Tris-HCl,pH 7.8,l mmol/L CaCl2,0.1%Tween-20,1 mmol/L DTT)与经过透析后的样品液按1∶9混合均匀,按照测定的蛋白浓度加入EK酶和羧肽酶,恒温25℃酶切12 h。将酶切后的样品先过亲和柱,除去硫氧还蛋白和组氨酸标签,收集穿透液过sephadexG-50凝胶层析,分离胰岛素与连接肽,流动相为去离子水,流量为1 mL/ min,检测波长280 nm,收集洗脱峰。收集得到的胰岛素样品送北京市德易临床检验所用免疫酶标法对胰岛素活性进行测定。

图1 人胰岛素原基因序列与优化后序列的比较Fig.1 Comparison of native and optimized PI gene sequence
2 结果与讨论
2.1 基因克隆
首先将经密码子优化后(如图1所示)合成的胰岛素原基因引物片段进行磷酸化处理,并使用T4 DNA Ligase连接,经纯化后做为模板进行PCR扩增,1 g/dL琼脂糖电泳结果发现在290 bp处有清晰条带(如图2(a)所示),与预期扩增的基因大小基本相符。将扩增得到的基因片段首先连接到pMD18-T载体上,转化大肠杆菌JM109,构建得到pMD18-PI质粒。对该质粒进行双酶切(如图2(b)所示),结果表明PI基因成功连接到pMD18-T载体上,将质粒送至华大基因公司进行测序。

图2 pMD18-PI质粒构建的凝胶电泳Fig.2 Construction of replication plasmid pMD18-PI

图3 pET32-PI表达载体的构建Fig.3 Construction of the expression vector pET32-PI
2.2 重组表达质粒的构建
对pMD18-PI和pET32a(+)分别使用Kpn I与EcoR I进行双酶切处理,胶回收片段大小为290 bp 的PI基因片段以及5 900 bp的pET32a(+)线性片段,并使用T4 DNA Ligase过夜连接得到重组质粒(如图3所示),连接产物转化大肠杆菌JM109,在抗性平板上挑取阳性克隆菌落,将提取得到的重组质粒进行PCR(如图4所示)和测序鉴定,最终得到表达质粒pET32-PI。
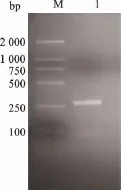
图4 pET32-PI质粒PCR验证结果Fig.4 PCR results of pET32-PI
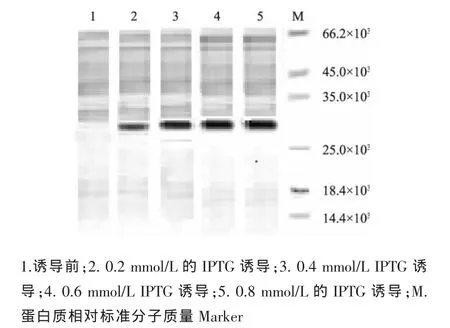
图5 不同浓度的IPTG诱导对目的蛋白表达的影响Fig.5 Effect of the different IPTG density on target protein expression
2.3 诱导表达
将表达质粒pET32-PI转入BL21,挑取单菌落进行蛋白诱导表达,分别使用终质量浓度为0.2、0.4、0.6、0.8 mmol/L的IPTG进行诱导表达,结果发现IPTG浓度从0.2 mmol/L到0.6 mmol/L蛋白表达量持续增加,而0.6 mmol/L与0.8 mmol/L时表达量相差不大,因此选择0.6 mmol/L IPTG作为诱导表达浓度(如图5所示)。重组菌使用25、28、32、37℃进行温度梯度诱导表达(图6(a)),结果发现在25℃和28℃诱导表达时融合蛋白存在于上清溶液中,而在32℃条件下诱导表达时,表达产物有部分出现在沉淀中;在37℃诱导表达时,表达的融合蛋白大部分出现在沉淀中。在30℃条件下诱导表达,结果表达产物基本都出现在上清(图6(b)),且表达量较高,因此选择30℃为诱导温度。
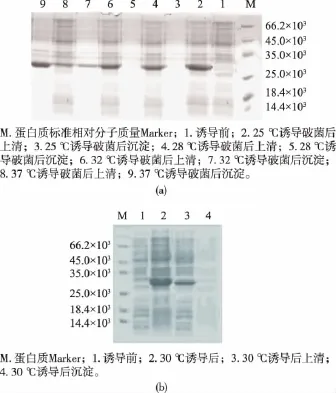
图6 不同温度诱导对目的蛋白表达的影响Fig.6 Effect of different temperature on target protein expression
2.4 流加发酵
大肠杆菌首先在分批发酵的条件下生长5.5 h,A600 nm即达28左右,此时加入诱导剂IPTG开始诱导,并且控制μ为0.25左右,4 h后A600 nm达到58左右。通过对发酵液中菌体的质粒稳定性测试,发现发酵11 h后质粒的稳定性为95%,表明该表达质粒在大肠杆菌中保持了较高的稳定性。
2.5 蛋白纯化
作者用含 20 mmol/L NaCl、pH 7.8、1 mmol/L DTT、20 mmol/L Tris-HCl作为缓冲液,最高压力分别选择450、550、650 MPa进行破菌,发现在最高压力为650 MPa破菌4次,表达的融合蛋白完全在上清液中。破菌后的样品使用亲和柱纯化,洗脱缓冲液分别用10、30、50、100 mmol/L咪唑洗脱,收集洗脱液进行SDS-PAGE电泳,结果如图8所示10 mmol/L咪唑洗脱时有部分目的蛋白被洗脱下来,30 mmol/L咪唑几乎全部洗下柱子上的目的蛋白,50 与100 mmol/L咪唑洗脱时目的蛋白很难被洗下,因此采用30 mmol/L咪唑进行洗脱。从电泳图来看,经过亲和层析后的目的蛋白还含有少量杂质,需进一步纯化处理。因此将亲和层析后的样品,经过透析处理后使用离子交换柱再次纯化,用不同浓度NaCl洗脱,从0.1 mol/L开始阶段洗脱,直到无洗脱峰出现。如图9所示,以0.2 mol/L浓度NaCI洗脱时紫外吸收示数可达最高,最高值为0.8,最终得到纯度较高的蛋白样品。
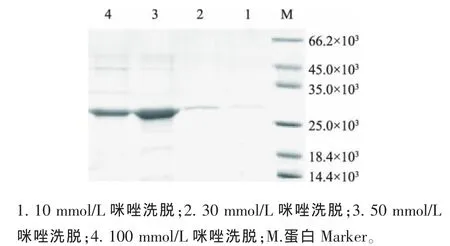
图7 亲和柱阶段洗脱样品SDS-PAGE电泳图Fig.7 Analysis of SDS-PAGE on step-wise affinity elution samples
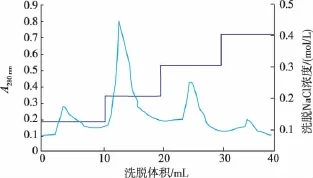
图8 离子交换层析阶段洗脱曲线Fig.8 Step-wise elution curves of ion exchange
2.6 Western Blot鉴定
将纯化后的胰岛素原蛋白样品经SDS-PAGE电泳转移至PVDF膜后,以鼠抗人胰岛素单克隆抗体作为一抗,磷酸酶(Ap)标记的羊抗豚鼠IgG作为二抗进行Western Blot印迹分析。如图9所示,蛋白质免疫印迹的PVDF膜的有明显的条带,这表明重组PI蛋白可以与抗体杂交,因此纯化得到的PI蛋白具有免疫活性。
2.7 酶活力测定
将纯化后的胰岛素原蛋白使用EK酶去除硫氧还蛋白和组氨酸标签,用羧肽酶水解胰岛素原蛋白得到成熟胰岛素。洗脱图谱如图10所示,凝胶层析出现两个洗脱峰,收集第一个洗脱峰即为重组人胰岛素样品液,最终得到纯化的胰岛素与连接肽。将分离纯化后的样品送北京市德易临床检验所用免疫酶标法对胰岛素活性进行测定,检测结果为l mL样品液中胰岛素活性为92 μIU,证明作者所制备的样品具有胰岛素活性。

图9 Western Blot检测重组PI蛋白Fig.9 Western Blot analysis of the recombinant PI
3 结语
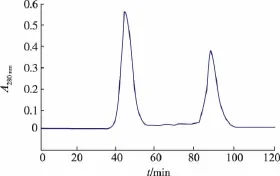
图10 酶切后凝胶层析图谱Fig.1 0 Profile of Sephades G-50 gel chromatography after enterokinase
糖尿病的治疗药物有很多种,I型糖尿病由于是体内胰岛素的绝对缺乏造成的,所以胰岛素类药物是治疗I型糖尿病的必需特效药物;II型糖尿病患者出现胰岛素缺乏时,也需要胰岛素治疗[15-16]。因此胰岛素在糖尿病的治疗中有着举足轻重的地位和广阔的开发前景。作者对人胰岛素原基因进行密码子优化,与pET32a(+)质粒连接后实现了该基因在大肠杆菌BL21中的成功表达,作者对胰岛素原基因的诱导表达条件进行了探索,发现了诱导最适温度和诱导剂浓度,并通过亲和层析和离子交换层析成功得到了较纯的胰岛素原蛋白,酶切纯化后的胰岛素经活力测定具有一定的胰岛素活性。在样品制备过程中由于缓冲液条件与生理条件不同或者其他因素的影响,而导致样品中部分胰岛素生物活性的丧失,今后可以对胰岛素原及成熟胰岛素的纯化条件进一步探索以保证胰岛素的活性及稳定性。
[1]蔺忆,高翠翠,陈立立,等.GABA对高糖诱导氧化损伤的RIN-m5f细胞的保护作用和机制 [J].食品与生物技术学报,2015,34(2):195-200.
LIN Yi,GAO Cuicui,CHEN Lili,et al.Effect of GABA on RIN-m5f cells in high glucose-induced oxidative injury model[J]. Journal of Food Science and Biotechnology,2015,34(2):195-200.(in Chinese)
[2]舒向荣,王霆,程泽能,等.肌醇类物质降血糖作用的研究进展[J].中南药学,2009,7(1):43-46. SHU Xiangrong,WANG Ting,CHENG Zenen,et al.Advance research on the hypoglycemic mechanism of sequoyitol and inositol substances[J].Central South Pharmacy,2009,7(1):43-46.(in Chinese)
[3]DESHPANDA A D,HARRIS-HAYES M,SCHOOTMAN M.Epidemiology of diabetes and diabetes-related complications[J]. Physical Therapy,2008,88(11):1254-1264.
[4]PERLER F,EFSTRATIADIS A,LOMEDICO P,et al.The evolution of genes:the chicken preproinsulin gene[J].Cell,1980,20 (2):555-566.
[5]BELL G I,PICTET R L,RUTTER W J,et al.Sequence of the human insulin gene[J].Nature,1980,284(5751):26-32.
[6]QIAN X,KRAFT J,NI Y,et al.Production of recombinant human proinsulin in the milk of transgenic mice[J].Scientific Reports,2014,4:6465.
[7]STOLL R W,TOUBER J L,MENAHAN L A,et al.Clearance of porcine insulin,proinsulin,and connecting peptide by the isolated rat liver[J].Experimental Biology and Medicine,1970,133(3):894-896.
[8]陈燕,李金照,夏令朝,等.人胰岛素原基因在大肠杆菌中高效外分泌表达[J].生物化学杂志,1995,11(6):637-641. CHEN Yan,LI Jinzhao,XIA Lingchao,et al.Secretive expression of human proinsulin gene at high level in E.coli[J].Chinese Biochemical Journal,1994,11(6):636-641.(in Chinese)
[9]COWLEY D J,MACKIN R B.Expression,purification and characterization of recombinant human proinsulin[J].FEBS Letters,1997,402(2):124-130.
[10]WINTER J,NEUBAUER P,GLOCKSHUBER R,et al.Increased production of human proinsulin in the periplasmic space of Escherichia coli by fusion to DsbA[J].Journal of Biotechnology,2000,84(2):175-185.
Soluble Expression and Purification of Human Proinsulin in Escherichia coli.
SHEN Jiabin, XU Pan, LI Xinyu, ZHANG Li, ZHENG Haiyan, YONG Bin*
(College of Life Science Sichuan Normal University,Chengdu 610101,China)
The human proinsulin gene(PI)was cloned by PCR using specific primers designed according to the PI gene sequcence in NCBI and codon in Escherichia coli.The expression plasmid pET32-PI was constructed to express fusion protein of PI in E.coli BL21(DE3).The recombinant PI protein in E.coli exhibited the best expression at an optimized condition of 30℃and 0.6 mmol/L Isopropyl β-D-Thiogalactoside (IPTG).The results of SDS-PAGE and Western blot analysis indicated that the PI protein was successfully expressed at the same molecular weight as the known PI protein.After the Fed-batch fermentation and centrifugation,this protein was purified to homogeneity using the Ni-NTA affinity chromatography and ion exchange chromatography,respectively.Proinsulin was converted to mature insulin through the digestion of enterokinase and carboxypeptidase.The digested product was purified by Ni-NTA affinity chromatography.The enzyme activity of recombinant insulin was 92 μlU/mL and the product was proved to possess theactivity of human insulin.
proinsulin,Escherichia coli,ferment,separation and purification
Q 789
A
1673—1689(2016)07—0721—07
2015-01-01
国家自然科学基金项目(21472132)
雍 彬(1973—),男,四川南充人,理学博士,副教授,硕士研究生导师,主要从事微生物基因工程研究。
E-mail:binyong1225@163.com
