催化动力学光度法测定微量元素铜(Ⅱ)
2016-10-10韩友
韩友
(延安大学 化学与化工学院,陕西 延安 716000)
催化动力学光度法测定微量元素铜(Ⅱ)
韩友
(延安大学化学与化工学院,陕西延安716000)
基于在pH=11.0的NH3-NH4Cl缓冲溶液中,在邻菲啰啉存在下,铜(Ⅱ)对双氧水氧化紫脲酸铵的褪色反应具有催化作用,建立了催化动力学光度法测定微量元素铜(Ⅱ)的新方法.该方法的线性范围为0.01~0.15μg/mL,检出限为1.4×10-3μg/mL.对0.1μg/mL的铜(Ⅱ)进行11次测定,测得相对标准偏差为1.3%,用于样品(海带、延河水)中微量铜的测定,结果满意.
催化动力学光度法;铜;紫脲酸铵;双氧水
铜是生活中最常见的金属元素之一,且在人体内具有非常重要的作用[1-2].目前测定铜离子的方法主要有电位滴定法[3]、分光光度法[4]、原子吸收法[5]、化学发光法[6]、极谱法[7]、电化学法[8]、差分脉冲极谱法[9]等.但由于催化动力学光度法具有设备低廉、成本低、操作简单、灵敏度高等优点,因而备受关注.本实验研究发现在pH=11.0的NH3-NH4Cl缓冲溶液中,在邻菲啰啉存在下,铜(Ⅱ)对双氧水(H2O2)氧化紫脲酸铵的褪色反应具有良好的催化作用,并由实验建立了催化动力学光度法测定微量铜的新方法,用于试样(海带、延河水)中所含微量铜的测定,结果满意.
1 实验部分
1.1主要实验仪器和试剂
722型分光光度计(上海精密科学仪器有限公司);
铜 (Ⅱ)标准储备溶液(1.0mg/mL):准确称取0.629g CuSO4溶于水中后,加几滴H2SO4(1:1)酸化,待完全溶解后转入250mL的容量瓶中定容,摇匀,使用时稀释为1.0ug/mL的标准溶液.所用试剂均为分析纯,水为二次蒸馏水.
1.2实验方法
取两支10mL比色管,分别加入1g/L紫脲酸铵2.50mL,pH=11.0的缓冲溶液1.00mL,3%的H2O21.00mL,邻菲啰啉1.50mL.向其中一支比色管中加入适量的Cu2+标准溶液(吸光度为A),另一支比色管中不加Cu2+标准溶液(吸光度为A0),分别定容、摇匀.同时置于50℃恒温水浴锅加热3min,取出后迅速用流水冷却至反应终止.本实验以蒸馏水为参比,用1cm的比色皿,于波长520nm处分别测定吸光度A 和A0,并计算ΔA=A0-A值.
2 实验结果与讨论
2.1吸收曲线
由实验方法分别配制催化与非催化体系,以蒸馏水为参比,于不同波长处,分别测定两体系的吸光度,绘制吸收曲线(见图1),结果表明:曲线2高于曲线1许多,可知Cu2+对H2O2氧化紫脲酸铵的反应具有很好的催化作用;两吸收曲线的最大值均在520nm处,且此处的ΔA值最大,说明在该波长处催化作用最为明显.因此选用520nm为测量波长.
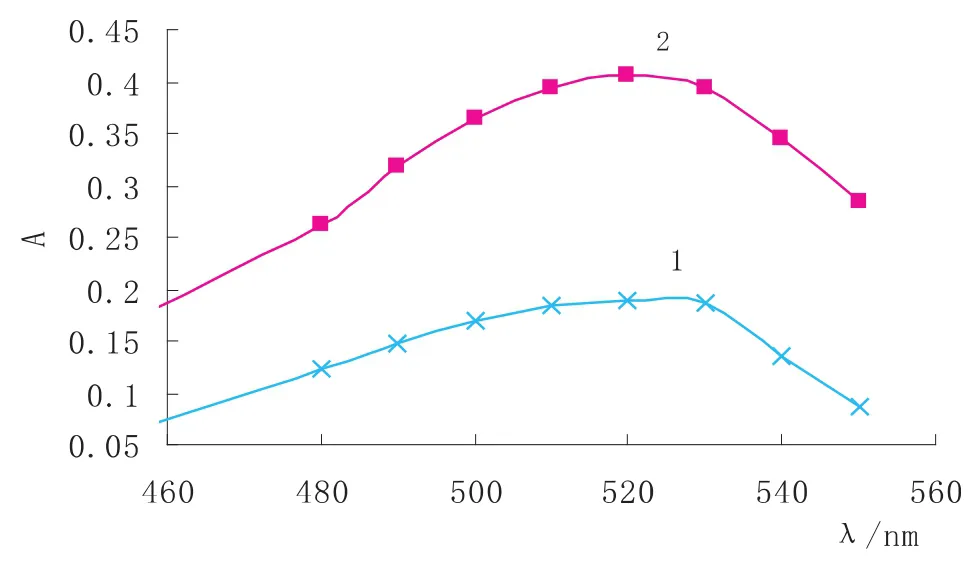
图1 吸收曲线
2.2反应条件的选择
2.2.1酸度的影响
实验结果表明,选用NH3-NH4Cl缓冲溶液pH=11.0时,ΔA值最大,故本实验选用pH=11.0的缓冲溶液.
2.2.2缓冲溶液用量的影响
实验结果表明,NH3-NH4Cl缓冲溶液的用量在0.50mL~2.00mL时,ΔA值先增大后减小,当缓冲溶液用量为1.00mL时,ΔA值达到最大,故本实验选用1.00mL pH=11.0的缓冲液.
2.2.3紫脲酸铵用量的影响
由实验知,随着紫脲酸铵用量的增大,ΔA值也呈现增大的趋势,当增大到2.50mL时,ΔA值达到最大,当再增加紫脲酸铵的用量时,ΔA值就会下降,故本实验选用紫脲酸铵溶液的体积为2.50mL.
2.2.4过氧化氢用量的影响
实验结果表明,当H2O2的用量在0.50mL时,其ΔA值最大,故本实验选用0.50mL3%的H2O2溶液.
2.2.5表面活性剂及其用量的影响
按照实验方法,分别加入三已醇胺、十二烷基硫酸钠、溴化十二烷基吡啶、氨三乙酸、邻菲啰啉等不同种类的表面活性剂.结果表明,当加入邻菲啰啉时,所测的ΔA值较大,进一步实验发现,当邻菲啰啉的用量为1.50mL时,所测ΔA达到最大值,故本实验选择1.50mL的邻菲啰啉做表面活性剂.
2.2.6反应温度及其时间的影响
按照实验方法考察反应温度和时间对ΔA值影响.由实验知,当反应温度由30℃逐渐升至70℃时,反应速率先加快后减慢,当温度控制在50℃时,速率最快,ΔA值也最大;改变反应时间后发现,体系反应1min就开始慢慢褪色,到达3min时,ΔA值达最大值,3min后,ΔA值开始下降,故本实验选在50℃水浴中、反应时间为3min的条件下进行,并用流水冷却法终止反应,最终体系可稳定15分钟左右.
2.2.7工作曲线
实验结果表明,当Cu2+的浓度在0.01~0.15μg/mL时与ΔA值符合朗伯-比耳定律,线性回归方程:ΔA=0.5762 CCu2++0.0442.式中Cu2+的单位是μg/10mL相关系数R=0.9984.对0.1μg/mL的Cu2+平行进行11次测定,所得相对标准偏差为1.3%,进行同等次数的空白试验,测得A0值的标准偏差Seb=0.00268,由空白试验标准偏差的3倍除以工作曲线斜率可得出检出限为 CL=3×Seb/K=1.4× 10-3μg/mL.
2.2.8实验中干扰离子的影响
按实验方法,对0.1μg/mL Cu2+进行测定,相对误差可控制在≤±5%内,下述共存离子不干扰测定(倍数):K+,Na+,F-,NO3-,Ba2+,S2O32-,I-(1000);Ag+(500);Ca2+,Mg2+(200);Ni2+(20);Bi+(15);Pb2+,Co2+,Al3+(10);Zn2+,Cr(Ⅵ)(5);Mn2+,Fe3+(<1),加入F-后可消除干扰.
3 样品分析
3.1样品的处理
3.1.1对海带样品的处理
准确称取9.9900g经预处理的市售海带于坩埚中,在电炉炭化后再放到500℃马弗炉中灼烧至灰化,冷却后用稀盐酸(GR)将其溶解,再用2mol/L的NaOH溶液滴定至中性,定容到250mL容量瓶中备用.
3.1.2水样的处理
按照实验方法先把采集的水样过滤,浓缩100倍后放入储备瓶中,待用.然后将样品缓慢注入已经制好的Cl-式阴离子交换树脂柱中,进行阴离子交换.弃去20mL的起始流出液,再接取一定量的水样作为被测样品,交换过程完成后,用二次蒸馏水将树脂上层的残留的试液以及交换出来的离子洗去.
3.2样品测定与分析
按实验方法,准确移取1.0mL的已预处理的样品,测其Cu2+含量,同时做加标回收实验,测定结果见表1.
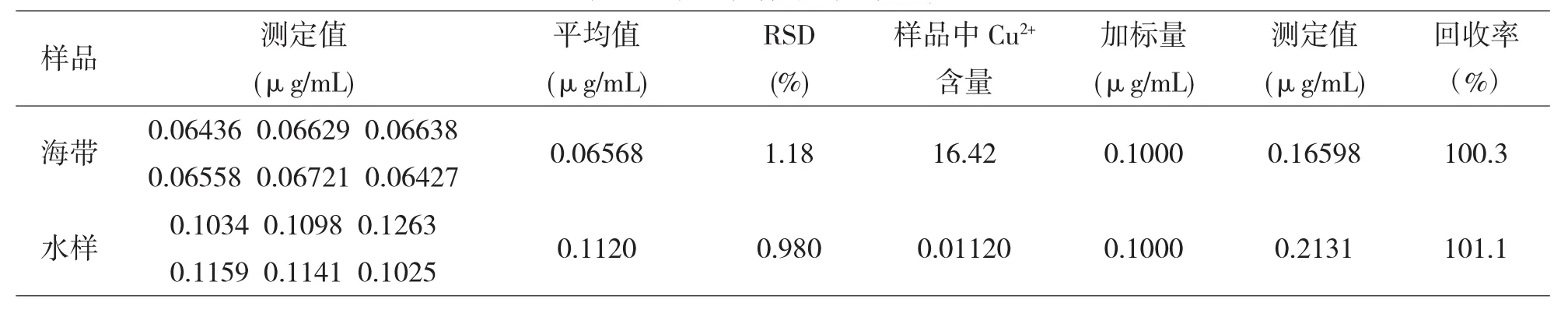
表1 样品中铜的测定结果(n=6)
4 结论
本实验研究发现在NH3-NH4Cl的缓冲溶液中,Cu2+对H2O2氧化紫脲酸铵有明显的催化作用,优化了反应条件,建立了催化动力学光度法测定试样中微量铜的新方法.将该法用于实际样品测定,测得海带、延河水试样的回收率分别为100.3%、101.1%,结果满意.
〔1〕吴茂江,徐长信.铜与人体健康[J].微量元素与健康的研究,2005,22(5):64-65.
〔2〕李万立,罗海吉.微量元素铜与人类疾病的关系的研究进展[J].微量元素与健康研究,2008,25(1):62-65.
〔3〕郭绿林.电位滴定法测定铜合金中铜[J].理化检验,2000,36(5):222-223.
〔4〕李山,刘根起.双波长分光光度法测定铜的研究[J].冶金分析,2004,4(6):17-18.
〔5〕薛光荣.火焰原子吸收光谱法连续测定陶瓷绝缘子镀液中的锌、铜、铁[J].化学分析计量,2005,14(4):34-37.
〔6〕李梦耀,张小燕,李绍卿.Cu2+-鲁米诺-过氧化氢-8-羟基喹啉化学发光体系的研究及应用[J].理化检验,2006,42 (4):278-280.
〔7〕王玉娥.示波极谱法测定水中的铜[J].现代预防医学,2003,30(5):745.
〔8〕陈华萍.催化动力学自动电位滴定法测定痕量铜[J].理化检验,1999(8):371-373.
〔9〕张华军.人发中微量铜的差分脉冲极谱法测定[J].黑龙江医药科学,2000,23(5):34.
O657.3
A
1673-260X(2016)04-0033-02
2015-12-23
