玉米(zea mays.L)ZmCen基因原核表达载体的构建及表达体系的优化
2016-10-10雷海英白凤麟王志军
雷海英,白凤麟,王志军
(1.长治学院生物科学与技术系,山西长治046011;2.长治学院化学系,山西长治046011)
玉米(zea mays.L)ZmCen基因原核表达载体的构建及表达体系的优化
雷海英1,白凤麟1,王志军2
(1.长治学院生物科学与技术系,山西长治046011;2.长治学院化学系,山西长治046011)
以玉米(zea mays L.)cDNA为模板,并将其构建到带有GST表达标签的原核表达载体pGEX-6p-1中,构建的重组载体pGEX-6p-Zmcen转化至大肠杆菌BL21(DE3)。为表达出较大量的可溶性GST-ZmCen融合蛋白,设置0.1 mmol/L,0.3 mmol/L和0.5 mmol/L IPTG3种不同浓度,诱导温度和4 h、16 h和20 h的诱导时间建立正交体系,诱导产物经超声波裂解破碎细胞后,通过12%SDS-PAGE比较分析融合蛋白表达量,从而确定最佳的表达体系。结果显示:当诱导温度28℃,IPTG浓度为0.3 mmol/L,诱导20 h时可以获得较大量的45kD可溶性融合蛋白(GST-ZmCen)表达量。
玉米;中心蛋白;原核表达;体系优化
1 引言
作为真核细胞胞质骨架的主要成分之一,微管组织中心(Microtubule-organizing centre,MTOC)不仅为微管提供了生长的起点,而且还决定了微管的方向性。其复制的改变会导致细胞分裂中止或癌症的产生[1,2,3]。微管组织具有多种功能,如纤毛和鞭毛的运动、细胞运动和胞质流动、染色体运动、细胞形态的维持、细胞内外的运输、细胞表面受体的固定等[4]。存在于细胞内的中心粒是主要的微管组织中心,但真正起微管组织作用的不是中心粒本身,而是中心粒周围的蛋白或与之相当的物质。高等植物由于没有特殊结构的MTOC,只能靠其他一些含微管相关蛋白的细胞器来行使类似的功能。中心蛋白是作为MTOC或中心粒周围的蛋白保守成分之一。已有研究表明,中心蛋白具有保守的EF-hand钙结合蛋白,分子量约20 kD的酸性蛋白,属于钙调蛋白超家族中的一员,也是负责MTOC细胞复制和分裂所必需的蛋白之一[5,6]。中心蛋白最早是从绿藻[7]中鉴定得到的,目前很多研究主要集中在哺乳动物、低等植物等,对高等植物的中心蛋白研究较少,迄今为止克隆到的中心蛋白基因主要有盐沼植物滨藻Atriptex thaliana的AtCen[8],拟南芥Arabidops thaliana的AtCen[9],烟草Nicotiana tabacum的两个同源基因NtCenl和NtCen2[10],水蕨Marsilea vestita 的MvCen[11]等,它们内部约有77%-78%的同源性。中心蛋白在细胞有丝分裂、纺锤体的分离、纤维的收缩等过程中起重要作用[12]。
文章克隆了玉米中心蛋白Zmcen基因,为能诱导表达出较大量的可溶性中心蛋白,对表达体系进行了优化,为后续的相关性质研究奠定了基础。
2 实验方法
2.1材料与试剂
试验所用玉米自交系材料郑58,种子由山西省农业科学院生物技术研究中心提供,在本实验室花盆种植一周后,取其新鲜叶片提取总RNA。本研究中Trizol总RNA抽提试剂盒、Taq DNA聚合酶、IPTG、DNA Marker、琼脂糖、RT-PCR试剂盒、限制性内切酶BamH I、Sal I、T4 DNA连接酶均购Takara公司产品;原核表达载体pGEX-6p-1由山西大学分子研究所杨斌盛教授实验室惠赠;凝胶回收试剂盒、小量制备质粒DNA试剂盒为Omega公司产品;大肠杆菌BL21(DE3)为本实验室保存;PCR引物合成、样品测序均由上海生工生物工程有限公司完成。
2.2实验方法
2.2.1总RNA提取
取玉米一周的幼苗0.1~0.2 g,液氮中研磨成粉末,提取总RNA,提取方法参照TaKaRa公司Trizol 总RNA抽提试剂盒说明书,1%的琼脂糖凝胶电泳检测总RNA的质量,微量紫外分光光度计(Nano2000,America)定量RNA样品。
2.2.2RT-PCR法
参照RT-PCR试剂盒说明书,去除基因组DNA后,将总RNA反转录成cDNA,反应体系为37℃15 min;85℃5 s;后置于4℃保存。
2.2.3重组载体的构建
以Zmcen基因的cDNA作为模板,使用Primer5.0软件设计PCR扩增引物:上游引物为mL:5′-GCC GGATCC ATGAGTTTCAACCAGT-3,下游引物为mR:5′-GCC GTCGACTCAAGCACTC ACAGA-3′。(画线部分分别为BamH I、Sal I限制性内切酶酶切位点,下游引物中TCA为终止密码子)。PCR反应体系为20 μL,PCR反应程序:94℃预变性5 min,94℃35 s,55℃40 s,72℃3 min,72℃7 min,30个循环。PCR产物用1%琼脂糖电泳检测扩增片段。
将回收纯化后的PCR产物和表达载体pGEX-6p-1分别用Bam H I、Sal I双酶切,纯化试剂盒回收PCR扩增产物,1%琼脂糖电泳回收线性载体。目的DNA片段与双酶切后的线性pGEX-6p-1载体连接,构建pGEX-6p-Zmcen重组载体,转化大肠杆菌BL21(DE3)感受态细胞,涂布于含有氨苄青霉素(50 μg/mL)的固体LB培养基上于37℃培养过夜,挑取单克隆进行菌落PCR扩增,同时保存备份菌液。经菌液PCR初步鉴定正确后,送由上海生工生物工程有限公司进一步测序鉴定。
2.2.4表达条件优化
取已构建转化好的原核表达菌株pGEX-6p-Zmcen-BL21单菌落接到10 mL含氨苄青霉素(50μg/mL)的LB培养基中,37℃震荡培养过夜。次日,将过夜培养菌液按1︰100的比例接入含50μg/mL氨苄的LB培养基中培养2-3h,当菌液浓度至OD600=0.6-0.8时,分别对IPTG浓度、诱导温度及诱导时间三种条件设置三因素三水平正交实验,IPTG终浓度分别设定为0.1mmol/L,0.3 mmol/L,0.5mmol/L,诱导温度设定为20℃,28℃,37℃,诱导时间分别为4 h,16 h,20 h时留取样品,同时留取空载体和不诱导样品作为对照组,离心收集菌体,沉淀菌体用PBS缓冲液(140 mmmol/L NaCl,2.7 mmmol/L KCl,10 mmmol/L Na2HPO4,1.8 mmmol/L KH2PO4,pH7.4)清洗1次,5000 rpm/min离心10 min,沉淀加500 μL PBS缓冲液,超声波破碎细胞,频率为20KHz,超声处理3-5 s,间隙3-5 s。持续10-15min后,离心,取上清4℃储存备用。蛋白样品中加入等体积的2×SDS上样缓冲液,混匀,100℃煮沸5min,12%SDS-PAGE电泳检测。通过分析蛋白表达量确定最佳表达体系。
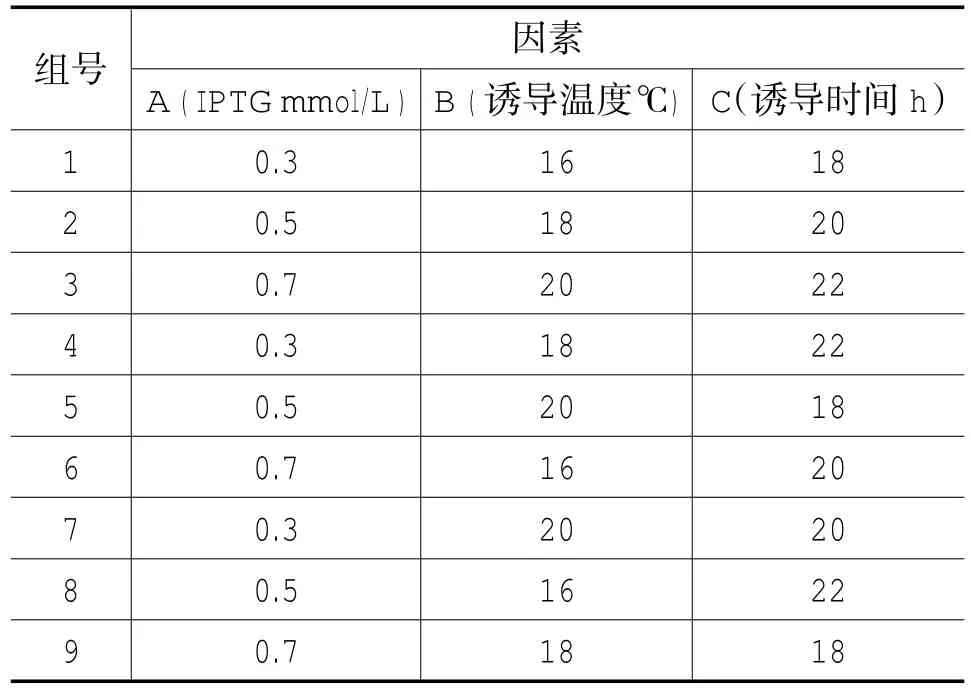
表1 BL21重组菌正交实验设计L9(33)Tab.1 BL21 Recombinant bacteria orthogonal experiment program L9(33)
3 结果与讨论
3.1玉米ZmCen cDNA序列扩增
经RT-PCR扩增后,扩增产物由1%琼脂糖凝胶电泳检测,结果如图1A所示,扩增片段特异性强,无杂带,带有酶切位点和保护碱基序列的ZmCen的目的条带大小为534 bp,其CDS序列与预期的序列大小相符,初步确定这些扩增片段为目的片段,回收目的片段用于重组载体的连接。
3.2ZmCen cDNA重组载体的构建
将构建的重组载体pGEX-6p-Zmcen转化大肠杆菌BL21(DE3),筛选克隆提取质粒双酶切鉴定,菌落PCR扩增产物,经1%琼脂糖凝胶电泳检测,有目的条带的阳性克隆送至上海生工测序鉴定(图1A/1B),阳性克隆测序结果如图2所示,测序结果包含有完整的ORF,且没有突变和移码,与NCBI报道的玉米基因Zea mays caltractin(LOC100284444)mRNA的cDNA序列一致,其CDS长为516bp,编码172个氨基酸证明已成功克隆出了Zmcen cDNA。经测序公司鉴定后命名为pGEX-6p-Zmcen-BL21,用于后续蛋白表达。

图1 玉米ZmCen扩增(A)与重组载体鉴定(B)的电泳结果图A:DL1000 DNA Marker与PCR扩增产物;B:M1与M2分别为DL1000、λHind III DNA Marker,1与2分别为重组载体pGEX-6p-ZmCen的质粒与酶切产物Fig.1 PCR amplification of ZmCen gene(A)and the recombinant plasmid digested by restriction endonuclease of pGEX-6p-AtCen2(B),A:M,DL1000 DNA Marker;1,The product of PCR amplification.B:M1 and M2 were DL1000 and λHind III DNA Markers.1,The recombinant plasmid;2,The product of the recombinant plasmid pGEX-6p-ZmCen digested.

图2 ZmCen cDNA克隆测序结果及氨基酸序列Fig2ThecDNAandanomyacidsequencesofZmCengene
3.3中心蛋白的原核诱导表达
由于在预实验中重组pGEX-6p-Zmcen-BL21菌株在通常的表达体系中难以表达出较大量的可溶性蛋白,经过体系的调整也只能有少量的可溶性蛋白出现,而大量的蛋白只以包涵体的形式出现,不利用后续蛋白分离纯化的利用。因此,为使重组菌株pGEX-6p-Zmcen-BL21的目的基因Zmcen能大量在上清中表达出可溶性的蛋白,通过设置正交实验,对3种不同温度、3种IPTG浓度及3个不同的诱导时间,进行融合蛋白GST-ZmCen诱导表达。不同诱导体系的超声破碎产物经12% SDS-PAGE电泳分析,从而确定能够表达出较大量可溶性蛋白的最佳体系,其代表性的电泳结果如图3所示。
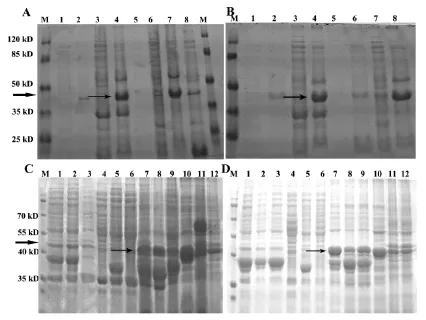
图3 玉米ZmCen不同诱导条件下的12%SDS-PAGE电泳结果M:蛋白质Marker;A和B:1、2分别表示对照组pGEX-6p-1的未诱导与诱导的产物;3、5、7泳道为超声裂解细胞上清液,4、6、8泳道为超声裂解细胞上清液,箭头所指为诱导的重组菌pGEX-6p-ZmCen目的蛋白表达产物,其中仅在图A的7泳道中的上清中表达出45 kD可溶性的融合目的蛋白;C为0.3mmol/L IPTG诱导的不同体系上清中蛋白表达;D为诱导20 h的不同体系上清中蛋白表达Fig.3 The result of ZmCen protein expression on12%SDS-PAGEM was marker of protein standard molecular weight;A and B:1 and 2 were the expression of negative control,3,5 and 7 lanes were the expression of ZmCen protein in supernatant with IPTG induction.4,6 and 8 lanes were the expression of ZmCen protein in deposition with IPTG induction.The induced solvable GST fusion protein of 45 kD was only expression in lane 7 of Fig A;C: the expression protein under 0.3mmol/L IPTG induction condition;D:the expression protein under induction 20 h condition。
从图3中可以看出,图3A中的部分体系在泳道4的沉淀中出现了大量的目的蛋白,第7泳道中有较大量的目的蛋白表达,同时沉淀中的蛋白较少(第8泳道)。图3B不同体系的结果显示,在第4、第8泳道中表达出了目的蛋白,但也都是沉淀中的表达,基本都是以包涵体的形式存在,上清中仅有少量的或微量的可溶性蛋白表达,结果也不利用蛋白的进一步纯化。图3C为0.3mmol/L IPTG的诱导条件的电泳结果,从图可以看出,IPTG浓度相同条件下,诱导温度和诱导时间的不同,诱导的目的蛋白的表达量也不同,其中第7、8、10泳道的表达量较大。图3D为诱导时间在20 h条件下的蛋白表达结果,其中第7、9、10泳道的表达量较大。综合正交表达条件下的所有诱导结果分析,当IPTG浓度为0.3mmol/L,28℃时诱导20h时,确定为GST-ZmCen融合蛋白表达的最佳体系,其表达的目的蛋白位于沉淀中的目的蛋白极少,大部分是存在于上清中的可溶性蛋白,而其他条件下有的未表达出可溶性的目的蛋白,即要么以包涵体的形式,要么表达量不够。因此将此条件确定为诱导表达ZmCen的最适诱导条件。大量可溶性蛋白的成功诱导将为进一步用于的蛋白纯化及性质研究。
4 结论
构建的重组菌株pGEX-6p Zmcen-BL21,当诱导条件为0.3 mmol/L IPTG,温度为28℃,诱导20 h时,位于上清中的GST-ZmCen可溶性融合蛋白大量被诱导表达,被确定为最佳的诱导条件。这将为后续蛋白的分离纯化及性质研究提供一定的借鉴。
[1]Well W A E.The spindle-assembly checkpoint: aiming for a perfect mitosis[J].Trends Cell Biol,1996,6:228-234.
[2]王琦,杨坤,李艳红.高等植物微管组织中心及其相关蛋白[J].植物生理学通讯,2005,41(3):400-404.
[3]Salisbury J L,Whitehead C M,Lingle W L,et a1.Centrosomes and cancer[J].Biol Cell,1999, 91:451-460.
[4]王志军.八肋游仆虫中心蛋白性质和功能的研究[D],山西大学博士学位论文,2007.
[5]Tucker J B.Spatial organization of microtubuleorganizing centers and microtubule[J].J Cell Bid,1984,99:55-62.
[6]Taillon P,Adler S,Suhan J,Jarvik J.Mutational analysis of centrin:an EF-hand protein associated with three distinct contractile fibers in the basal body apparatus of Chlamydomonas[J].J Cell Biol, 1992,119:1613-1624.
[7]Salisbury,J.L.,A.T.Baron,M.A.Sanders:The centrin-basedcytoskeletonofChlamydomonas reinhardtii:distribution in interphase and mitotic cells[J].J Cell BioI.1988,107,635-641.
[8]Zhu J K Breussan R A and Hasegawa P M.An Atriplex nummunularia cDNA sequence relatedness to thealgal caltractingene[J].PlantPhysiol, 1992,99:1734-1735.
[9]CordeiroM,PiquerasR,OliveriraDand Castresana C.Characterization of early induced genesinArabidopsisthalianarespondingto bacterial inoculation:identification of centrin and of a novel protein with two regions related to kinase domains[J].FEBS Lett,1998,434:387-393.
[10]Stoppin-Mellet V Canaday J and Lambert A M. Characterization of microsome associated tobacco BY-2 centrins[J].Eur J Cell Biol,1999,78(11): 842-848.
[11]Hart P E,Wolniak S M.Molecular cloning of a centrinhomologfromMarsileavestitaand evidenceforitstranslationalcontrolduring spermiogenesis[J].Biochem Cell Biol.1999,77(2): 101-108.
[12]Hu H,Sheehan J H and Chazin W J.The mode of action of centrin:binding of Ca2+and a peptide fragment of Kar1p to the C-terminal domain[J].J Biol Chem,2004,279(49):0895-50903.
(责任编辑铁军)
Lei Hai-ying1,Bai Feng-ling1,Wang Zhi-jun2
(1.Department of Biology Science&Technology,Changzhi University,Changzhi,Shanxi 046011; 2.Department of Chemistry,Changzhi University,Changzhi Shanxi 046011)
Q753
A
1673-2014(2016)02-0005-05
国家自然科学基金项目(21201024);山西省自然科学基金项目(2012021009-1);山西省科技攻关项目(20140311005-3)。
2016—01—13
雷海英(1978-),女,山西平遥人,讲师,硕士,主要从事分子生物学教学与研究。
