多西他赛治疗紫杉醇耐药乳腺癌的疗效
2016-10-09李云霞
李云霞
[摘 要] 目的:分析多西他赛对于紫杉醇耐药的乳腺癌临床效果及安全性,探讨其临床应用价值。方法:以我院2013年12月—2014年12月收治的87例接受多西他赛治疗的紫杉醇耐药乳腺癌患者为研究对象,分析其疗效及毒副作用,探讨多西他赛治疗效果的影响因素及安全性。结果:87例紫杉醇耐药乳腺癌患者中,35例为原发耐药,占40.23%,52例为继发耐药,占59.77%。多西他赛治疗客观缓解率为67.82%,临床获益率为86.21%,不同耐药情况患者临床疗效比较,差异无统计学意义(P>0.05)。血液学毒副反应以Ⅲ度白细胞计数降低、Ⅳ度中性粒细胞减少为主,分别占55.17%、65.52%。患者平均PFS为(4.52±1.08)个月,原发耐药组患者平均PFS为(2.82±0.47)个月,显著低于继发耐药组的(5.71±1.33)个月,差异有统计学意义(P<0.05)。结论:多西他赛治疗紫杉醇耐药乳腺癌能够得到一定的客观缓解率与临床获益率,亚组分析显示原发耐药者对多西他赛反应性差。
[关键词] 多西他赛;紫杉醇;耐药;乳腺癌;影响因素
中图分类号:R737.9 文献标识码:B 文章编号:2095-5200(2016)04-031-03
DOI:10.11876/mimt201604012
近年来乳腺癌发病率以每年3%的速度增长,对女性生命健康造成了严重威胁[1]。20世纪90年代起,紫杉醇的应用为乳腺癌术后辅助化疗开辟了新的前景,含紫杉醇的化疗方案在改善患者无病生存率、总生存率方面较蒽环类药物的显著优势已得到广泛认可[2]。但临床亦有部分患者对于紫杉醇耐药,有学者将多西紫杉醇(多西他赛)用于紫杉醇耐药乳腺癌的解救治疗,取得了一定成效[3]。为了解上述结论可行性,本研究选取87例患者分析该方案的安全性以及临床疗效。
1 资料与方法
1.1 临床资料
以我院2013年12月—2014年12月收治的87例接受多西他赛治疗的紫杉醇耐药乳腺癌患者为研究对象,所有患者均经病理检查确诊乳腺癌,既往接受紫杉醇辅助化疗。排除病历资料不完整或疗效、疾病进展时间(TTP)、治疗失败时间(TTF)无法评价者。患者Her-2阳性25例、阴性59例、3例未查;单用紫杉醇26例、紫杉醇联合其他药物61例。
1.2 治疗方案
紫杉醇治疗方案参照美国国立综合癌症网络(NCCN)指南中标准剂量[4]:三周疗:紫杉醇175 mg/m2静脉滴注,d 1,21 d为1周期;周疗:紫杉醇
80 mg/m2静脉滴注,每周1次。多西他赛治疗方案为:60~100 mg/m2静脉滴注,d 1,21 d为1周期,有效者持续用药至疾病进展或不良反应无法耐受。
1.3 分析方法
1.3.1 耐药分析 按照患者耐药情况分为原发耐药组、继发耐药组[5]:原发耐药:紫杉醇治疗无效,或既往接受紫杉醇辅助化疗,但无病生存期(DFS)不足12个月;继发耐药:紫杉醇治疗达完全缓解(CR)或部分缓解(PR),但治疗期间出现疾病进展(PD),或既往接受紫杉醇辅助化疗,DFS超过12个月但出现乳腺癌复发。
1.3.2 疗效及毒副作用评价 疗效评价参照实体瘤疗效评价新标准(RECIST v1.1),对患者多西他赛治疗结束后临床疗效进行评价,包括CR、PR、稳定(SD)及PD,客观缓解率为CR+PR,临床获益为CR+PR+SD,且持续24周以上[6]。记录不同耐药情况患者无进展生存期(PFS)。
毒副作用评价参照世界卫生组织(WHO)化疗药物毒性反应分度标准,观察患者治疗期间血液学毒副反应发生情况,评价多西他赛的血液学毒性[7]。
1.4 统计学分析
数据采用SPSS18.0软件分析,评价数据以(n/%)表示,χ2检验,以P<0.05为有统计学意义。
2 结果
2.1 耐药情况
87例紫杉醇耐药乳腺癌患者中,35例为原发耐药,占40.23%,52例为继发耐药,占59.77%。
2.2 疗效评价
患者客观缓解率为67.82%,临床获益率为86.21%,原发耐药组和继发耐药组缓解率分别为65.71%VS69.23%、临床获益率为85.71%VS86.54%,不同耐药情况患者组间差异无统计学意义(P>0.05)。
2.3 血液学毒副反应评价
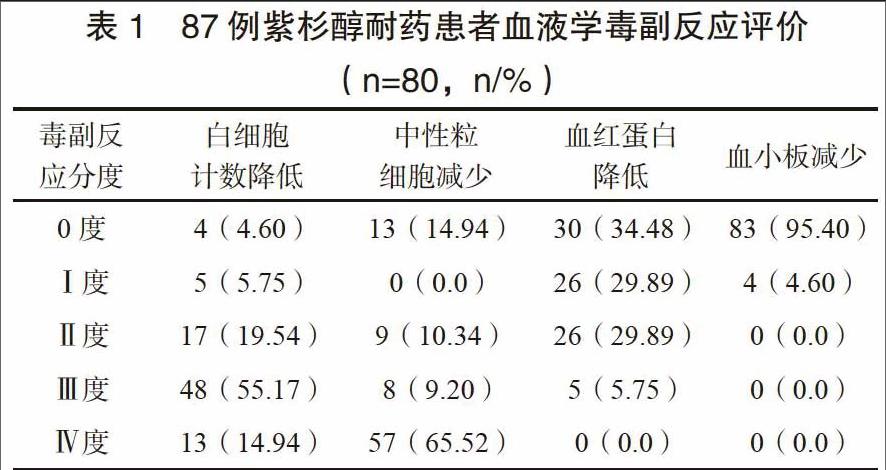
患者血液学毒副反应以Ⅲ度白细胞计数降低、Ⅳ度中性粒细胞减少为主,分别占55.17%、65.52%。见表1。
2.4 生存情况
87例患者平均PFS为(4.52±1.08)个月,原发耐药组患者平均PFS为(2.82±0.47)个月,显著低于继发耐药组的(5.71±1.33)个月,差异有统计学意义(P<0.05)。
3 讨论
保证患者生存质量、尽量延长其生存期是乳腺癌的首要治疗原则,紫杉醇、多西紫杉醇均被纳入乳腺癌治疗的推荐化疗用药[8]。紫杉醇自红豆杉科植物红豆杉的干燥根、枝叶以及树皮提取而来,具有抑制微血管解聚作用,与蒽环类药物同为卵巢癌、乳腺癌、非小细胞肺癌化疗的一线药物,其良好的抗肿瘤作用已得到广泛共识,但近年来临床紫杉醇耐药乳腺癌的报道逐渐增多[9]。
多西他赛为半合成型多西紫杉醇类抗肿瘤药物,其与紫杉醇均可通过促进和稳定微管装配、抑制解聚,使细胞周期阻滞于G2/M阶段,抑制肿瘤细胞的增殖过程。大量研究证实,较紫杉醇而言,多西他赛微管聚合方式更为独特,故与微管结合位点结合紧密性更高,能够更为持久的停留于靶细胞内,其较高的浓聚程度可保证胸腺嘧啶磷酸化的明显上调,从而显著增强体内外抗肿瘤活性,并通过诱导Bcl-2蛋白磷酸化,加快乳腺癌细胞的凋亡速度,促进患者预后质量的改善[10-12]。过往吴新刚等[13]将多西他赛用于44例紫杉醇耐药患者的解救治疗,Raza等[14]对60例紫杉醇耐药乳腺癌患者应用多西他赛治疗,均取得了满意的效果。本研究结果示,87例患者客观缓解率为67.82%,临床获益率为86.21%,证明了多西他赛对于紫杉醇耐药乳腺癌患者的确切治疗效果。
过往研究多关注多西他赛解救紫杉醇耐药乳腺癌的有效性,未能明确该治疗方案的影响因素[15]。本研究按照患者耐药情况进行分组,发现原发耐药、继发耐药患者近期疗效比较,差异无统计学意义,但原发耐药者PFS显著低于继发耐药者,考虑与原发耐药者既往对紫杉醇敏感性即较低有关,故即便多西他赛较强的抗肿瘤活性能够在一定程度上保证较高的客观缓解率,但长期治疗仍无法维持满意的多西他赛反应性,患者预后质量不够理想[16]。
作为一种直接杀灭肿瘤细胞的治疗手段,化疗药物亦不可避免地会对机体正常细胞造成损伤,导致患者免疫功能下降并出现血液学反应。本研究结果示,患者治疗期间均出现了不同程度的血液学毒副作用,且以Ⅲ度白细胞计数降低、Ⅳ度中性粒细胞减少为主,说明多西他赛对患者免疫功能的抑制效果较为强烈,与多数文献报道相仿[17]。因此,如何取得多西他赛用药剂量与不良反应的平衡,在保证治疗安全性的前提下最大限度延长患者生存时间,是今后临床研究的重点。
综上所述,多西他赛治疗紫杉醇耐药乳腺癌具有确切的近期临床效果,但其对患者免疫功能的影响较为明显,在临床实践中,如能根据患者实际状态选择合适的治疗剂量,则有望在降低毒副作用增加的前提下延长患者PFS,保证治疗效果与安全性。
参 考 文 献
[1] Wang Y J, Chen L J, Tan L W, et al. PEG–PCL based micelle hydrogels as oral docetaxel delivery systems for breast cancer therapy[J]. Biomaterials, 2014, 35(25): 6972-85.
[2] Perrone F, Nuzzo F, Di R F, et al. Weekly docetaxel versus CMF as adjuvant chemotherapy for older women with early breast cancer: final results of the randomized phase Ⅲ ELDA trial.[J]. Ann Oncol, 2014, 26(4): 675-82.
[3] 宋晓丹. 乌司他丁联合多西他赛对乳腺癌免疫微环境的影响[D]. 重庆:重庆医科大学, 2014.
[4] Yang L, Zheng L Y, Tian Y, et al. C6 ceramide dramatically enhances docetaxel-induced growth inhibition and apoptosis in cultured breast cancer cells: A mechanism study[J]. Exp Cell Res, 2015, 332(1):47-59.
[5] Coleman R E, Howell A, Eggleton S P H, et al. A Phase II study of docetaxel in patients with liver metastases from breast cancer[J]. Ann Oncol, 2014, 127(2): 541-546.
[6] 彭兴梅, 李爱国, 杨爱红,等. 多西他赛联合希罗达和多西他赛联合顺铂治疗蒽环类耐药乳腺癌的临床疗效[J]. 江苏医药, 2014, 40(13): 1539-1541.
[7] Jacobs C, Hutton B, Mazzarello S, et al. Optimisation of steroid prophylaxis schedules in breast cancer patients receiving docetaxel chemotherapy—a survey of health care providers and patients[J]. Support Care Cancer, 2015, 23(11): 1-7.
[8] 王芳,韩锐.紫杉醇耐药机理研究进展[J].癌症, 2002, 21(4):439-442.
[9] Webber-Foster R, Kvizhinadze G, Rivalland G, et al. Cost-Effectiveness Analysis of Docetaxel Versus Weekly Paclitaxel in Adjuvant Treatment of Regional Breast Cancer in New Zealand[J]. Pharmacoeconomics, 2014, 32(7): 707-724.
[10] 木扎帕尔·阿不都克热木, 玉素甫·买买提, 马斌林. 联合应用表柔比星与多西他赛辅助化疗三阴乳腺癌的疗效分析[J]. 国际肿瘤学杂志, 2014, 41(7): 556-557.
[11] Palma G, Conte C, Barbieri A, et al. Antitumor activity of PEGylated biodegradable nanoparticles for sustained release of docetaxel in triple-negative breast cancer[J]. Int J Pharm, 2014, 473(1-2): 55-63.
[12] Tavassolian F, Kamalinia G, Rouhani H, et al. Targeted poly ( l -γ-glutamyl glutamine) nanoparticles of docetaxel against folate over-expressed breast cancer cells[J]. Int J Pharm, 2014, 467(1-2):123-138.
[13] 吴新刚, 黄谦, 向安萍. 乳腺癌多西他赛耐药的分子机制[J]. 肿瘤防治研究, 2014, 41(4): 413-415.
[14] Raza K, Thotakura N, Kumar P, et al. C60-fullerenes for delivery of docetaxel to breast cancer cells: A promising approach for enhanced efficacy and better pharmacokinetic profile.[J]. Int J Pharm, 2015, 495(1): 551-559.
[15] 赵广章, 刘海英, 刘启龙,等. TAC与AT方案新辅助化疗治疗局部晚期乳腺癌疗效分析[J]. 现代肿瘤医学, 2014, 22(7): 1587-1589.
[16] Kim H J, Im S A, Keam B, et al. ABCB1, polymorphism as prognostic factor in breast cancer patients treated with docetaxel and doxorubicin neoadjuvant chemotherapy[J]. Cancer Sci, 2015, 106(1): 86-93.
[17] 刘小红, 杨灵, 付洁,等. 多西他赛联合顺铂治疗转移性乳腺癌疗效分析[C]// 全国肿瘤学进展学术会议. 2007:96-97.
