贻贝蛋白Mgfp-5的原核表达与纯化
2016-09-29吕玉伟吕亚维杨泽熵王睿劼张雨靖王英娟
吕玉伟,吕亚维,杨泽熵,王睿劼,张雨靖,王英娟
(西北大学 生命科学学院/西部资源生物与现代生物技术教育部重点实验室/生物技术省级重点实验室, 陕西 西安 710069)
·生命科学·
贻贝蛋白Mgfp-5的原核表达与纯化
吕玉伟,吕亚维,杨泽熵,王睿劼,张雨靖,王英娟
(西北大学 生命科学学院/西部资源生物与现代生物技术教育部重点实验室/生物技术省级重点实验室, 陕西 西安710069)
贻贝(Mytilus galloprovincialis) 足丝中黏附蛋白,是一种黏合强度高、生物相容性好、优质的生物黏合剂,可以应用于医学、表面化学、海洋工程等领域,其中富含DOPA(多巴,3,4-二羟基苯丙氨酸)的贻贝足丝蛋白5(Mytilus galloprovincialis foot protein type 5, Mgfp-5)显著表现出此特性。天然获取Mgfp-5含量低,易固化,纯化困难,越来越多学者尝试基因工程获得黏蛋白。文中构建重组质粒pET28a-mgfp,在大肠杆菌(Escherichia coli)BL21(DE3)中诱导表达出重组蛋白Mgfp-5。为得到高质量的Mgfp-5蛋白,优化了Mgfp-5蛋白诱导表达参数:菌液OD600=0.8,诱导剂异丙基-β-D巯基半乳糖苷(IPTG)0.8 mmol/L,37℃,诱导8h;优化镍离子亲和层析纯化蛋白Mgfp-5最佳条件为:Elution Buffer的pH为7.0,500 mmol/L咪唑。Western Blot鉴定到重组Mgfp-5可以特异性表达。该研究为得到大量Mgfp-5蛋白奠定了基础,为加速黏蛋白的黏附机理及生物医学黏合剂的开发提供参考。
贻贝;mgfp-5基因;原核表达;优化;纯化
双壳类软体动物贻贝(Mytilusgalloprovincialis)足腺分泌的黏性蛋白质,亦称贻贝黏蛋白、多酚蛋白质或贻贝足丝蛋白(Mytilusgalloprovincialisfoot protein,Mgfp)[1-3],富含酪氨酸经羟基化修饰后的DOPA(多巴,3,4-二羟基苯丙氨酸)残基[4-6]。DOPA残基强的金属螯合能力和强氢键的能力,利于Mgfp在任何环境尤其在潮湿性环境中,牢固黏附于不同材料表面[7-8]。Mgfp生物相容性好、无免疫原性,具有生物降解性[9-10],是一种优质的生物黏合剂,应用于生物医学[11-13]、表面化学及海洋工程领域[14-16]。Mgfp是由多种黏蛋白组成的复合体,目前已鉴定主要有Mgfp-1~Mgfp-6 6种类型黏附蛋白以及3种胶原蛋白质前体(precollagen,preCoI)preCoI-D, preCoI-P,preCoI-NG。其中,Mgfp-5每4个氨基酸中就会有超过1个的DOPA,总含量高达25%~30%[17],具有强黏合力,是发挥黏附功能的主要蛋白分子,分布于贻贝足基底面及与外界接触界面。
天然状态下,从贻贝足部提取获得的液态蛋白量极少,容易固化,而且提取成本很高。近年来有用大肠杆菌及酵母基因工程手段表达贻贝黏合蛋白的研究[18-20],但是效率极低,基因工程表达和纯化仍然是制约贻贝黏合蛋白基因工程获取的瓶颈。本研究通过构建含有mgfp-5基因的原核表达载体,在E.coliBL21(DE3)中诱导Mgfp-5蛋白表达,优化Mgfp-5的诱导表达、纯化条件,以期提高Mgfp-5蛋白的表达量,奠定大量获得Mgfp-5蛋白的基础,为加速黏蛋白的黏附机理及生物医学黏合剂的开发提供参考。
1 材料和方法
1.1菌株与载体
大肠杆菌(Escherichiacoli,E.coli)BL21(DE3)及质粒pET-28a由西北大学付爱根教授馈赠。
1.2主要试剂与仪器
质粒DNA提取试剂盒、琼脂糖凝胶回收试剂盒购自天根生化生物公司;DNA Marker、限制性内切酶、连接酶等购自Takara公司;Protein Marker、ECL发光液购自Thermo;Ni-NTA Agarose购自Qiagen公司;一抗购自Vazyme公司、二抗购自北京中杉金桥生物有限公司;引物合成、测序于上海生工生物有限公司,其余化学试剂为国产分析纯。
1.3mgfp-5基因原核表达载体的构建
根据贻贝Mgfp-5的cDNA mgfp-5(GenBank:AY521220.1)基因序列构建含有目的基因mgfp-5的pUC57的克隆载体(本实验室构建并保存),以mgfp-5基因和pET-28a载体设计引物,PCR扩增。正向引物(NdeI酶切位点和保护碱基):mgfp-5-F(5′-GGAATTCCATATGAGTTCTGAAGAAT);反向引物(EcoRI酶切位点保护碱基):mgfp-5-R(5′-CGGAATTCCTAACTGCTACCACCT)。PCR扩增程序:94℃预变性5min;94℃变性30s;55℃退火30s;72℃延伸45s,循环34次,72℃延伸10min;凝胶电泳鉴定。
试剂盒回收的PCR产物和载体pET-28a,经NdeI和EcoRI双酶切,回收,T4DNA连接酶4℃连接16 h,转化E.coliBL21,50 mg/L卡那霉素(Kan.)的LB固体筛选培养。挑取单克隆进行菌落PCR和双酶切验证,阳性克隆测序,测序正确的质粒命名为pET28a-mgfp。
1.4重组Mgfp-5蛋白的表达
1.4.1重组Mgfp-5的IPTG诱导pET28a-mgfp单克隆在含50 mg/L的LB液体培养基中,37℃,180 r/min过夜培养。同时设不含pET28a-mgfp的BL21为阴性对照。按体积比1∶100的比例扩大培养,37℃,180 r/min培养至菌液OD600为0.6~0.8,取1.0 mL为对照,其余菌液中加IPTG至终浓度1.0 mmol/L,继续培养4 h,取1.0 mL为诱导后样品。12 000 r/min,2 min,PBS冲洗菌体沉淀2次,加上样缓冲液,98℃,10 min,冰上冷却,12 000 r/min,10 min,15% SDS-PAGE电泳分析Mgfp-5蛋白的表达。
1.4.2重组Mgfp-5的Western Blot用Western Blot鉴定E.coliBL21/pET28a-mgfp未诱导和诱导后的总蛋白:SDS-PAGE凝胶电泳电转(湿转)到0.22 μm的PVDF膜上,转化完全的膜,用TBST(20 mmol/L Tris-HCl,pH 7.5,150 mmol/L NaCl,体积分数0.05% Tween 20)冲洗干净;0.05g/mLTBST-脱脂奶粉封闭1.5~2h,TBST洗涤4次,每次8 min;加入抗His一抗(体积比1∶2 000,鼠单抗),4℃过夜孵育,TBST洗涤4次,每次8 min;加入二抗(体积比1∶5 000),常温孵育3~4 h,TBST洗涤4次,每次8 min;ECL化学发光显影。
1.5重组Mgfp-5表达形式的确定
设E.coliBL21(DE3)空载体菌落作为阴性对照,培养阳性单克隆BL21/pET28a-mgfp至OD600为0.6~0.8时,加入IPTG至终浓度1.0 mmol/L,4 h。收集1.0 mL菌液细胞,裂解液重悬沉淀,冰上超声,4℃,12 000 r/min,15 min,取上清;沉淀用相同量裂解液重悬,SDS-PAGE分析Mgfp-5蛋白的表达形式。
1.6重组Mgfp-5表达条件优化
诱导前菌体生物量:培养过程中,培养至不同OD600(0.4,0.6,0.8和1.0)菌液,同时加入IPTG诱导剂至终浓度为1.0 mmol/L,37℃,200 r/min,4 h诱导培养;诱导温度:菌液OD600=0.8,IPTG终浓度1.0 mmol/L,不同温度(25,30,37℃),200 r/min,4 h诱导培养;诱导时间:菌液OD600=0.8,IPTG终浓度1.0 mmol/L,37℃,200r/min,不同时间(0,2,4,6,8,10,12,16h)诱导培养;IPTG浓度:菌液OD600=0.8,不同IPTG终浓度(0,0.4,0.6,0.8,1.0,1.2 mmol/L),37℃,200 r/min,4 h诱导培养。取诱导及未诱导菌液1.0 mL,冰上超声裂解,离心后取上清,分析上述因素对蛋白Mgfp-5表达的影响。
1.7Mgfp-5的纯化及条件的优化
用优化后的最佳表达条件进行诱导、 培养、 收集菌体, PBS洗涤2次, 菌体用Binding Buffer(50 mmol/L NaH2PO4, 300 mmol/L NaCl,10 mmol/L咪唑, pH 8.0)重悬沉淀, 超声破碎菌体细胞, 12 000 r/min离心20 min,0.45 μm过滤上清,滤液与Binding Buffer预处理的Ni2+柱结合;Wash Buffer (50 mmol/L,NaH2PO4,300 mmol/L NaCl,100 mmol/L咪唑,pH 8.0)冲洗3次;收集Elution Buffer洗脱液。以Elution Buffer洗脱液进行SDS-PAGE电泳分析,依次优化Elution Buffer中的咪唑浓度(250,375,500,625 mmol/L;pH 8.0)及适合咪唑浓度条件下的最适pH(8.0,7.5,7.0,6.5)。
1.8Mgfp-5的Western Blot鉴定
方法同1.4.2,Western Blot分析重组菌株的未诱导及诱导后总蛋白、纯化后的蛋白。
1.9蛋白量的检测方法
灰度扫描SDS-PAGE凝胶并运用软件分析目的蛋白含量,以15kD左右特异性条带为目标,计算Mgfp-5蛋白在可溶性蛋白中的含量。利用Bradford法检测Mgfp-5蛋白浓度。
2 结果与分析
2.1原核表达载体pET28a-mgfp的构建
以克隆载体pUC57-mgfp为模板,用1.3中的引物进行PCR扩增mgfp-5目的基因,扩增的产物在预期的250bp附近出现条带(图1)。菌落PCR显示(图2)阳性转化子中有约250bp的目的条带,而阴性对照菌落未见此条带;在双酶切鉴定结果(图3)中,均出现了2条带,其中可见大小约250bp的目的条带,与mgfp-5基因预期大小一致;阳性菌测序结果与GenBank中的mgfp-5基因序列比对100%相同,且插入位点正确(图4),表明mgfp-5基因已经成功嵌入表达载体pET-28a。

M DL15000 DNA Marker; 1-5 PCR扩增的mgfp-5基因片段; 6 空白对照图1 贻贝mgfp-5 PCR扩增产物凝胶电泳图Fig.1 Agarose gel electrophoresis of the mgfp-5 PCR products

M DL2000 DNA Marker; 1-6 单克隆菌体; 7 阴性对照图2 重组表达质粒的菌落PCR电泳图Fig.2 Colony PCR identification of recombiannt expression vector
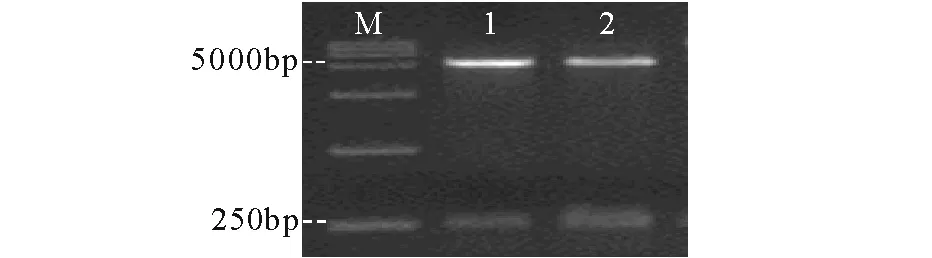
M DL15000 DNA Marker; 1-2 重组质粒双酶产物图3 重组质粒pET28a-mgfp的双酶切鉴定Fig.3 Restriction enzyme digestion of the pET28a-mgfp prokaryotic expression plasmid by Nde I and EcoR I

图4 DNA序列比对结果Fig.4 Result of DNA sequence alignment
2.2重组Mgfp-5蛋白的表达
2.2.1重组Mgfp-5的IPTG诱导pET28a-mgfp重组质粒转化后经过IPTG诱导(图5), 重组Mgfp-5的SDS-PAGE分析符合预期,目的条带出现在15kD附近,而阴性对照没有,说明Mgfp-5蛋白可以原核表达。重组Mgfp-5分子量约11.4kD,但是电泳条带显示目标蛋白分子量大于11.4kD,分析可能是由于Mgfp-5蛋白的等电点(9.3左右)所致,高等电点的蛋白更易于结合SDS,从而增加了重组Mgfp-5蛋白的SDS-PAGE分子量[21]。

M Marker; 1-2 重组诱导,未诱导; 3-4 空载诱导,未诱导图5 融合蛋白的表达分析Fig.5 Expression analysis of Mgfp-5 fusion protein
2.2.2重组Mgfp-5的Western Blot利用pET28a-mgfp载体的mgfp-5基因序列的上游含有的组氨酸标签(His-tag),进行重组Mgfp-5的Western Blot(图6),可见诱导后的蛋白阳性反应带,而未诱导蛋白无任何特异性的反应条带,证明Mgfp-5蛋白在E.coliBL21中已成功的表达。

1-2 未诱导; 3-4 诱导图6 Mgfp-5融合蛋白的Western Blot分析Fig.6 Western Blot analysis of Mgfp-5 fusion protein
2.3Mgfp-5蛋白存在形式的确定
IPTG诱导后分析上清和沉淀(图7),阳性重组BL21/pET28a-mgfp菌的上清液在约15kD处出现明显的高水平表达的外源蛋白条带,而在沉淀里没有,说明Mgfp-5蛋白主要以可溶性的形式存在,这与Hwang等在对重组Mgfp-5以可溶形式存在的研究相似[21]。

M Marker; 1-2空载上清,沉淀; 3-4 重组菌上清,沉淀图7 融合蛋白Mgfp-5诱导表达的可溶性分析Fig.7 Soluble analysis of Mgfp-5 fusion protein
2.4诱导条件的优化
2.4.1诱导前菌体生物量外源蛋白的表达会因细菌的生长速率的变化而变化, 因此需要优化菌液浓度。灰度扫描电泳条带分析(图8), Mgfp-5的表达量开始时随着菌液OD600值的增加而增加,在0.8时最高,为10.7%,当OD600>0.8时表达量随OD值增加而减少。这可能是细菌已处于过度生长状态,细菌活力下降,死亡菌体数量增加,Mgfp-5的表达量随之减少。选定蛋白表达量最高时的OD600=0.8,作为诱导前实验所选的最佳菌体培养生物量标准。

A SDS-PAGE结果 B 蛋白含量M Marker; 1-4 OD600依次为1.0, 0.8, 0.6, 0.4; 5 未诱导(OD600为0.6)图8 诱导前菌体生物量对重组蛋白Mgfp-5表达的影响Fig.8 Optimization of for bacteria biomass inducing recombinant protein Mgfp-5 expression
2.4.2诱导温度的确定诱导温度不仅影响菌体的生长,也影响着外源蛋白的表达以及蛋白的可溶性,被认为是表达外源蛋白时最大的影响因素[22]。灰度扫描电泳条带,分析不同培养温度对Mgfp-5蛋白表达量的影响(图9),在37℃诱导重组蛋白Mgfp-5时,可溶性形式存在的重组蛋白Mgfp-5表达量(12.3%)明显优于其他温度的诱导。通常较高温度诱导蛋白表达时容易出现错误性折叠,形成包涵体而沉淀,而低温诱导可以有助于蛋白的可溶性表达[23],与本实验尝试的较高温度诱导可溶性表达有异。

A SDS-PAGE结果 B 蛋白含量M Marke; 1 未诱导; 2-4 依次为25, 30, 37℃诱导上清图9 Mgfp-5蛋白的诱导温度优化Fig.9 Optimization of temperature for inducing recombinant protein Mgfp-5 expression
2.4.3诱导时间的优化选择不同时间诱导培养(图10), Mgfp-5的表达量在8h之内呈上升趋势, 8h后下降, 可能是随着诱导时间的延长, Mgfp-5蛋白自身不稳定或者被菌体内源酶解所致;当诱导8h时,Mgfp-5的表达量最大(11.2%)。8h为最佳诱导时间。
2.4.4诱导剂IPTG浓度的优化常采用诱导剂IPTG,诱导表达型工程菌的重组蛋白高效表达[24]。不同浓度IPTG诱导(图11)Mgfp-5蛋白表达,当IPTG<0.8 mmol/L时,表达量与IPTG浓度呈正相关,IPTG>0.8 mmol/L时蛋白的表达量与诱导剂浓度出现负相关。推测IPTG作为诱导剂时,高浓度对菌株本身有一定的毒害作用,抑制菌株生长[25],从而造成目标蛋白的表达量的下降。0.8 mmol/L IPTG诱导时,Mgfp-5表达量最高(16.7%),选定诱导最佳浓度为0.8 mmol/L。

A SDS-PAGE结果 B 蛋白含量M Marker; 1-8 诱导时间依次为0, 2, 4, 6, 8, 10, 12, 16 h图10 Mgfp-5 蛋白的诱导时间优化Fig.10 Optimization of time for inducing recombinant protein Mgfp-5 expression

A SDS-PAGE结果 B 蛋白含量M Marker; 1-5 IPTG浓度依次为1.2, 1.0, 0.8, 0.6, 0.4mmol/L; 6 未诱导图11 Mgfp-5蛋白的IPTG诱导浓度优化Fig.11 Optimization of IPTG concentration for inducing recombinant protein Mgfp-5
2.5重组蛋白纯化条件的优化
在Ni2+亲和层析时,咪唑起最关键的作用,Binding Buffer和Wash Buffer中低浓度的咪唑能够有效的降低杂蛋白与Ni2+柱的结合,可减少纯化步骤。Elution Buffer中高浓度的咪唑与His竞争Ni2+有利于洗脱蛋白。pH的降低会使His残基质子化,减弱重组蛋白与树脂结合位点的作用,使标签蛋白中的His不能够与Ni2+结合,蛋白易被洗脱。
Ni2+柱纯化的蛋白Mgfp-5,SDS-PAGE分析呈现单一条带;Elution Buffer咪唑浓度为500 mmol/L时效果最好,继续提高浓度洗脱效果变化不明显(图12)。在500 mmol/L咪唑时优化洗脱pH,洗脱效果(图13)随着pH的降低而逐渐提高,当pH降至7.0和6.5时洗脱效果相差不大。考虑到较低的pH会降低蛋白活性[26],最终确定洗脱液pH为7.0。

M Marker; 1-4 咪唑浓度依次为625, 500, 375 , 250 mmol/L; 5 全蛋白图12 不同咪唑对重组蛋白纯化的影响Fig.12 Influence of different imidazole concentration on the Mgfp-5 purification

M Marker; 1-4 pH分别为8.0, 7.5, 7.0 , 6.5; 5 全蛋白图13 不同pH对重组蛋白纯化的影响Fig.13 Influence of different pH on the Mgfp-5 purification
2.6纯化后Mgfp-5蛋白的鉴定
分别取重组菌株未诱导及诱导总蛋白,纯化重组蛋白,Western Blot鉴定,结果显示(图14)纯化蛋白与全菌液上清蛋白的显色条带与电泳中的条带位置一致,为预期的重组蛋白Mgfp-5。

1 未诱导; 2 诱导; 3 纯化的Mgfp-5图14 Mgfp-5蛋白Western blot分析Fig.14 Western blot analysis of Mgfp-5
3 讨论与结论
贻贝足丝蛋白组分中,Mgfp-5蛋白分子量最小,但多巴(DOPA)含量最高,为25%~30%[17],是开发新型防水和生物医疗黏合剂的主要候选分子之一。20世纪80年代,人们开始关注贻贝足丝蛋白及其基因的结构、功能和相关黏附机制,但是其研究瓶颈一直是没有足够量的纯品Mgfp-5蛋白。现有的Mgfp-5蛋白主要靠天然获取,然而其易固化、纯化难、获取量低,使得越来越多研究者尝试基因工程解决此问题。目前仅有Hwang等[21]在大肠杆菌中的表达地中海贻贝Mgfp-5蛋白,试图得到重组蛋白,但是表达的重组蛋白在变性条件下,纯化率低,蛋白量极少。资料少有通过探讨不同诱导表达条件,来有效诱导Mgfp-5重组蛋白表达的研究。本文从Mgfp-5的高效表达入手,优化了重组蛋白Mgfp-5诱导及纯化条件。
His-tag是由6个组氨酸组成的短肽,目的蛋白与标签一起表达可以增加蛋白的可溶性,组氨酸短肽对重组蛋白的大小、功能以及免疫原性的影响都相对较低,且纯化的蛋白可以直接制备抗体[27],本实验择其优点选取His-tag纯化Mgfp-5蛋白。
重组蛋白原核表达系统中的菌液OD、诱导温度、时间及诱导剂等,都影响到蛋白的表达量[22-26],优化合适的工程菌株表达条件可以提高重组蛋白的产量。E.coliBL21/pET28a-mgfp在37℃,OD600=0.8,IPTG浓度为0.8 mmol/L诱导8h,可有效得到可溶性表达的目的蛋白Mgfp-5。在Ni2+柱的纯化中,选择合适的咪唑浓度和洗脱液的pH有助于获得较高纯度和较好功能的重组蛋白[26]。在Elution Buffer pH7.0时,用500 mmol/L咪唑洗脱,可以纯化得到Mgfp-5蛋白,SDS-PAGE灰度扫描分析纯度达到96%。
本研究构建了pET28a-mgfp表达载体并在E.coliBL21成功表达Mgfp-5,使用Ni2+柱层析纯化、Western Blot鉴定重组的Mgfp-5。纯化的蛋白Mgfp-5特异性条带,比预估的11.4kD目标条带稍大一些,可能与蛋白本身携带电荷、高等电点更易结合SDS,造成电泳条带有了一定的迁移[21]。在蛋白能够表达的同时优化了Mgfp-5蛋白在E.coliBL21中的表达及纯化条件,获得重组蛋白Mgfp-5,浓度为4.32 mg/mL,纯化率为8.3%。本工作为后续单克隆抗体的制备、黏蛋白黏附机理研究及生物医用黏合剂的发展奠定了基础。
[1]WAITE J H, TANZER M L. Polyphenolic substance of Mytilus edulis: Novel adhesive containing L-dopa and hydroxyproline [J]. Science, 1981, 212(4498): 1038-1040.
[2]HWANG D S, GIM Y, CHA H J. Expression of functional recombinant mussel adhesive protein type 3A inEscherichiacoli[J]. Biotechnology Progress, 2005, 21(3): 965-970.
[3]HWANG D S, YOO H J, JUN J H, et al. Expression of functional recombinant mussel adhesive protein Mgfp-5 inEscherichiacoli[J]. Applied and Environmental Microbiology, 2004, 70(6): 3 352-3 359.
[4]DEMING T J. Mussel byssus and biomolecular materials [J]. Current Opinion in Chemical Biology, 1999, 3(1): 100-105.
[5]WAITE J H. Evidence for a repeating 3,4-dihydroxyphenylalanine-and hydroxyproline-containing decapeptide in the adhesive protein of the mussel,MytilusedulisL [J]. Journal of Biological Chemistry, 1983, 258(5): 2911-2915.
[6]YU M, HWANG J, DEMING T J. Role of L-3, 4-dihydroxyphenylalanine in mussel adhesive proteins [J]. Journal of the American Chemical Society, 1999, 121(24): 5825-5826.
[7]RZEPECKI L M, HANSEN K M, WAITE J H. Characterization of a cystine-rich polyphenolic protein family from the blue musselMytilusedulisL [J]. The Biological Bulletin, 1992, 183(1): 123-137.
[8]WAITE J H. Adhesion in byssally attached bivalves [J]. Biological Reviews, 1983, 58(2): 209-231.
[9]HWANGD S, SIM S B, CHAH J. Cell adhesion biomaterial based on mussel adhesive protein fused with RGD peptide [J]. Biomaterials, 2007, 28(28): 4039-4046.
[10] DOVE J, SHERIDAN P. Adhesive protein from mussels: possibilities for dentistry, medicine, and industry [J]. Journal of the American Dental Association (1939), 1986, 112(6):879.
[11] HWANG D S, WAITE J H, TIRREL L M. Promotion of osteoblast proliferation on complex coacervation-based hyaluronic acid-recombinant mussel adhesive protein coatings on titanium [J].Biomaterials, 2010, 31(6): 1080-1084.
[12] WU C, HAN P, LIU X, et al. Mussel-inspired bioceramics with self-assembled Ca-P/polydo pamine composite nanolayer: Preparation, formation mechanism, improved cellular bioactivity and osteogenic differentiation of bone marrow stromal cells [J].Acta Biomaterialia, 2014, 10(1): 428-438.
[13] YIN M, YUAN Y, LIU C, et al. Development of mussel adhesive polypeptide mimics coating for in-situ inducing re-endothelialization of intravascular stent devices [J]. Biomaterials, 2009, 30(14):2764-2773.
[14] SABABI M, ZHANG F, KRIVOSHEEVA O, et al. Thin composite films of mussel adhesive proteins and ceria nanoparticles on carbon steel for corrosion protection [J]. Journal of the Electrochemical Society, 2012, 159(8):C364-C371.
[15] ZHANG F, PAN J, CLAESSON P M. Electrochemical and AFM studies of mussel adhesive protein (Mefp-1) as corrosion inhibitor for carbon steel [J]. Electrochimica Acta,2011,56(3):1636-1645.
[16] ZHANG F, PAN J, CLAESSON P M, et al. Electrochemical, atomic force microscopy and infrared reflection absorption spectroscopy studies of pre-formed mussel adhesive protein films on carbon steel for corrosion protection [J]. Thin Solid Films, 2012, 520(24):7136-7143.
[17] WAITE J H, QIN X. Polyphosphoprotein from the adhesive pads ofMytilusedulis[J]. Biochemistry,2001,40(9):2887-2893.
[18] 蒋臻. 翡翠贻贝足丝黏附蛋白Pvfp-1黏附功能及其应用的研究 [D].西安:西北大学,2011.
[19] 李楠楠,谭亮,王智平,等. 厚壳贻贝足丝黏附蛋白mfp-3重组表达及黏附功能分析 [J].中国生物化学与分子生物学报,2011,27(9):851-857.
[20] 郑昕,王运吉. 贻贝黏合蛋白基因转化巴斯德毕赤酵母 [J]. 大连轻工业学院学报,2003,22(2):100-102.
[21] HWANG D S, YOO H J, JUN J H, et al. Expression of functional recombinant mussel adhesive protein Mgfp-5 inEscherichiacoli[J]. Applied and Environmental Microbiology, 2004, 70(6): 3352-3359.
[22] 叶姣,陈长华. 温度对重组大肠杆菌生长及外源蛋白表达的影响 [J]. 华东理工大学学报(自然科学版),2002, 28(4): 364-367.
[23] 朱红裕,李强. 外源蛋白在大肠杆菌中的可溶性表达策略 [J]. 过程工程学报, 2006, 6(1):150-155.
[24] 卫红飞,万敏,杨世杰,等. 不同诱导剂对工程菌发酵及重组蛋白表达的影响[J]. 中国生物制品学杂志,2006,18(6):518-519.
[25] 丁军颖,伊瑶,争津舐,等. 不同温度、时间、IPTG和菌种浓度对丁肝抗原蛋白表达量的影响 [J]. 医学研究杂志,2012, 41(5):31-34.
[26] UEDA E, GOUT P, MORGANTI L. Current and prospective applications of metal ion-protein binding [J]. Journal of Chromatography A, 2003, 988(1):1-23.
[27] 黄蓉,徐小洁,梁迎春,等. 人ATG4B 的表达及蛋白纯化和鉴定 [J]. 细胞与分子免疫学杂志,2015(4): 173-176.
(编辑陈镱文)
Prokaryotic expression and purification ofMytilusgalloprovincialisfoot protein-5
LÜ Yu-wei, LÜ Ya-wei, YANG Ze-shang, WANG Rui-jie, ZHANG Yu-jing, WANG Ying-juan
(College of Life Science, Key Laboratory of Resource Biology and Biotechnology in Western China, Ministry of Education/Provincial Key Laboratory of Biotechnology, Northwestern University, Xi′an 710069, China)
The byssus ofMytilusgalloprovincialisproduce and secrete specialized adhesivesMytilusgalloprovincialisfoot protein type 5 (Mgfp-5) which has significant adhesive ability and biocompatibility and which is rich in high DOPA. It can be widely used in medical, chemical surface and ocean engineering or other fields. But the natural extraction of Mgfp-5 resulted in very little purified protein since this process is labor-intensive and inefficient, and these issues restrict its application. To obtain enough Mgfp-5 for the further study, gene fragments mgfp-5 were amplified and cloned it into the prokaryotic expression vector pET28a, then transformed it intoEscherichiacoli(E.coli) BL21(DE3) expression system. The expression of Mgfp-5 protein was induced by isopropyl-β-d-thiogalactoside (IPTG) and SDS-PAGE was used to identify Mgfp-5. The recombinant plasmid pET28a-mgfp was constructed correctly and the recombinant protein was expressed successfully. The factors including bacteria biomass, temperature, time and concentration of IPTG were optimized before induction. Recombinant protein was purified using Ni-NTA Purification System under native conditions. The optimum conditions for the induced expression of recombinant protein were determined as follows: the OD600of bacterial before induction with 0.8, the IPTG concentration of 0.8 mmol/L, the induction temperature of 37℃ and the induction time of 8 h. Recombinant protein was eluted with Native Elution Buffer (pH 7.0) containing 500 mmol/L imidazole. The specificity of the recombinant protein was confirmed using western blots. It can provide the basis for the Mgfp-5 manufacture, in-depth theoretical research and practical application. It can also provide a new way to develop a bioadhesive in medical or underwater environments.
Mytilusgalloprovincialis; mgfp-5 gene; prokaryotic expression; purification; optimization
2015-12-28
国家自然科学基金资助项目(31270411;31572665);陕西省教育厅社会发展攻关计划基金资助项目(2012K120102);陕西省教育厅专项基金资助项目(12JK0827;12JS105)
吕玉伟,女,山东新泰人,从事转基因及蛋白提取方面的研究。
王英娟,女,陕西西安人,西北大学副教授,博士,从事生物技术及细胞工程研究。
Q78
A
10.16152/j.cnki.xdxbzr.2016-03-016
