关于氮、磷元素异同的问题
2016-09-28北京王笃年
◇ 北京 王笃年
◇ 黑龙江 卢国锋
关于氮、磷元素异同的问题
◇北京王笃年
1) 作为同一主族且在周期表里相邻的元素,为什么氮元素的单质为N2而磷元素的单质则是P4(白磷)?
与此类似的问题还有很多,如,同主族的氧元素和硫元素,其单质分子结构也有很大不同——氧元素的单质有O2和O3等小分子,而常温下硫元素的稳定单质则主要是S8;再如,同属第ⅣA族的碳元素有金刚石(微观四面体结构)和石墨(微观平面六边形结构)及“球碳”“碳纳米管”等多种,而硅元素则难以形成类似石墨的微观平面层状结构,“球硅”“硅纳米管”是理论化学家和实验化学家一直在追求的物种,说明它们并不常见.
对这样一些事实,目前我们只能从原子半径不同导致原子间结合时轨道重叠程度不同等角度加以理解.根据价键理论,当2个N原子相互结合时,首先通过2p轨道的“头碰头”重叠形成1个σ键,为满足每个原子最外层的8电子稳定结构,其余2个相互平行的2p轨道从侧面以“肩并肩”的形式发生电子云重叠,形成2个π键.我们不妨这样想象,氮原子半径较小,所以2p轨道可以发生较大程度的重叠,形成的π键比较牢固.而半径相对较大的磷原子,2个原子间距离大,3p轨道重叠程度小,会导致形成的“3p-3p”π键不够牢固,故而不易形成P2分子.相反,如果4个P原子彼此间结合形成正四面体结构的P4分子,每个P原子都与另外3个P原子间以σ键结合(尽管键角并不理想,分子内部张力相对较大,但是由于P原子半径大,可在一定程度上缓解张力作用)则比较容易,一般说来,σ键比π键的电子云重叠程度大,键更稳定一些.
科学研究表明,在800℃以上,P4也会分解为P2,其分子结构与N2相似,2个P原子间形成共价三键.
2)P的最高价氧化物是P2O5还是P4O10?同一物质为什么会有2种不同写法?
P2O5叫化学式,P4O10才是分子式.请参考图1.

图1
P4氧化时(红磷氧化也发生类似过程),先断开各个P—P键,在中间插入氧原子,形成P4O6分子(化学式P2O3),这时每个磷原子还有1对孤对电子,它们分别再向1个氧原子配位,即形成P4O10分子.可以看出,无论P4O6还是P4O10分子中,磷原子、氧原子都是满足最外层8电子稳定结构的,所以它们都可以独立存在.
在化学研究的早期,人们并没有分子结构的概念,那时主要通过质量测定换算物质的元素组成情况,大量的实验数据表明,磷元素的最高价氧化物中磷元素与氧元素的质量比是31∶40,人们由此推知,该化合物的组成比例为P2O5.
3) 为什么硝酸分子式为HNO3而磷酸分子式为H3PO4?
请参考本刊2013年第13期《笃年老师问与答——关于含氧酸命名规则及酸性强弱的问题》.
4) 为什么磷酸难挥发而硝酸却易挥发?
液体是否容易挥发,一般看其沸点是否低于水的沸点100℃.磷酸沸点为261℃,而硝酸沸点只有83℃,所以我们说磷酸为难挥发性酸而硝酸则属于挥发性酸.物质的沸点高低决定于其内部分子间作用力的强弱,从磷酸和硝酸的分子结构看,它们都含有羟基,因此似乎都具备形成分子间氢键的条件,但是由于硝酸分子中只有1个氢原子,它首先参与分子内氢键的形成(图2),以至于分子间氢键的强度受到影响,所以硝酸的沸点并不高.而磷酸分子内有3个氢原子,不可能都形成分子内氢键,所以分子间氢键作用很强,故而沸点高.
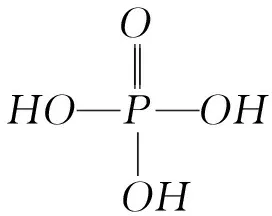
图2
上述“硝酸分子内氢键”的说法只是教科书的描述,其实根据氢键理论可知,该分子内氢键在方向性方面存在很大问题(理想的氢键应该是X—H…Y直线结构).我们不妨用“硝酸分子内氢原子数少,因而分子间形成的氢键数量少”来理解它与磷酸沸点的差异.
5) 为什么常见的3类化学肥料(氮肥、磷肥、钾肥)中,氮族元素就占了2类?
这涉及元素观问题.构成植物的化学物质主要是糖类(淀粉和纤维素)、油脂、蛋白质,从元素的视角看,主要有H、C、O、N、S、P等元素,H、C、O可以从大气和土壤中吸收H2O和CO2获得,N、P等虽然也可以从土壤中获取,但对于现代农业的产量需求来说,自然土壤提供不了所需要的量,所以需要人为补充这些元素(以作物能够吸收利用的方式,所谓“肥料”).
其实,氮、磷、钾肥只是人们对于传统农业肥料的经验性认识,不同的作物、不同的种植方式决定着土壤需要肥料的种类.首先我们知道,封闭的大棚种植需要施用CO2“气肥”,因为大棚内气体不参与大气循环,CO2供应不足;有些作物不宜“重茬”种植,除了考虑病虫害等因素外,更重要的原因则是植物生长需要的某些微量元素(有些可能是目前尚未认识到的)供应不足.所以,现代农业不再像传统农业那样只依据观察和经验施用化学肥料,而是依据科学研究的结果,进行“测土施肥”——先测定土壤中各元素的含量,再依据所种植植物的生长需要科学合理地设计配方,向土壤中施加各种营养元素,包括氮、磷、钾肥及硫、硼、钙、钼等微量元素肥料.
1 原子结构与元素的性质
1.1基态原子(离子)的核外电子排布
1) 1~18号元素按构造原理1s2s2p3s3p填充电子,19~36号元素E3d>E4s, 1s2s2p3s3p4s3d4p,书写时按能层调整为1s2s2p3s3p3d4s4p,同时书写顺序也是由外向内失去电子形成离子顺序.
2) 画电子排布图时遵循泡利原理和洪特规则,每个轨道最多容纳2个自旋状态相反的电子,当电子排布在等价轨道上时,电子总是优先单独占据1个轨道,而且自旋方向相同.
3) 审题时注意书写微粒状态是原子还是离子,是外围排布式(也叫价电子排布式)还是核外电子排布式,是电子排布式还是电子排布图.教材第7页“思考与交流”,提供了电子排布式的简化书写方法,[稀有气体元素符号]外围排布式.如:钠原子的电子排布式1s22s22p63s1;钠离子的电子排布式1s22s22p6.钠原子可简写:[Ne]3s1,若删除稀有气体部分得外围电子排布式3s1.过渡元素中不仅最外层电子为价电子,次外层电子也可成为价电子,如:Cu[Ar] 3d104s1,删除稀有气体结构得外围电子排布式3d104s1,K外围电子排布式4s1,外围电子排布式不同,但最外层电子数相同.


1.2元素性质——电离能和电负性
1) 元素第一电离能变化规律:每一周期的第一种元素(氢和碱金属)的第一电离能最小,最后一种元素(稀有气体)的第一电离能最大,同周期从左到右元素第一电离能呈增大趋势,但第ⅡA族s2全充满结构和第ⅤA族p3半充满结构,原子的能量较低,该元素具有的第一电离能比邻近的元素大.
2) 电离能的应用:判断元素的金属性强弱.I1越大,元素的金属性越弱;I1越小,元素的金属性越强.根据电离能数据,确定元素在化合物中的化合价.钠和镁第一、二、三电离能,如表1所示.

表1
从表1可以看出钠的第一电离能较小而第二电离能突跃地升高,表明钠易失去1个电子达到8电子稳定结构,形成+1价Na+,不易再失去第2个电子;而镁的第一、二电离能均较低,第三电离能突跃地升高,说明镁易失去2个电子,形成+2价Mg2+后达到8电子稳定结构,再失去第3个电子很困难.
3) 电负性变化规律:同一周期从左到右,元素的电负性逐渐增大,同一主族从上至下电负性减小.在所有元素中,氟的电负性(4.0)最大,非金属性最强,钫的电负性(0.7)最小,金属性最强.




2 化学键与物质的性质考点
2.1σ键和π键的形成,键的极性和分子的极性
1) 共价键按成键原子关系分为非极性键、极性键;按电子云重叠方式分为δ键、π键;按共用电子对的来源分为一般共价键、配位键A→B.判断键的极性方法:看成键原子是否相同.
2) 判断分子极性方法:a) 中心原子化合价法.组成为ABn型化合物,若中心原子A的化合价(只考虑数值)等于族的序数,则该化合物为非极性分子,如CH4、CCl4、SO3、PCl5.b) 受力分析法.若已知键角(或空间结构),可进行受力分析,合力为0者为非极性分子,如CO2、C2H4、BF3.
3) 判断δ键和π键成键数目方法: 共价单键是δ键,共价双键有1个δ键、1个π键,共价三键由1个δ键、2个π键组成.
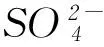
5) 鲍林从实验中总结出经验规律,含氧酸用通式表示为(HO)mROn,其中n为非羟基氧原子(即不与氢相连的氧原子)的数目,n越大,酸性越强.结构解释是成酸R元素相同,n值越大,R的正电性越高,导致R—O—H中O的电子向R偏移,水分子作用下,越容易电离出H+,即酸性越强.如酸性由强到弱为HClO4、HClO3、HClO2、HClO.




2.2简单配合物的成键
配位键是特殊的共价键.一方有孤对电子,而另一方有空轨道,这是形成配位键的必要条件,常用电子对给予体→电子对接受体符号表示.在配合物中,与配合物形成体(中心原子或离子)直接结合的配位原子总数,叫配位数.





2.3金属晶体常见的堆积方式
在讨论各种类型晶体结构时,也常借用配位数这个名词,指1个原子(或离子)周围连接的其他原子(或异号离子)的数目.金属有4种堆积模型,简单立方堆积、体心立方堆积、面心立方最密堆积、六方最密堆积,其配位数分别6、8、12、12.


2.4杂化轨道类型与分子构型







3 分子间作用力与物质的性质考点
3.1氢键的存在对物质性质的影响
氢键是H原子特有的性质,半径很小的H原子与电负性大的X(符合条件的有F、O、N)形成共价键后,由于X吸引价电子能力大,使H几乎成为“裸露”的质子,由于质子的半径特别小,可以与另一个电负性大的Y相互作用形成氢键,一般表示为X—H…Y,X—H键是共价键,其中H…Y的结合力就是氢键.氢键是介于化学键和分子间作用力之间的一种特殊的作用,其强度远小于化学键,略大于分子间作用力.氢键分为分子间氢键、分子内氢键2种.如HF、H2O、HCOOH可以结合为(HF)n、(H2O)n、(HCOOH)n.分子间形成的氢键会使物质的熔点和沸点升高.

A第4周期元素中,锰原子价电子层中未成对电子数最多;
B第2周期主族元素的原子半径随核电荷数增大依次减小;
C卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小;
D价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数

3.2分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别
晶体熔、沸点的比较方法: 1) 不同晶体类型的物质,一般情况下,熔、沸点由高到低顺序为原子晶体、离子晶体、分子晶体,而金属晶体的熔、沸点差异较大,有的很高(钨),有的很低(汞).2) 原子晶体:原子半径越大,共价键越长,共价键就越弱,熔、沸点越低;离子晶体:离子所带电荷越多,离子半径越小,则离子键越强,熔、沸点越高;金属晶体:金属阳离子带的电荷越多,半径越小,金属键越强,熔、沸点越高;分子晶体:组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,熔、沸点越高;组成和结构不相似的物质,分子的极性越大,熔、沸点越高;若分子间存在氢键,则熔、沸点会反常高. 3) 对于有明显状态差异的物质,根据常温下状态进行判断.


表2
Ge单晶具有金刚石型结构,微粒之间存在的作用力是________.



3.3根据晶胞确定晶体的组成并进行相关计算
1) 用均摊的方法来确定晶体的化学式(图1).

图1
空间利用率=[V(球总体积)/V(晶胞体积)]×100%.
注意单位换算: 1m=10dm=102cm=103mm=106μm=109nm=1012pm.
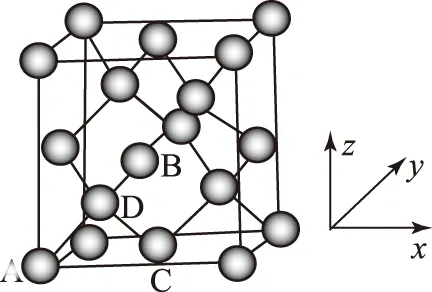
图2


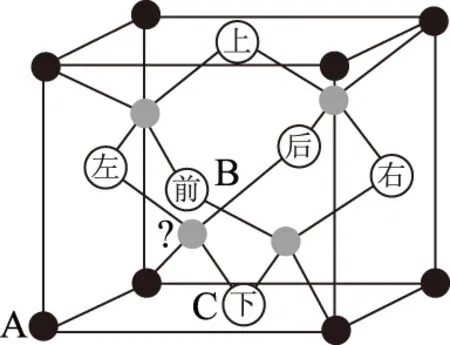
图3
(作者单位:黑龙江省大庆市第五十六中学)
北京十一学校)

◇黑龙江卢国锋
2016年全国卷和地方卷共10套,《物质结构与性质》模块在全国卷3套中以“三选一”的形式作答,海南卷中必考与选考相结合,江苏卷“二选一”,四川卷一道必考题,上海卷一道必考题中的一部分,7套卷都涉及此模块试题.本文按照考试大纲考点,将相关试题分解,揭示命题规律,归纳解题常用方法.
