与化学键有关的几组易混淆概念的导析
2016-09-28安徽张保定
◇ 安徽 张保定
与化学键有关的几组易混淆概念的导析
◇安徽张保定
化学键作为物质结构中的重要理论知识,是中学化学教学的重要内容.既是《必修2》的内容,也是《选修3》的基础.通过这部分知识的学习,不仅可以使学生对所学元素化合物知识进行综合、归纳,形成初步的化学理论,为继续学习化学打下基础,还可帮助学生进一步认识物质结构的知识、化合物的形成及化学反应的本质.但由于化学键知识的理论性较强,概念较多,且内容较为抽象,使学生理解起来比较困难,本文对与化学键有关的几组易混淆的概念进行导析.
1 化学键、氢键和分子间作用力(表1)

表1
当氢原子与原子半径小且吸电子强的N、O、F等原子相结合时,由于键的极性太强,使共用电子对极大地偏向于吸电子能力强的原子,使H原子几乎成了不带电子、半径极小的带正电的核,它会受到相邻分子中原子半径小且吸电子能力强的原子中孤对电子的强烈吸引,而表现出较强的作用力,这种作用力称为氢键,属于一种较强的分子间作用力.一般影响物质的物理性质,如溶解性和熔、沸点等.

A原子间的相互作用都是化学键;
B只有相邻的2个原子间才能形成化学键;
C氢键是氢原子与原子半径小且吸电子强的原子之间形成的一种特殊的化学键;
D化学键包括相邻原子间相互吸引和排斥两方面的强烈作用

2 离子键和共价键比较(表2)

表2

A原子半径:r(W)>r(Z)>r(Y)>r(X);
BY分别与Z、W形成的化合物中化学键类型相同;
CX的最高价氧化物对应水化物的酸性比W的弱;
DY的气态简单氢化物的热稳定性比W的强

3 非极性键和极性键(表3)
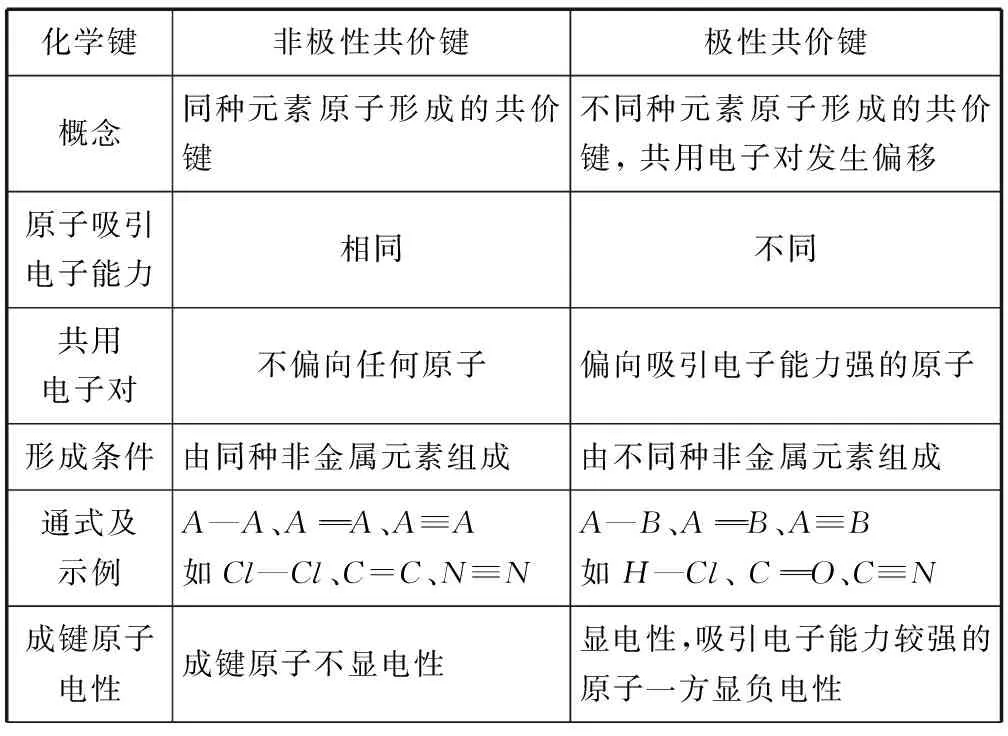
表3
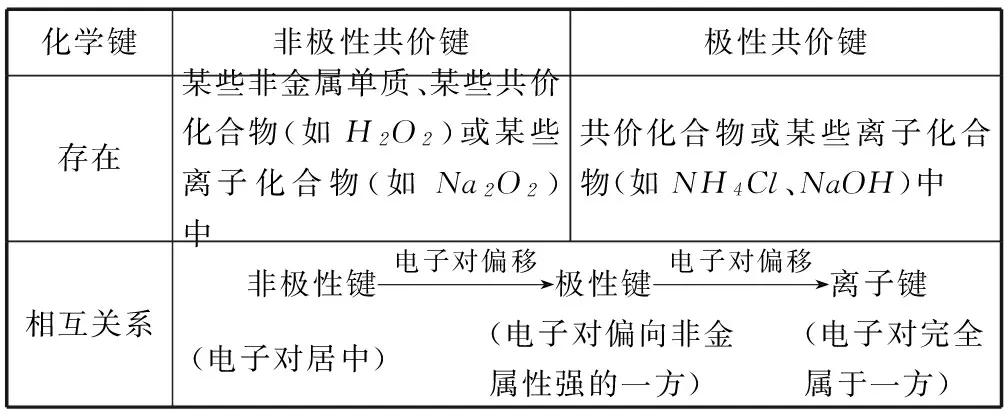
续表3

Ad元素的非金属性最强;
B它们均存在2种或2种以上的氧化物;
C只有a与其他元素生成的化合物都是离子化合物;
Db、c、d与氢形成的化合物中化学键均为极性共价键

4 离子化合物和共价化合物(表4)

表4

A单质的沸点:W大于X;
B阴离子的还原性:W强于Z;
C氧化物的水化物的酸性:Y弱于Z;
DX与Y不能存在于同一离子化合物中

5 化学键与单质、化合物类型之间的关系
1) 离子化合物中一定有离子键,可能还有共价键.简单离子组成的离子化合物中只有离子键,如MgO、NaCl等.复杂离子(原子团)组成的离子化合物中既有离子键又有共价键,既有极性共价键,又有非极性共价键.只含有离子键的物质:MgO、NaCl、MgCl2;含有极性共价键和离子键的物质:NaOH、NH4C1、Na2SO4;含有非极性共价键和离子键的物质:Na2O2、CaC2、Al2C3等.2) 共价化合物中只有共价键.3) 在由双原子或多原子组成的物质中,非金属单质中只有共价键,如N2、O2、P4.4) 离子键只存在于离子化合物中,在单质中无离子键;非金属单质中可能存在非极性共价键,如H2、N2、O2、Si、P4、Cl2等.构成稀有气体的单质分子由于原子已达到稳定结构,这些分子中不存在化学键.5) 非金属元素的原子之间也可以形成离子键,如NH4Cl.

ACaO与CO2;BNaCl与HCl;
CSiC与SiO2;DCl2与I2

