不同致病力禽流感病毒比较研究的适宜小鼠模型筛选
2016-09-28董照光傅卫辉刘璐徐建青张晓燕
董照光 傅卫辉 刘璐 徐建青 张晓燕
325000 温州医科大学检验医学院生命科学学院[董照光(硕士研究生)、张晓燕]; 201508 上海市公共卫生临床中心,复旦大学附属公共卫生临床中心(董照光、傅卫辉、刘璐、徐建青)
·论著·
不同致病力禽流感病毒比较研究的适宜小鼠模型筛选
董照光傅卫辉刘璐徐建青张晓燕
325000 温州医科大学检验医学院生命科学学院[董照光(硕士研究生)、张晓燕]; 201508 上海市公共卫生临床中心,复旦大学附属公共卫生临床中心(董照光、傅卫辉、刘璐、徐建青)
目的筛选用于不同致病力禽流感病毒比较研究的适宜小鼠模型。方法采用禽流感病毒高致病力毒株H7N9和低致病力毒株H9N2分别以滴鼻方式感染C57BL/6和BALB/c小鼠,观察小鼠临床症状、病理变化并检测体内病毒载量。结果小鼠感染两类禽流感病毒1 d后均出现竖毛、聚集成堆、反应迟钝、四肢无力等症状。H7N9与H9N2感染BALB/c小鼠导致的体重丢失最低点分别为63.80%与66.35%,均低于C57BL/6小鼠(分别为68.96%与87.57%)。感染小鼠的肺组织都存在间质肺炎、水肿、充血、炎细胞浸润等病理症状,H7N9感染C57BL/6小鼠后肺组织病毒载量峰值(1.02×105拷贝/ml)约为BALB/c组(8.72×103拷贝/ml)12倍;而H9N2感染后C57BL/6小鼠肺组织病毒载量(5.94×103拷贝/ml)仅为BALB/c小鼠(2.86×104拷贝/ml)的20%。结论C57BL/6小鼠感染禽流感病毒更能表现出强弱毒株的致病特点,更适用于不同致病力禽流感病毒比较研究。小鼠的病理变化与临床特征与接种禽流感病毒株的生物学特征及小鼠品系均密切相关。
【主题词】禽流感病毒;小鼠模型;致病力;炎症反应;病毒载量
Fund programs: National Natural Science Foundation of China(81430030)
高致病性流感疫情的暴发来源除了季节性人流感病毒如H1N1、H3N2,还有禽来源的流感病毒如H5N1以及H7N9[1-2]。血凝素HA与神经氨酸酶NA组合形成复杂多样的基因型,其在病毒跨物种传播中致病力与对宿主的敏感性等方面发挥重要作用。新型H7N9禽流感病毒的内部基因片段与H9N2病毒(A/brambling/Beijing/16/2012)相似[3],但是根据世界动物健康组织规定的禽类静脉接种死亡指数检测,新型的H7N9病毒被认定为高致病性禽流感病毒,而H9N2是低致病性禽流感病毒[4]。
本研究主要使用高致病性的禽流感H7N9病毒和低致病性禽流感H9N2病毒分别感染C57BL/6和BALB/c小鼠,观察比较不同致病力病毒在不同品系小鼠中致病力差异,以期为今后流感病毒的不同研究目的选择适宜模型提供科学依据。
1 材料与方法
1.1材料
1.1.1实验动物:6-8周雌性C57BL/6和BALB/c小鼠,购买自上海西普尔-必凯实验动物有限公司,并饲养于上海市公共卫生临床中心无特殊病原体(SPF)级饲养室。病毒接种前将小鼠转移到实验动物生物安全二级实验室和实验动物生物安全三级实验室分别进行H9N2和H7N9禽流感病毒攻毒试验。所有和小鼠相关实验都遵循实验动物使用的3R原则并给与人道主义关怀。
1.1.2毒株:病毒株A/Chicken/Shanghai/F/98(H9N2)禽流感病毒由中国农业科学院上海兽医研究所提供。病毒株A/Shanghai/4664T/2013(H7N9)禽流感由上海市公共卫生临床中心动物实验生物安全三级实验室提供。
1.2方法
1.2.1动物分组:两个品系的小鼠(C57BL/6和BALB/c)按照体重各自随机分二个实验组包括H7N9攻毒组(n=30)和H9N2攻毒组(n=30),分别接种H7N9和H9N2禽流感病毒。
1.2.2攻毒:采用盐酸氯胺酮溶液 (50 μg/μl) 腹腔注射麻醉小鼠(40 μl/小鼠)。H7N9禽流感病毒的攻毒剂量为7×106TCID50;H9N2禽流感病毒的攻毒剂量为2×107EID50;对照组滴鼻PBS缓冲液40 μl。攻毒后小鼠分笼正常饲养。
1.2.3观察指标:攻毒前定义为0 d,分别在1 d、2 d、3 d、4 d、5 d、6 d、7 d观察小鼠,包括小鼠的活动、反应性、饮食、呼吸及有无弓背、竖毛、蜷缩、颤抖和死亡等每天用电子秤测量体重。
1.2.4病理检查:在0 h、1 d、3 d、7 d随机挑选3只小鼠处死,取肺组织用于组织病理学检查。
1.2.5肺组织病毒载量测定:在0 h、1 d、2 d、3 d、7 d随机挑选3只小鼠处死,取肺组织液氮研磨后抽提RNA,利用real-time PCR测定病毒载量。
1.3统计学方法数据处理采用 GraphPad Prism 5软件进行统计分析组间比较采用t检验,P<0. 05为具有统计学意义。
2 结果
2.1症状与体征H7N9和H9N2禽流感病毒都是通过滴鼻方式对C57BL/6和BALB/c小鼠进行攻毒。观察7 d。两种病毒都引起小鼠体重丢失,且BALB/c小鼠体重丢失比C57BL/6严重,H7N9病毒感染后第3天出现统计学差异,H9N2病毒感染后第1天出现统计学差异(P<0.05)(图1)。感染H7N9病毒感染导致的体重丢失最低点(Weight loss nadir)在BALB/c小鼠为63.80 %,C57BL/6小鼠为68.96 %,均低于H9N2病毒感染导致的体重丢失最低点(BALB/c小鼠:66.35 %;C57BL/6小鼠:87.57 %)。
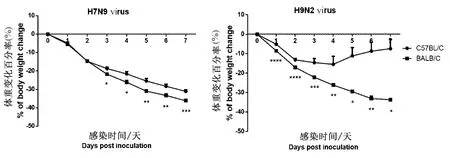
*,**,***和****分别代表P<0.05,0.01,0.001和0.0001图1 H7N9和H9N2禽流感病毒感染C57BL/6和BALB/c小鼠的体重变化*, **, ***and**** indicating P<0.05, 0.01, 0.001 and 0.0001, respectivelyFig.1 Weight changes in C57BL/6 and BALB/c mice after challenge with H7N9 and H9N2 avian influenza viruses
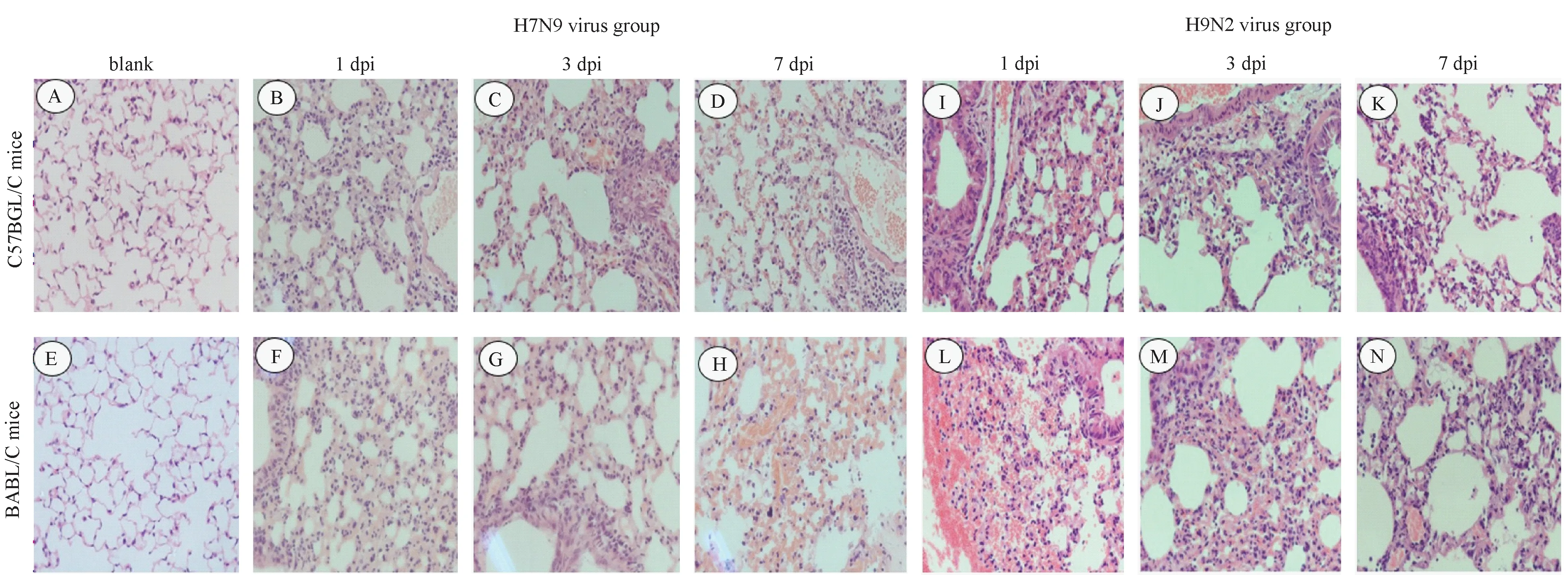
A和E分别为空白组C57BL/6 和BALB/c小鼠;B-D分别为感染H7N9病毒的1 d,3 d,7 d的C57BL/6小鼠,F-H分别为感染H7N9病毒的1 d,3 d,7 d的BALB/c小鼠;I-K分别为感染H9N2病毒的1 d,3 d,7 d的C57BL/6小鼠,L-N分别为感染H9N2病毒的1 d,3 d,7 d的BALB/c小鼠图2 小鼠肺组织HE染色结果(400×) A and E indicate C57BL/6 and BALB/c mice in control group, respectively. B-D indicate C57BL/6 mice infected by H7N9 viruses at the 1 st day, 3 rd day and 7th day, respectively F-H indicate BALB/c mice infected by H7N9 viruses at the 1 st day, 3 rd day and 7th day, respectively. I-K indicate C57BL/6 mice infected by H9N2 viruses at the 1 st day, 3 rd day and 7th day, respectively. L-N indicate BALB/c mice infected by H9N2 viruses at the 1 st day, 3 rd day and 7th day, respectivelyFig.2 Lung pathological features in BALB/c and C57BL/6 mice (400×)
2.2病理学检查H7N9禽流感病毒感染后小鼠肺组织都存在间质肺炎、水肿、充血、炎细胞浸润等病理症状,但病变程度却不相同(图2)。H9N2感染小鼠后亦出现类似的病理改变(图2):第1天出现红细胞严重渗出,第3天红细胞渗出减轻、炎细胞浸润,出现肺间质肺炎,第7天红细胞渗出基本消失且肺泡壁结构逐步恢复。值得注意的是,H9N2感染导致的上述病理改变在BALB/c小鼠重于C57BL/6小鼠。
2.3肺组织病毒载量通过RT-PCR对感染小鼠的肺组织进行病毒载量的测定。如图3所示H7N9病毒感染C57BL/6后第1天病毒载量即达峰值(1.02×105拷贝/ml),之后虽然逐渐降低,第7天依然保持在较高水平(3.41×104拷贝/ml);而H7N9感染BALB/c小鼠肺组织的病毒载量则持续在较低水平,第1天为5.68×103拷贝/ml,第2天升至峰值(8.72×103拷贝/ml),但不足前者的十分之一。
H9N2病毒感染C57BL/6和BALB/c小鼠后,肺组织病毒载量则显示了截然相反的趋势。H9N2感染C57BL/6小鼠后病毒载量则保持较低水平,小鼠第1天肺组织病毒载量为5.94×103拷贝/ml,第2天为2.86×103拷贝/ml,第3天即基本清除(89 拷贝/ml);而H9N2病毒感染BALB/c小鼠后第1天肺组织病毒载量为2.66×104拷贝/ml,第2天为2.86×104拷贝/ml,其后逐渐降低至第7天(469 拷贝/ml)。

图3 C57BL/6和BALB/c小鼠的病毒载量.*,**和****分别表示P<0.05,0.01和0.0001Fig.3 Viral loads in C57BL/6 and BALB/c mice. *, **and**** indicating P<0.05, 0.01 and 0.0001, respectively
3 讨论
甲型流感病毒为常见流感病毒,宿主范围非常广泛。根据血凝素蛋白HA和神经氨酸酶蛋白NA可将流感病毒分为不同的亚型,目前HA具有18个亚型[5],NA具有9个亚型。禽流感病毒为甲型流感病毒的亚型,能够引起禽类的从呼吸系统到全身等多种症状的传染病。新型H7N9禽流感病毒能够感染人且具有高发病率和病死率的特点[6],基因分析显示其相比其他禽流感病毒更加容易感染哺乳动物[7]。H7N9禽流感病毒感染猪和雪貂模型已经建立[8],但免疫学研究试剂和基因改造动物资源稀缺,对H7N9禽流感病毒研究具有局限性,小鼠作为很好的哺乳动物模型,广泛用于禽流感病毒的发病机理、免疫学、药物评估和疫苗研发。
前期不同研究团队的结果提示不同禽流感病毒对不同的小鼠品系具有不同的敏感性和致病力。例如2011年Otte研究表明C57BL/6小鼠比BALB/c小鼠更容易感染季节性H1N1流感病毒,然而H7N9与H5N1流感病毒感染BALB/c小鼠导致更加严重的病理损伤[9]。但是也有报道称H7N9病毒感染C57BL/6小鼠病毒清除缓慢[10]。 此外,H9N2禽流感病毒感染小鼠模型研究中经常使用BALB/c模型,但是有报道称H9N2病毒可在C57BL/6小鼠引起严重肺损伤[11]。我们的数据显示,与BALB/c小鼠相比,H7N9病毒感染C57BL/6小鼠可引起更加严重的炎症反应与更高的病毒载量(12倍);但是低致病性的H9N2感染BALB/c小鼠可导致更加严重的病理损伤,有报道称这可能由于低致病性的H9N2病毒通过氨基酸的突变产生高致病性的小鼠适应株[12]。
综合本研究与其他研究报道的数据,如需平行对比强弱不同禽流感病毒的致病力、发病机制与临床转归及其调控关键因素等相关研究,可考虑采用C57BL/6小鼠作为研究动物模型。当然,宿主对禽流感病毒感染不止体现在体重丢失、病毒载量、炎症病理损伤等方面,还涉及宿主固有免疫与获得性免疫应答的诸多因素,应持续深入研究。
[1]Qin Y, Horby P W, Tsang T K, et al. Differences in the Epidemiology of Human Cases of Avian Influenza A(H7N9) and A(H5N1) Viruses Infection[J]. Clin Infect Dis,2015,61(4):563-571.doi: 10.1093/cid/civ345.
[2]Jernigan D B, Cox N J. H7N9: preparing for the unexpected in influenza[J]. Annu Rev Med,2015,66:361-371. doi: 10.1146/annurev-med-010714-112311.
[3]Wang C, Luo J, Wang J, et al. Novel human H7N9 influenza virus in China[J]. Integr Zool,2014,9(3):372-375. doi: 10.1111/1749-4877.12047.
[4]Lin Z, Xu C, Liu B, et al. Analysis of the phylogeny of Chinese H9N2 avian influenza viruses and their pathogenicity in mice[J]. Arch Virol,2014,159(10):2575-2586. doi: 10.1007/s00705-014-2110-7.
[5]Tong S, Zhu X, Li Y, et al. New world bats harbor diverse influenza A viruses[J]. PLoS Pathog,2013,9(10):e1003657. doi: 10.1371/journal.ppat.1003657.
[6]Tanner W D, Toth D J, Gundlapalli A V. The pandemic potential of avian influenza A(H7N9) virus: a review[J]. Epidemiol Infect,2015,143(16):3359-3374. doi: 10.1017/S0950268815001570.
[7]Gao R, Cao B, Hu Y, et al. Human infection with a novel avian-origin influenza A (H7N9) virus[J]. N Engl J Med,2013,368(20):1888-1897. doi: 10.1056/NEJMoa1304459.
[8]Zhu H, Wang D, Kelvin D J, et al. Infectivity, transmission, and pathology of human-isolated H7N9 influenza virus in ferrets and pigs[J]. Science,2013,341(6142):183-186. doi: 10.1126/science.1239844.
[9]Otte A, Sauter M, Alleva L, et al. Differential host determinants contribute to the pathogenesis of 2009 pandemic H1N1 and human H5N1 influenza A viruses in experimental mouse models[J]. Am J Pathol,2011,179(1):230-239. doi: 10.1016/j.ajpath.2011.03.041.
[10]Yen H L, Webster R G. Pandemic influenza as a current threat[J]. Curr Top Microbiol Immunol,2009,333:3-24. doi: 10.1007/978-3-540-92165-3_1.
[11]Li Y, Shan Y, Chi Y, et al. Acute lung injury induced by H9N2 virus in mice[J]. Chin Med J (Engl),2014,127(20):3576-3580.
[12]Zhang Z, Hu S, Li Z, et al. Multiple amino acid substitutions involved in enhanced pathogenicity of LPAI H9N2 in mice[J]. Infect Genet Evol,2011,11(7):1790-1797. doi: 10.1016/j.meegid.2011.07.025.
Mouse models choosing for the comparative study of different pathogenic avian influenza viruses
DongZhaoguang,FuWeihui,LiuLu,XuJianqingZhangXiaoyan
WenzhouMedicalUniversity,SchoolofLaboratoryMedicineandLifeScience,Wenzhou325000,China[DongZG(Master),ZhangXY];ShanghaiPublicHealthClinicalCenter,Shanghai201508,China(DongZG,FuWH,LiuL,XuJQ)
ZhangXiaoyan,Email:zhangxiaoyan@shaphc.org
ObjectiveTo filter appropriate mouse model for avian influenza viruses with different pathogenicity. MethodsTwo varieties mice (C57BL/6 and BALB/c) were anesthetized with ketamine and inoculated intranasal with highly pathogenic avian influenza virus H7N9 and low pathogenic avian influenza virus H9N2 in 50 μl PBS, or mock inoculated with PBS to serve as controls. The mice were observed daily including clinical symptoms body, weight and mortality. The pulmonary histopathological changes and viral load were also monitored. ResultsJust one day after the viral inoculation, H7N9 and H9N2 infected mice strains all showed reduced activity, ruffled fur and obvious body weight loss. The body weight loss nadir in BALB/c mice (63.80% for H7N9/BALB/c; 66.35% for H9N2/BALB/c ) were lower comparing to the corresponding viruses infected C57BL/6 mice (68.96% for H7N9/C57BL/6 and 87.57% for H9N2/C57BL/6 respectively). In addition, there were some obvious pulmonary oedema, haemorrhage and typical pulmonary interstitial inflammatory lesions in the lung tissues. The peak viral load in H7N9/C57BL/6 group (1.02×105copies/ml) was 12 folds higher than that in H7N9/BALB/c group (8.7×103copies/ml). But on the contrary, the peak viral load in H9N2/BALB/c group (2.86×104copies/ml) was 5 times of that in H9N2/C57BL/6 group (5.94×103copies/ml). ConclusionsPathogenic characteristics caused by different virulent avian influenza viral strains could be more clearly differential represented in C57BL/6 mice model, and thus it is more suitable for the comparative study between different pathogenic avian influenza viruses. It also reconfirmed that the different pathological changes and clinical outcomes of avian influenza viruses/mice infection models were associated not only to the different biological characteristics of inoculated virus strains, but also to hereditary characters of host mice strains.
Avian influenza virus; Mice model; Pathogenicity; Inflammatory response; Viral load
张晓燕,Email: zhangxiaoyan@shaphc.org
10.3760/cma.j.issn.1003-9279.2016.04.011
国家自然科学基金(81430030)
2016-02-19)
