白纹伊蚊内源性登革病毒序列分析
2016-09-28王衍海顾金保
王衍海 顾金保
100052 北京, 中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室(王衍海);510515 广州, 南方医科大学公共卫生学院(顾金保)
·论著·
白纹伊蚊内源性登革病毒序列分析
王衍海顾金保
100052 北京, 中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室(王衍海);510515 广州, 南方医科大学公共卫生学院(顾金保)
目的分析和验证白纹伊蚊(佛山株)基因组中的登革病毒来源的内源性病毒序列(endogenous viral elements,EVEs)。方法使用Blast序列比对工具,分别以四型登革病毒基因组全序列为待查序列对白纹伊蚊基因组进行序列比对分析。根据筛选得到的EVEs序列设计基因特异性引物,分别以雌、雄各8只成蚊个体进行基因组PCR检测并测序验证。结果在白纹伊蚊基因组上共计找到5个与登革病毒高度同源性的EVEs片段。其中,EVE-1与DENV-2 P8-1407MS株、EVE-2-5与DENV-1 02-20株具有高度的相似性。基因组PCR检测结果显示,EVE-1在种群个体中保守存在,而EVE-2未检测到,EVE-3-5在不同个体中变异度较高。结论白纹伊蚊基因组中存在登革病毒序列来源的EVEs,为研究登革病毒与媒介之间的相互作用提供了新的方向。
【主题词】登革热病毒;伊蚊属;内源性病毒序列
Fundprograms:NationalNaturalScienceFoundationofChina(81371846);PearlRiverS&TNovaProgrammeofGuangzhou(2014J2200032)
多种病毒在宿主细胞繁殖的长期过程中可以通过不同方式将部分或全部遗传物质整合入宿主基因组中,并随之遗传至子代,这种现象被称为病毒内生化(endogenization),其整合入的序列称为内源性病毒序列(endogenousviralelements,EVEs)[1]。在研究真核细胞基因组的过程中,人们发现除逆转录病毒(retrovirus)在其复制周期中具有整合入基因组而内生化的现象外, 一些DNA病毒和非反转录、RNA病毒亦存在整合入宿主细胞基因组的序列,这些来源不同的EVEs分别称之为内源性逆转录病毒(endogenousRetrovirus,ERV)、内源性DNA病毒与非逆转录整合RNA病毒(non-retroviralIntegratedRNAVirus,NIRV)[2,3]。白纹伊蚊是我国最重要的登革病毒(Denguevirus,DENV)媒介,本研究中,我们将分析、验证白纹伊蚊基因组中存在的登革病毒来源的EVEs。
1 材料与方法
1.1蚊株与饲养白纹伊蚊为我室保种广东佛山株。成蚊的饲养温度为27℃-29℃,湿度70%-80%,光照射循环12h/d,喂饲10%葡萄糖水。幼虫饲养于脱氯自来水,水温27℃-29℃,喂饲鱼食、酵母片1∶1混合物。

表1 白纹伊蚊 DENV来源的EVEs
1.2数据分析流程使用本地比对工具Blast 2.3.0,分别以4型登革病毒基因组全序列为待查序列。登革1型病毒(Dengue Type 1 virus, DENV-1)Singapore 8114/93株(GenBank No.AY762084)与WestPac(GenBank No.U88535);DENV-2 I348600株(GenBank No.AY702040)与ThD2_0017_98株(GenBank No.DQ181799);DENV-3 KJ71株(GenBank No.AY858044)与TB16株(GenBank No. AY858047);DENV-4 Singapore 8976/95株(GenBank No.AY762085)与ThD4_0476_97株(GenBank No.AY618988)与白纹伊蚊佛山株基因组(GenBank No.GCA_001444175)进行BlastN同源性比对。
1.3PCR检测与测序分别采集白纹伊蚊羽化后1 d雌、雄成蚊各8只样品,使用Insect DNA Kit昆虫组织DNA小量提取试剂(美国Omega Biotek公司)提取各样品总DNA。使用EmeraldAmp MAX PCR 预混试剂盒(大连 TaKaRa 公司),以各个样品基因组DNA为模版,根据各登革病源EVEs序列自行设计基因特异性引物行PCR反应,反应体系:基因组DNA 100 ng,上下游引物各20 pmol,EmeraldAmp MAX PCR Master Mix(2×Premix)25 μl,加去离子水至总体积50 μl。引物序列为,EVE-1F:5′-GGTGTACGAAACACCTACAGTG-3′,EVE-1R:5′-AGCTTGGGACAAGCGTAGAA-3′; EVE-2F: 5′-AACCAGTCAACATTGAGGCA-3′, EVE-2R:5′-GGTCTTCGTTCATGAAACCA-3′;EVE-3F: 5′-CCTCACTAAAGGGAGTTGT-3′,EVE-3R: 5′-TGTTCTTGTCGGTCCACGTA-3′;EVE-5F: 5′-CCAATCCCAATGGCGACCT-3′,EVE-5R: 5′-AATACGTCTTTCCCGGAGT-3′。白纹伊蚊核糖体蛋白基因Rps-7为内参照[4],PCR产物以1%琼脂糖凝胶电泳检测。阳性条带经凝琼脂糖凝胶回收试剂盒(北京 Tiangen公司)纯化后使用Mighty TA-cloning Kit(大连 TaKaRa 公司)亚克隆入pMD20-T载体后送华大基因进行测序分析。
2 结果
2.1登革病毒来源EVEs的比对以Blast N比对结果E-value<1e-10且Score>100为有意义,在白纹伊蚊佛山株基因组上共计找到5个与登革病毒高度同源性的EVEs片段(表1),其中EVE-1与DENV-2 P8-1407MS株序列相似度达到100%,该病毒株在1970年分离于马来西亚的猴类体内,与我国河南省新近分离的DENV-1核酸序列相似性也达到99%[5]。其他4处片段(EVE-2-5),与DENV-1 02-20株的序列相似度均达到99.7%以上。其中在基因组Scaffolds JXUM01S011899,从起始位置7 278到终止18 218,观察到了几乎完整的DENV-1(全长10 719 nt)的序列,包括编码区与非编码区。为了研究这些EVEs是否有转录,通过在线比对工具(www.vectorbase.org/blast)将它们与白纹伊蚊转录组又进行了相应的同源性比对与白纹伊蚊佛山株的转录组比对,结果没有发现比对有意义的转录组。
2.2基因组PCR为了验证这些EVEs是否存在于白纹伊蚊基因组,我们设计了基因特异性引物进行基因组PCR验证,设计原则为,上下游引物中一个引物位于病毒序列,一个引物位于病毒序列之外的接临基因组中,引物位置见图1A。由于EVE-3、EVE-4与EVE-5在基因组中位置相连,我们只设计了针对EVE-3和EVE-5相应的引物。为了验证这些EVEs序列是否普遍存在于种群中,还是存在个体差异,我们随机选取了非同一母系的子代个体雌雄各8只进行了RCR验证。结果证实,EVE-1在所有雌雄8个个体中均得到了阳性反应(图1B),产物回收后亚克隆入pMD20-T载体,经序列测定与预期结果一致。但是,对于EVE-2在所有雌雄8个个体中均未获得预期阳性条带(图1B)。EVE-3和EVE-5在蚊虫种群中分布有个体差异性,在部分个体中出现阳性条带(图1B),测序结果与预期序列一致。
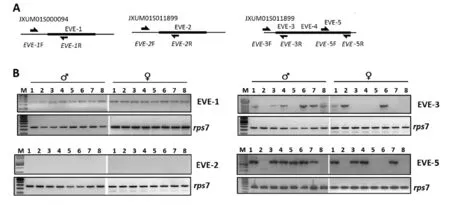
A:引物所在基因组位置;B: EVEs候选序列基因组PCR产物凝胶电泳图1 白纹伊蚊EVEs候选序列基因组PCRA: Location of primers in the Ae.albopictus genome; B: Agarose gel electrophoresis of PCR products of the EVEs candidatesFig.1 Analysis of EVEs in Ae.albopictus genome with genomic DNA PCR
3 讨论
白纹伊蚊不仅是一种攻击性很强的吸血蚊种,也是一种重要的传染病媒介,可作为20多种人类致病病毒的媒介,包括登革病毒、基孔肯雅病毒、黄热病毒、罗斯河病毒和西尼罗病毒等,也有作为寨卡病毒的媒介的潜在能力[6,7]。白纹伊蚊基因组大小约1 967 Mb,拥有目前基因组已知蚊种中最大的基因组,大约68%为重复序列组成[8],而真核生物的一些重复序列与EVEs有关,可能由于病毒与宿主的相互作用过程中整合入宿主的基因组形成。目前真核生物基因组中大多数EVEs位于非编码区,少部分可转录编码功能蛋白。EVEs的功能目前认为主要参与了宿主与病毒之间的免疫进程,对于非编码的EVEs,目前发现有些可能表达一些小RNA分子,例如piRNAs,从而参与与免疫相关的基因调控中[9,10]。我们的研究结果发现了白纹伊蚊基因组内存在登革病毒来源的EVEs,并通过相应的PCR方法证实了这些EVES并非来自基因组测序污染。但是结果也显示有些EVEs在种群内具有明显的个体差异性分布,这可能与这些EVEs在种群中的变异程度较高有关。这些EVEs是否通过某些途径参与登革病毒与媒介之间的相互作用有待我们进一步研究。
[1]Mager DL, Stoye JP. Mammalian Endogenous Retroviruses[J]. Microbiol Spectr, 2015, 3(1):MDNA3-0009-2014. doi:10.1128/microbiolspec.MDNA3-0009-2014.
[2]Ballinger MJ, Bruenn JA, Taylor DJ. Phylogeny, integration and expression of sigma virus-like genes in Drosophila[J]. Mol Phylogenet Evol, 2012,65(1):251-258. doi: 10.1016/j.ympev.2012.06.008.
[3]Chabannes M, Iskra-Caruana ML. Endogenous pararetroviruses-a reservoir of virus infection in plants[J]. Curr Opin Virol, 2013,3(6):615-620. doi: 10.1016/j.coviro.2013.08.012.
[4]Liu P, Li X, Gu J, et al. Development of non-defective recombinant densovirus vectors for microRNA delivery in the invasive vector mosquito, Aedes albopictus[J]. Sci Rep, 2016, 6:20979. doi: 10.1038/srep20979.
[5]杜燕华, 张白帆, 李懿, 等.河南省登革热1型病毒的发现与全基因组序列分析[J].中华预防医学杂志, 2015,49(10):892-895. doi:10.3760/cma.j.issn.0253-9624.2015.10.011.
[6]Ngoagouni C, Kamgang B, Nakouné E, et al. Invasion of Aedes albopictus (Diptera: Culicidae) into central Africa: what consequences for emerging diseases [J]? Parasit Vectors, 2015,8:191. doi: 10.1186/s13071-015-0808-3.
[7]Chouin-Carneiro T, Vega-Rua A, Vazeille M. Differential Susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika Virus[J]. PLoS Negl Trop Dis, 2016,10(3):e0004543. doi:10.1371/journal.pntd.0004543.
[8]Chen XG, Jiang X, Gu J, et al. Genome sequence of the Asian Tiger mosquito, Aedes albopictus, reveals insights into its biology, genetics, and evolution[J]. Proc Natl Acad Sci USA, 2015,112(44):E5907-5915. doi: 10.1073/pnas.1516410112.[9]Feschotte C, Gilbert C. Endogenous viruses: insights into viral evolution and impact on host biology[J]. Nat Rev Genet, 2012,13(4):283-296. doi: 10.1038/nrg3199.
[10]赖植发, 王衍海, 顾金保, 等. 白纹伊蚊感染登革病毒后病毒特异性piRNAs分析[J]. 中华实验和临床病毒学杂志,2014,28(4): 277-279. doi: 10.3760/cma.j.issn.1003-9279.2014.04.012.
Analysis of endogenous viral elements derived from dengue virus inAedesalbopictusgenome
WangYanhai,GuJinbao
StateKeyLaboratoryforInfectiousDiseasesControlandPrevention,NationalInstituteforViralDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing100052,China(WangYH);SchoolofPublicHealth,SouthernMedicalUniversity,Guangzhou510515,China(GuJB)
Gujinbao,Email:gujinbao@fmmu.corn
ObjectiveToidentifyandanalyzedenguevirus-derivedendogenousviralelements(EVEs)inAedes albopictus (Foshanstrain).MethodsThefullsequencesoffourserotypesofdenguevirus(DENV1-4)wereusedasqueries,andBlastNprogramwasusedtoscanthegenomeofAe.albopictus.ThecandidatesofEVEswereconfirmedbyPCRmethodusingspecificprimerswithgenomicDNAastemplatefrom8individualsoffemaleandmaleadult,respectivly.ResultsTotal5EVEscandidatesdisplayedthehighgeneticsimilaritywithDENVgenomesequences.Amongthem,EVE-1showed100%geneticsimilaritywithDENV-2P8-1407MSstrain,whereasEVE-2-5showedmorethan99%geneticsimilaritywithDENV-1 02-20strain.GenomicDNAPCRresultsindicatedthatEVE-1exhibitsequenceconservationacrossindividualsamongpopulation,whereastheEVE-3-5displayedthegenomicsequencevariationinindividuals.ConclusionsDenguevirus-derivedEVEswereindentifiedinAe.albopictus,thatmayprovidenewinsightintotheinteractionbetweenDENVandtheirvectors.
Denguevirus;Aedes;Endogenousviralelements
顾金保, Email:gujinbao@fimmu.com
10.3760/cma.j.issn.1003-9279.2016.04.001
国家自然科学基金(81371846);珠江科技新星(2014J2200032)
2016-04-06))
