利用冷冻保藏菌种测定食品中的水溶性维生素
2016-09-26李全霞崔亚娟陈兆天张绩觅徐佳佳刘玉峰
李全霞,崔亚娟,2*,陈兆天,张绩觅,徐佳佳,刘玉峰
1(北京市营养源研究所 分析检测中心,北京,100069) 2(中国农业大学农学与生物技术学院,北京,100193)
利用冷冻保藏菌种测定食品中的水溶性维生素
李全霞1,崔亚娟1,2*,陈兆天1,张绩觅1,徐佳佳1,刘玉峰1
1(北京市营养源研究所 分析检测中心,北京,100069)2(中国农业大学农学与生物技术学院,北京,100193)
建立了一种简单的甘油保护的冷冻保藏菌种的制备方法,通过测定冷冻菌种的活菌数和标准曲线,研究冷冻菌种的稳定性和重复性。结果显示,-20 ℃下保藏8个月时,冷冻菌种保藏液中的活菌数仍达到107CFU/mL以上,利用冷冻菌种测定烟酸、泛酸、叶酸和生物素的标准曲线与传统方法的标准曲线高度一致,利用冷冻保藏的菌种和新鲜菌种同时进行6种样品的分析,结果没有显著差异。冷冻菌种表现稳定,使用方便,快捷,适合作为菌种来源。
微生物法;烟酸;泛酸;叶酸;生物素
维生素是生物体内具有生理活性的物质,是一种食物或者膳食营养价值的真实反映。食物中某些维生素的生物活性可以作为食物营养价值评价标准的一部分。测定生物活性的最直接手段就是利用基于生理功能的生物分析方法。这也是维生素被发现的原因,至今我们也还在利用此方法去估量其他具有潜在治疗益处的维生素类似物[1]。随着仪器分析方法的迅猛发展,一些新的测定维生素的方法不断涌现,如高效液相-柱后衍生荧光法、液相色谱-质谱联用、超高效液相色谱-串联质谱法等[2-5]。微生物分析维生素方法因为其高的灵敏度和可靠性,测定结果可涵盖食物中添加和天然两种类型,从1940年代一直沿用至今。
由于微生物对维生素的特异活性,微生物法很长时间被喻为“黄金标准”方法,所有的B族维生素都能够利用微生物法进行测定[6]。所使用的分析菌种都来自于美国典型培养物培养中心(American Type Culture Collection,ATCC)。目前,国标方法中除了维生素B6使用酵母菌检测外,其他测定方法所使用的菌种都属于乳酸杆菌。
水溶性维生素一般是作为辅酶或辅基参与到机体的基础代谢反应中,是生物体生长必需的营养素。自然界中某些细菌或真菌也需要维生素维持生长,但本身并不能合成维生素,属于营养缺陷型的菌株,采用微生物分析维生素的原理就来源于此。在使用微生物进行测定过程中,保持营养缺陷型菌株的代谢活性对维生素的定量至关重要。传统的连续传代保存方法容易引入基因突变或者杂菌,培养基的理化性质及微生物代谢产物等原因还会导致微生物性状发生改变[7]。因此应该与其他能够长期保存菌株的方法相结合防止菌种衰退。1980年,GROSSOWLCZ等首先利用甘油保护的菌种进行血液中叶酸分析[8]。1982年,Willon和Horne对冷冻菌种的制备方法进行了改良,将其用于大鼠组织部分中叶酸的测定分析[9]。2005年,美国分析化学家协会(Association of Official Analytical Chemists,AOAC)将冷冻菌种写入官方分析方法2004.05中,用于谷物中叶酸的测定[10]。2007年,BUI和SMALL利用冷冻菌种测定面条中的叶酸[11]。2010年,Ortiz-Escobar等参照Grossowlcz的制备方法重新改良用来测定墨西哥仙人掌颈中的叶酸[12]。2011年,徐文婕等将甘油冷冻保存乳酸杆菌与96孔酶标相结合检测血浆叶酸[13]。笔者参照WILLON和HORNE的菌种制备方法,结合实验室现有的条件,建立了制备测定烟酸、泛酸、叶酸和生物素的冷冻保藏菌种方法,并应用于日常的检测分析中。经过8个多月的对比分析,该冷冻菌种表现稳定,使用方便,快捷。
1 材料与方法
1.1材料与试剂
菌种:植物乳杆菌(Lactobacillusplantarum)ATCC 8014,鼠李糖乳杆菌(Lactobacillusrhamnosus)ATCC 7469。
乳酸杆菌肉汤培养基,北京陆桥技术有限责任公司;烟酸测定培养基、泛酸测定培养基、生物素测定培养基、叶酸测定培养基,美国Difco公司。鸡胰酶,上海物竞化工公司;淀粉酶,美国Sigma公司;蛋白酶,国药集团化学试剂有限公司;烟酸(≥99.9%)、泛酸钙(≥99.9%)、生物素(≥98.0%)、叶酸(≥98.0%),美国Sigma公司;抗坏血酸、甘油、氢氧化钠、硫酸、乙醇,分析纯。
1.2仪器与设备
BPMJ-250F恒温培养箱;日立U-3900H紫外分光光度计;TOMY SX-700高压蒸汽灭菌锅;NU-425-400E生物安全柜;Sartorius千分之一和万分之一电子天平;BCD-235新飞冰箱;BCD-130HTB海尔超低温保存箱。
1.3方法
1.3.1标准溶液的配制
1)烟酸标准储备溶液的配制:准确称取20.0 mg烟酸,用25%乙醇溶液溶解并定容至100 mL[14]。
2)泛酸标准储备溶液的配制:准确称取21.25 mg泛酸钙标准品,溶于50 mL蒸馏水中,加入1 mL 0.2 mol/L乙酸,10 mL 0.2 mol/L醋酸钠,然后用蒸馏水定容至100 mL加3滴甲苯,于4 ℃冰箱保存[15]。
3)生物素标准储备溶液的配制:准确称取20.0 mg生物素50%乙醇溶液溶解并定容至100 mL[16]。
4)叶酸标准储备溶液的配制:准确称取20.0 mg叶酸,用0.01 mol/L氢氧化钠乙醇(1∶4)溶液溶解并定容至100 mL[17]。
1.3.2培养基的配制
1)乳酸杆菌肉汤培养基:按照培养基说明进行配制。
2)乳酸杆菌琼脂培养基:按照乳酸杆菌肉汤培养基说明进行配制,加入1%琼脂。
3)测定用培养基:按照培养基说明配制。
4)冷冻保藏菌种培养液:测定培养基中加入相应含量的维生素工作溶液,使得相应的培养液中维生素浓度分别为烟酸、泛酸20 ng/mL叶酸、生物素0.2 ng/mL。
1.3.3甘油溶液的配制
取甘油80 mL加入20 mL蒸馏水,混匀,121℃灭菌30 min。
1.3.4菌种的活化
将纯菌种植物乳杆菌和干酪乳杆菌穿刺接种于柱状乳酸杆菌琼脂培养基中,在36℃±1℃培养19~22 h。培养好的乳酸杆菌琼脂培养基试管的培养物作为储备菌种。
1.3.5冷冻保藏菌种的制备
接种1环储备菌种琼脂培养物于5 mL乳酸杆菌肉汤培养基中,在36℃±1℃培养19~22 h;取0.5 mL种子培养液接入50 mL冷冻保藏菌种培养液中,36 ℃±1 ℃培养19~22 h。立即取出放入冰浴中。在无菌环境中取1 mL培养液于灭菌的2 mL离心管中,加入1 mL 甘油,混匀,放入-20 ℃和-70 ℃冰箱保存。
1.3.6接种量试验
冷冻菌种保藏1个月内进行接种量的试验,分别按照0.25%,0.5%,1%,2%,4%,8%体积分数的接种量接种于空白试管和烟酸、泛酸20 ng/mL,叶酸、生物素0.2 ng/mL的试管中,在36℃±1℃培养19~24 h,测定吸光值,比较空白管和标准管的差异,判断最佳接种量。
1.3.7冷冻菌种中活菌的计数
每月取冷冻菌种溶液,稀释到合适梯度后利用乳酸杆菌琼脂培养基平板培养36 h,计数,计算每毫升菌液中的活菌落数。
1.3.8标准曲线的制备
取烟酸、泛酸标准储备液1.00 mL稀释至质量浓度为20 ng/mL,6支试管加2.50 mL测定用培养基,再加0~50 ng标准工作溶液,一式3份;取叶酸、生物素标准储备液1.00 mL稀释至质量浓度为0.2 ng/mL,6支试管加2.50 mL测定用培养基,再加0~0.5 ng标准工作溶液,一式3份。
以最佳接种量进行接种,在36℃±1℃培养19~24 h。培养后的标准管从恒温箱中取出后,用分光光度计于550 nm波长下,以标准管的零管调零,测定各管的吸光度值。以标准所含的维生素质量为横坐标,吸光度值为纵坐标,绘制标准工作曲线。
1.3.9样品测定及分析
样品处理和测定分析按照国家标准方法中规定的进行[14-20]。
1.4数据统计分析
利用SPSS19.0软件进行统计分析,当P<0.05为具有显著差异。
2 结果与分析
2.1最佳接种量
以未接种的空白试管为对照,测定各个接种量下的空白试管和标准试管的吸光值(见表1)。通过比较发现,随着接种量的增加,空白试管和标准试管的吸光值增加,但是在接种量小于1%时,这种变化没有显著差异,接种量高于1%时,空白试管的吸光值变大,因此0.25%,0.5%,1%的接种量最合适,为保险起见,选0.5%做为最佳接种量。

表1 不同接种量下烟酸、泛酸、叶酸、生物素空白管和标准管的吸光值
2.2冷冻时间对活菌数的影响
图1显示,随着冷冻时间的延长,活菌数不断减少,测定烟酸的冷冻菌种表现得最为明显,它在一开始急剧下降,2个月后稳定存在。-20 ℃冷冻保藏8个月后,植物乳杆菌和鼠李糖乳杆菌的活菌数仍能达到107CFU/mL以上,但明显的是,植物乳杆菌的活菌数从开始就比鼠李糖乳杆菌多。我们也同时做了测定烟酸冷冻菌种的-70 ℃和-20 ℃冻存的比较,8个月时,-70 ℃保存的冷冻菌种活菌数仍能达到9×108CFU/mL,而-20 ℃保存的冷冻菌种活菌数只剩下1.8×108CFU/mL。由于-70 ℃冰箱并不常用,有条件的实验室可以优先选择-70 ℃保存。
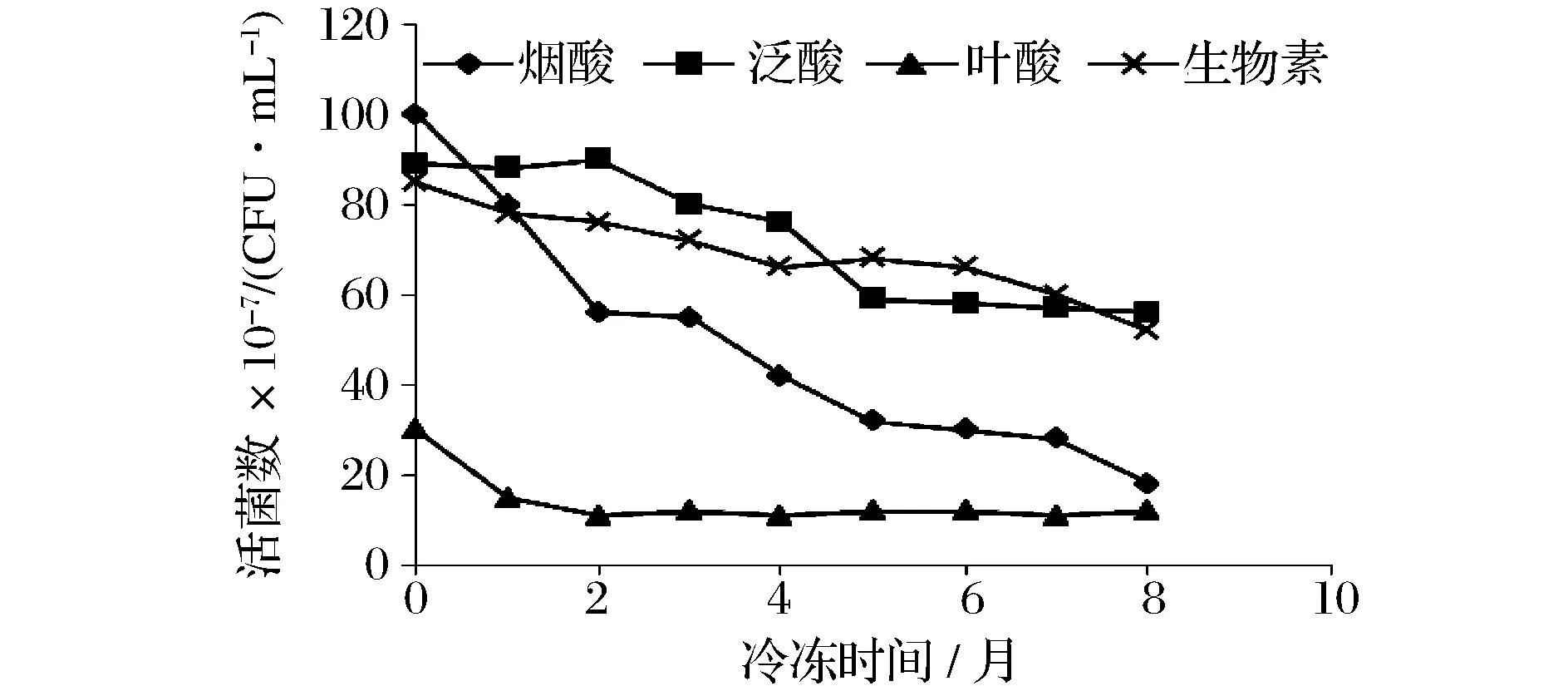
图1 冷冻菌种8个月内的活菌数变化Fig.1 Change of CFU incryopreserved cultures during eight months
2.3不同时间下冷冻菌种标准曲线的变化
利用同样的冷冻菌种,在8个月内进行了8次标准曲线测定分析(见图2)。结果显示,冷冻菌种对烟酸、泛酸、叶酸和生物素有高度的特异性与依赖性,随着标准浓度的增加,试管中的溶液浑浊度随之增加,但在高点时增加趋势减少。冷冻菌种具有和新鲜菌种同样的灵敏度。并且,在8个月内,冷冻菌种具有高的稳定性和重复性。
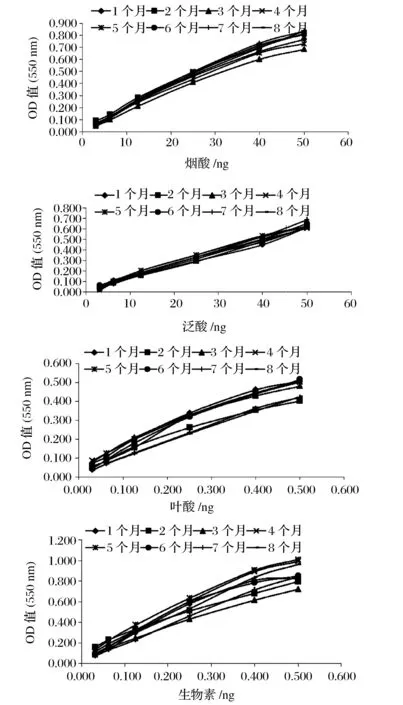
图2 利用冷冻菌种进行微生物法分析的标准曲线在8个月内的变化Fig.2 Change of standard curve for microbiological assay with cryopreserved cultures in eight months
2.4冷冻菌种和新鲜菌种标准曲线的对比
分别取冷冻菌种和新鲜菌种的8次标准曲线各标准点吸光值的平均值做成标准曲线,进行比较。新鲜菌种与冷冻菌种的标准曲线有很高的相似性,二者泛酸的标准曲线是重叠的,烟酸和生物素的标准曲线也高度一致,叶酸的标准曲线在高点时,冷冻菌种的生长稍有点低。
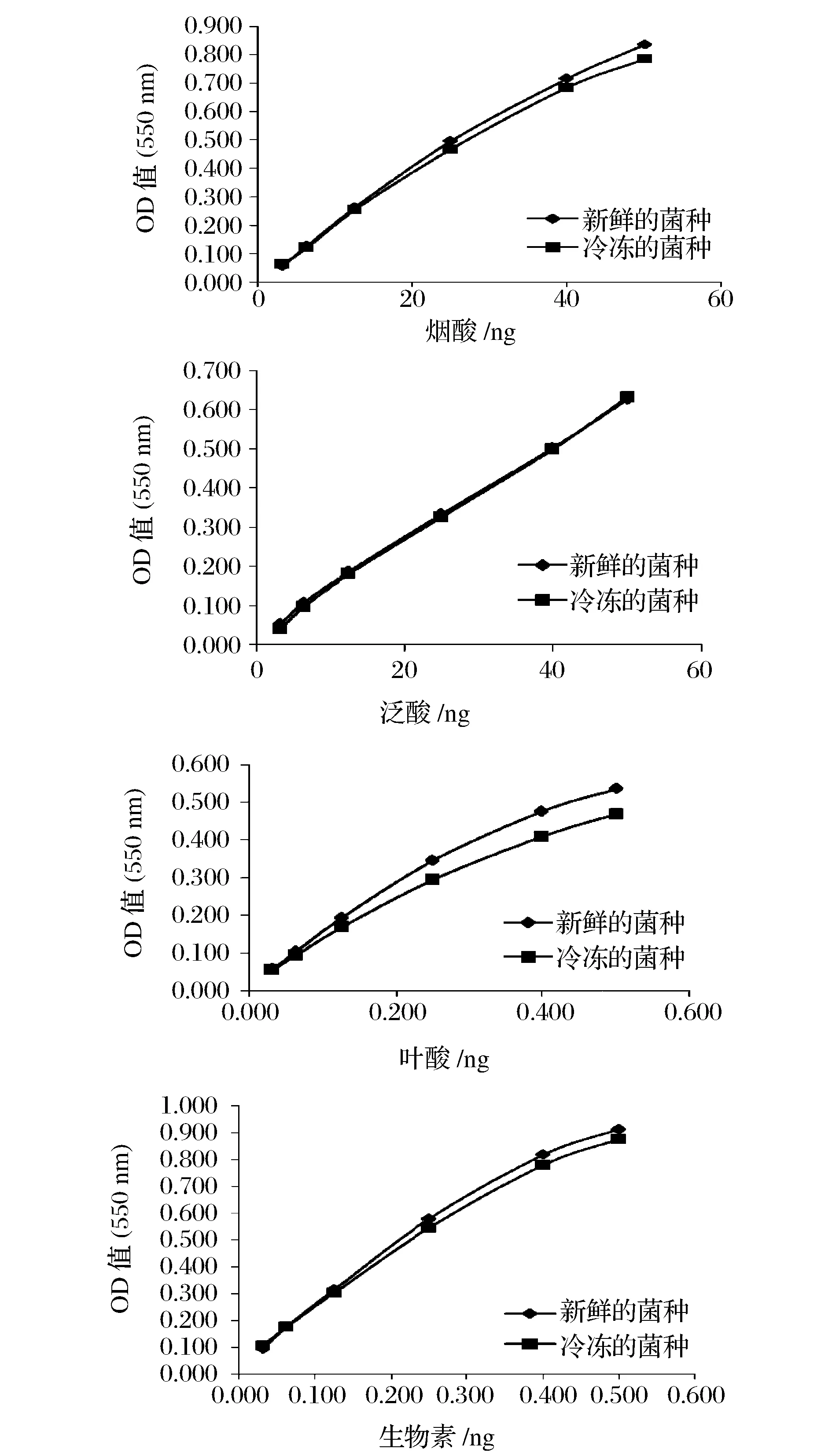
图3 冷冻菌种和新鲜菌种标准曲线的对比Fig.3 Comparison of standard curve with cryopreserved and fresh cultures
2.5样品测定结果
如表2所示,利用冷冻保藏的菌种和传代培养的新鲜菌种同时进行6种样品的分析,重复测定6次,实验数据用χ±s表示,t检验法检验,结果表明,采用两种方法测定的6种样品含量相一致,没有显著的差异(P>0.05)。
3 讨论
用同样的方法制备测定维生素B12的莱士曼氏乳杆菌的冷冻保藏培养液,但是发现冷冻后的活菌数很低,这种方法不适合于莱士曼氏乳杆菌。在GROSSOWLCZ和ORTIZ-ESCOBAR二者的方法中,冷冻菌种保藏液使用之前,要用生理盐水洗去其中残余的维生素。我们测定了保藏液中的维生素含量,发现已经完全消耗掉了,因此不必清洗,直接使用即可。
采用微生物分析法测定维生素至今已有60年左右的历史,因为它的成本低,可操作性强,灵敏度高,在我国现行的国家标准中依然用来测定婴幼儿食品和乳品中的生物素、泛酸、叶酸、维生素B12、烟酸以及食品中的维生素B6、维生素B12、烟酸、泛酸、叶酸。国标中规定的接种方式依然是传统的连续传代接种,测定周期一般是4~5 d,而直接低温保藏菌种在适宜的培养基中,使得菌种可以快速利用,大大节省测定周期,2~3 d就可以得到结果。由于冷冻保护的菌种在-20 ℃可以稳定至少8个月以上,这样方便实验室进行统一的标准化分析,可以简化分析程序,不会因为菌种活力问题引起测定结果的差异性。冷冻保护的菌种制备技术简单,在短时间内能够制备丰富的菌种,可以利用8个月以上。最重要的是,一批冷冻菌种的生长曲线在8个月内比较稳定,而新鲜菌种在转接过程中可能会出现未知的一些问题,导致标准曲线不稳定。
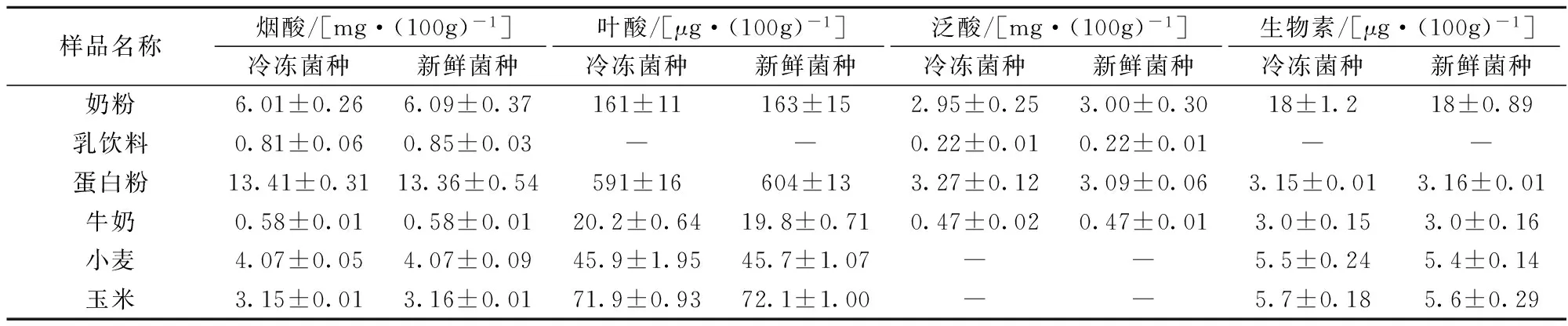
表2 利用冷冻菌种和新鲜菌种测定样品的结果
[1]GEORGE F M.Ball:Vitamins in Food Analusis,Bioavailability,and Stability [M].New York:Taylor & Francis Group,2006:311-312.
[2]PAKIN C,BERGAENTZLE M,HUBSCHER V.Fluorimetric determination of pantothenic acid in foods liquid chromatography with post-column derivatization[J].Journal of Chromatography A,2004,1 035(1):87-95.
[3]刘莉治,罗晓燕,周洪伟.高效液相柱后衍生法测定婴幼儿食品中的叶酸[J].中国卫生检验杂志,2007,17(7):1 179-1 180.
[4]KATHERINE M P,DAVID M R,DAVID B H.Folate composition of 10 types of mushrooms determined by liquid chromatography-mass spectrometry[J].Food Chemistry,2011,129(2):630-636.
[5]JIA Liu,RUSSELL P, ALAN P M.Quantitative analysis of tissue folate using ultra high-performance liquid chromatography tandem mass spectrometry[J].Analytical Biochemistry,2011,411(2):210-217.
[6]CHRISTOPHER J B.Analytical procedures for water-soluble vitamins in foods and dietary supplements: a review[J].Anal Bioanal Chem,2007,389(1):63-76.
[7]吕线红,郭利美.工业微生物菌种的保藏方法[J].山东轻工业学院学报,2007,21(1):52-55.
[8]GROSSOWLCZ N,WAXMAN S,Sehreiber C.CryoprotetedLactobacilluscasei:an approach to standardization of microbiological assay of folic acid in sorum[J].Clin Chem,1981,27(5):745-747.
[9]WILSON S D,HOME D W.Use of glycerol: cryoprotectedLactobacilluscaseifor microbiological assay of folic acid[J].Clin Chem,1982,28(5):1 198-1 200.
[10]AOAC International AOAC Official Method 2004.05. Total folates in cereals and cereal foods. Microbiological assays Trienzyme procedure[J]. Official Methods of Analysis of AOAC,International;AOAC International: Arlington,VA, 2005.
[11]BULL T T,SMALL D M.Folates in asian noodles: I. microbiological analysis and the use of enzyme treatments[J].Journal of Food Science,2007,72(5):276-281.
[12]ORTIZ-ESCOBAR T B,VALVERDE-GONZA Lez M E,PAREDES-LOPEZ O.Determination of the folate content in cladodes of nopal(Opuntiaficusindica) by microbiological assay utilizingLactobacilluscasei(ATCC 7469) and enzyme-linked immunosorbent assay[J].J Agric Food Chem,2010,58(10):6 472-6 475.
[13]徐文婕,曲全冈,刘建蒙.微生物法检测血浆叶酸实验方法评价及应用[J].中国卫生检验杂志,2011,21(7):1 722-1 724.
[14]中国国家标准化管理委员会. GB/T 5009.89—2003食品中烟酸的测定[S].北京:中国标准出版社,2003.
[15]中国国家标准化管理委员会.GB/T 5009.210—2008食品中泛酸的测定[S].北京:中国标准出版社,2003.
[16]中华人民共和国卫生部.GB 5413.19—2010婴幼儿食品和乳品中游离生物素的测定[S].北京:中国标准出版社,2010.
[17]中国国家标准化管理委员会. GB/T 5009.211—2008食品中叶酸的测定[S].北京:中国标准出版社,2003.
[18]中华人民共和国卫生部.GB 5413.15—2010 婴幼儿食品和乳品中烟酸和烟酰胺的测定[S].北京:中国标准出版社,2010.
[19]中华人民共和国卫生部.GB 5413.16—2010 婴幼儿食品和乳品中叶酸(叶酸盐活性)的测定[S].北京:中国标准出版社,2010.
[20]中华人民共和国卫生部.GB 5413.17—2010 婴幼儿食品和乳品中泛酸的测定[S].北京:中国标准出版社,2010.
Use of cryopreserved cultures for microbiological assay of soluble-vitamins in food
LI Quan-xia1,CUI Ya-juan1,2*,CHEN Zhao-tian1,ZHANG Ji-mi1,XU Jia-jia1,LIU Yu-feng1
1(Analysis Laboratory of Beijing Nutrition Resources Institute, Beijing 100069, China) 2(College of Agriculture and Biotechnology of China Agriculture University,Beijing 100193,China)
A simple procedure for preparing glycerol-cryopreserved cultures has been developed. The stability and repeatability of cryopreserved cultures have been studied by measuring the standard curve and colony-forming units. The results revealed that there were more than 107CFU/mL in cryopreserved cultures stored at -20℃ for 8 months. Standard curves of nicotinic acid, pantothenic acid, folic acid and biotin determined using cryopreserved cultures were highly consistent with those from traditional method. There were no significant differences among the results of six samples that determined with cryopreserved and fresh cultures at the same time. Cryopreserved cultures were stable, convenient, fast, and suitable ready source of inoculum.
microbiological method;nicotinic acid;pantothenic acid;folic acid;biotin
10.13995/j.cnki.11-1802/ts.201601011
硕士、助理研究员(崔亚娟副研究员为通讯作者,E-mail:cuiyj66@163.com)。
北京市科技计划项目(Z141100002614013)
2015-03-02,改回日期:2015-06-10
