糙枝金丝桃药材质量标准的研究△
2016-09-25郭炬亮倪国柱朱丹丹热娜卡斯木
郭炬亮,倪国柱,朱丹丹,热娜·卡斯木
(新疆医科大学 药学院,新疆 乌鲁木齐 830054)
·基础研究·
糙枝金丝桃药材质量标准的研究△
郭炬亮,倪国柱,朱丹丹,热娜·卡斯木*
(新疆医科大学 药学院,新疆 乌鲁木齐 830054)
目的:建立糙枝金丝桃药材质量标准,为该药的开发利用提供科学依据。方法:进行生药学研究,测定水分、灰分,薄层色谱鉴别,HPLC测定金丝桃苷的含量。结果:对糙枝金丝桃药材的性状、显微特征进行描述;供试品TLC色谱可显出金丝桃苷和芦丁的斑点,金丝桃苷的平均含量为0.424%。结论:实验结果可作为糙枝金丝桃药材的质量控制标准。
糙枝金丝桃;显微鉴别;薄层色谱;金丝桃苷;HPLC
糙枝金丝桃HypericumscabrumL.是藤黄科(Guttiferae)金丝桃属(HypericumL.)植物,又名腺点金丝桃[1],多年生草本或半灌木,全草入药,为哈萨克族习用药材;生于海拔1100 m左右的干旱多石山坡或砾质坡地上,国内仅分布于新疆阿尔泰;前苏联及中亚地区也有分布。糙枝金丝桃性辛、凉,具有清热解毒、消肿散瘀、收敛止血等功效,用于风湿性腰痛、疖肿、肝炎、蛇咬伤等[2]。其主要化学成分有二蒽酮类的金丝桃素(Hypericin) 和伪金丝桃素(Pseudo hypericin)、黄酮类的金丝桃苷(Hyperin)和芦丁(Rutin)、间苯三酚类化合物hyperibone A~I、挥发油α-蒎烯(α-pinene)等[3-4]等。仅收载于《哈萨克药志》(第一卷),只对其来源、性状及功能主治等进行了简要描述,没有具体的质量标准,目前亦未见文献报道。本实验对糙枝金丝桃药材的性状、显微特征进行了分析,并建立了其指标性成分金丝桃苷的薄层鉴别及HPLC含量测定的方法[5-10],为建立糙枝金丝桃药材质量标准提供科学依据。
1 仪器与材料
1.1 仪器
高效液相色谱仪(日本岛津,LC-20AB泵,SPD-20A紫外双波长检测器,Lcsolution色谱工作站);LINOMAT5半自动点样仪(CAMAG),REPROSTAR 3薄层色谱数码成像系统(CAMAG),AG135 TOLEDO分析天平(METTLER d=0.1 mg)、SK2510HP超声仪(上海科马)、DMEX30生物显微镜(宁波舜宇 )。
1.2 材料
金丝桃苷(中国食品药品检定研究院,批号:111521-200303);芦丁对照品(上海原生生物科技有限公司,批号:20120226),糙枝金丝桃药材共10批,收集于新疆,由新疆医科大学药学院帕丽达·阿不力孜教授鉴定为藤黄科植物糙枝金丝桃HypericumscabrumL.。
2 方法与结果
2.1 性状鉴别
本品茎呈圆柱形,长20~40 cm,多分支,茎及分枝两侧各有一条纵棱,叶无柄或近无柄,披针形或长圆状线形,全面散布单色腺点。茎上的叶卵状长圆形或长圆形,长1.3~1.7 cm,宽0.3~0.5 cm。稠密的伞房花序,花黄色,花瓣、花萼各5片,卵状长圆形。气微,味微苦、涩。
2.2 显微结构
2.2.1 茎横切面 木栓层为数列细胞,栓内层窄;韧皮部细胞排列紧密;木质部射线宽广;导管单个散在或数个聚集,1~2列径向排列成放射状。见图1。
2.2.2 粉末显微鉴别 粉末为淡绿色或黄绿色[11],具单细胞非腺毛,壁厚,长191.80~460.46 μm,直径14.80~40.15 μm。纤维多单个散在,壁厚,胞腔狭窄,长32.51~396.68 μm,直径7.76~34.64 μm。油细胞为棕黄色,多聚集,直径36.94~245.33 μm。螺纹导管长45.06~211.09 μm,直径10.21~52.31 μm。花粉粒多单个存在,直径31.20~48.16 μm。粉末气孔多为单个,副卫细胞破损。叶表皮观察发现气孔多为不定式,副卫细胞多有3个,少有4个。见图2。

注:1.叶表皮(气孔);2.螺纹导管;3.具缘纹孔导管;4.油室;5.纤维;6.花粉粒;7.花丝表皮细胞;8.木薄壁细胞。图2 糙枝金丝桃药材粉末显微结构
2.3 薄层色谱鉴别
称取药材1 g置于圆底烧瓶,加甲醇100 mL,超声回流10 min(20 ℃、50 Hz)提取,过滤后,滤液旋转蒸发浓缩至1~2 mL,转移至蒸发皿中,于水浴锅上蒸干(40 ℃),晾干后加甲醇10 mL溶解即得甲醇供试液。分别精密称取金丝桃苷对照品、芦丁对照品各适量,加甲醇溶解并定容,制成0.5 mg·mL-1的混合对照品溶液。分别吸取3 μL甲醇供试品溶液、5 μL对照品溶液,点于同一张薄层板上[12],乙酸乙酯-丙酮-甲醇-水(5∶2∶0.5∶0.5)展开,取出,晾干,喷以5%AlCl3无水乙醇溶液显色剂,于紫外灯366 nm下检视,结果见图3。
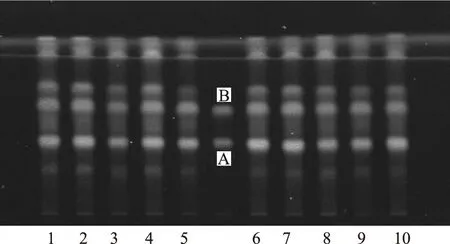
注:A.芦丁;B.金丝桃苷。图3 10批糙枝金丝桃药材中芦丁和金丝桃苷的薄层鉴别图
2.4 金丝桃苷的HPLC含量测定
2.4.1 对照品溶液的配制 精密称取金丝桃苷对照品约20 mg,置于10 mL容量瓶中,加甲醇溶解并定容,即得对照品储备液,其浓度为2.0 mg·mL-1,备用。
2.4.2 供试品溶液的制备 精密称定糙枝金丝桃药材0.2 g,粉碎,过60目筛,置锥形瓶中,精密加入10 mL 70%乙醇,称定重量,水浴中(95 ℃)回流30 min,取出,放冷,再称定重量,用乙醇补足减失的重量,摇匀,0.22 μm微孔滤膜过滤,取续滤液作为供试品溶液。
2.4.3 色谱条件与系统适应性 Sunfire C18色谱柱(250 mm×4.6 mm,5μm);流动相:乙腈-0.1%磷酸水溶液(15∶85)洗脱;流速:1.0 mL·min-1;柱温:35 ℃;检测波长:360 nm;进样量:10 μL。取上述对照品溶液和供试品溶液各10 μL,注入HPLC色谱仪,记录色谱图(见图4),结果表明在此色谱条件下[13-16],金丝桃苷对照品、糙枝金丝桃样品分离度都大于1.5,理论塔板数都大于4000,拖尾因子小于2.0。

注:A.供试品,B.金丝桃苷。图4 糙枝金丝桃药材和对照品的HPLC图
2.4.4 线性关系考察 精密吸取对照品贮备液适量,加甲醇稀释至刻度,摇匀,得到系列质量浓度的对照品溶液0.010 085、0.020 17、0.040 34、0.060 51、0.080 68、0.100 85 mg·mL-1,精密吸取上述6种溶液各10 μL,分别进样,以对照品质量浓度X(mg·mL-1)为横坐标,峰面积Y为纵坐标进行线性回归,得回归方程Y=20 871 000X+2 510.6(r=0.999 9)。实验结果表明金丝桃苷对照品溶液质量浓度在0.010 085~0.100 85 mg·mL-1线性关系良好。
2.4.5 精密度试验 取同一供试品溶液连续进样6次,测得金丝桃苷含量的日内RSD;再连续进样5 d,测得金丝桃苷含量的日间RSD。结果日内RSD=1.4%,日间RSD=1.5%。
2.4.6 稳定性试验 同一供试品溶液在0、2、4、6、8、12、24、48 h分别进样测定,结果48 h内金丝桃苷色谱峰面积无明显变化,RSD=1.6%,表明被测样品在48 h内稳定性良好。
2.4.7 重复性试验 取同一批样品0.2 g,6份,按供试品溶液的制备法制备并进样测定,糙枝金丝桃药材中金丝桃苷的平均含量为0.33%,RSD=1.5%。
2.4.8 加样回收率试验 精密称取已知含量的样品(批号:20120325)约0.3 g,共9份,分为3组,按低、中、高浓度分别加入金丝桃苷对照品储备液(2.017 mg·mL-1)0.1、0.15、0.2 mL,按2.4.2项下方法制备供试品溶液,进样测定,计算加样回收率,结果见表1。

表1 糙枝金丝桃药材中金丝桃苷加样回收率试验结果(n=9)
2.4.9 样品测定 取收集的10批不同产地的样品,每批样品取2份进行测定,按供试品溶液制备法进行样品处理并测定,结果见表2。

表2 10批糙枝金丝桃样品含量测定结果(n=2)
3 讨论
本实验中考察薄层鉴别时,分别以3种展开系统展开,①乙酸乙酯-甲酸-水(8∶1∶1),②乙酸乙酯-丁酮-甲醇-水(5∶5∶1∶1),③乙酸乙酯-丙酮-甲醇-水(5∶2∶0.5∶0.5)。结果表明以乙酸乙酯-丙酮-甲醇-水(5∶2∶0.5∶0.5)为展开系统,金丝丝桃苷、芦丁斑点清晰,分离效果较好。
综上所述,通过对糙枝金丝桃药材性状、显微、薄层色谱和指标性成分的定性和定量分析,能较好地控制药材的质量。建议糙枝金丝桃药材各项指标可控制在如下范围内:薄层层析应检出金丝桃苷和芦丁;本品按干燥品计算,含金丝桃苷(C21H20O12)量不低于0.10%。
[1] 中国科学院中国植物志编委会.中国植物志:第50卷.第2册[M].北京:科学出版社,1990:2-72.
[2] 徐新,巴哈尔古丽·黄尔汗.哈萨克药志:第一卷[M].北京:民族出版社,2009:57-59.
[3] Baser K H,Ozek T,Nuriddinov H R,et al.Essential oils of two Hypericum species from Uzbekistan[J].Chemistry of Natural Compounds,2002,38 (2):54-57.
[4] Morteza S K,Saeedi M,Changizi S.The essential oil composition ofHypericumscabrumL.from Iran[J].Flavour Fragr J,2006,21(2):513-515.
[5] 莫玉兰,韦东玲,覃琳,等.金丝桃苷药理研究概况[J].内科,2007,2(4):651-654.
[6] 陈红艳,王建华,杨新波,等.金丝桃苷对大鼠脑缺血再灌注氧化应激损伤的影响[J].解放军药学学报,2007,23(2):88-92.
[7] BAUREITHEL K H,BUTER K B,ENGESSER A,et al.Inhibition of benzodiazep ine bindinginvitroby amentoflavone,a constituent of various species of Hypricum[J].Pharm Acta Helv,1997,72 (3):153-157.
[8] 周宏超,范光丽,穆祥,等.金丝桃苷对SLT2IIe诱导大鼠肠黏膜微血管内皮细胞分泌PGI2、TXA2及PAF的影响[J].西北农林科技大学学报,2007,35 (4):6-11.
[9] LEE S H,JUNG S H,LEE Y S.Antiinflammatory activity of hyperin from Acanthopanax chiisanensis roots[J].A rch Pharm acal Res,2004,27 (6):628-632.
[10] KIM D W,YOKOZAWA T,HATTOR I M,et al.Inhibition effects ofan aqueous extract of Apocynum venetum leaves and its constituentson Cu2+induced oxidative modification of low density lipop rotein[J].Phytother Res,2000,14 (7):501-504.
[11] 刘勇民.维吾尔药志(下)[M].乌鲁木齐:新疆科技卫生出版社,1999:454-458
[12] 国家药典委员会.中华人民共和国药典:四部[S].北京:中国医药科技出版社,2015:57-61.
[13] 黄慈英,王继良,黄敏洁,等.HPLC法同时测定夏枯草中芦丁、金丝桃苷、槲皮素和山柰酚[J].中成药,2012,34(3):520-523.
[14] 丁姗姗,吕凌,张毅,等.HPLC法同时测定宣木瓜中绿原酸、芦丁、金丝桃苷、槲皮素的含量[J].安徽医药,2012,16(4):450-452.
[15] 石芸,池玉梅,谈献和,等.黄蜀葵花HPLC法指纹图谱及金丝桃苷、槲皮素含量测定研究[J].西北药学杂志,2011,26(6):399-402.
[16] 郑清明,秦路平,郑汉成,等.金丝桃属植物的HPLC指纹谱研究[J].中草药,2003,34(4):365-369.
StudyonQualitySpecificationofHypericumscabrumL.
GUOJuliang,NIGuozhu,ZUDandan,RENAKasimu*
(PharmacyCollegeofXinjiangMedicalUniversity,Urumqi830054,China)
Objective:To provide scientific basis for the utilization and development ofHypericumscabrumL.by setting up the quality specification ofH.scabrum.Methods:The pharmacognositical methods were applied.Moisture and ash were determined,and the constituents were analyzed by thin layer chromatography (TLC).The content of hyperin was determined by HPLC.Results:The morphological,histological characters ofH.scabrumwere observed.The developed TLC spots were quite clear.And spots obtained with the given samples all corresponded in position and color to the spot obtained with the reference hyperin and rutin in the chromatogram.The average content of hyperin was 0.424%.Conclusion:All these data mentioned above can be used as the standards for evaluating quality ofH.scabrum.
HypericumscabrumL.;microscopical identification;TLC;hyperin;HPLC
10.13313/j.issn.1673-4890.2016.11.017
2016-01-15)
新疆维吾尔自治区科技重大专项(201130105-2)
*
热娜·卡斯木,博士,教授,研究方向:天然药物化学;E-mail:renakasimu@vip.sina.com
