药用蜈蚣生物活性物质与毒性物质研究进展
2016-09-25于金高刘培段金廒
于金高,刘培,段金廒
(南京中医药大学 江苏省方剂高技术研究重点实验室/江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏 南京 210023)
·综述·
药用蜈蚣生物活性物质与毒性物质研究进展
于金高,刘培,段金廒*
(南京中医药大学 江苏省方剂高技术研究重点实验室/江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏 南京 210023)
中药蜈蚣以其显著的生物活性以及含有的蛋白质、多肽、多糖类功能物质成为研究者关注的热点,其中多肽类物质既存在于蜈蚣毒液中,又可由虫体蛋白质经降解而产生,这些多肽结构式样新颖,生物活性丰富。本文对蜈蚣类药用生物资源类群及其重要的资源性化学物质多肽的分离纯化、结构分析、生物活性及其多肽结构与生物活性之间的相关性研究进行文献梳理和知识挖掘,提出了该类中药资源未来研究的重点和资源深度开发的发展方向,以期为相关领域的学者、企业家等客观认识蜈蚣的资源价值和产业化前景提供借鉴,也为中医临床对蜈蚣药材的致毒物质基础、不同加工方式、用法以及不同疾病状态下合理、安全使用该类药材提供参考。
蜈蚣;动物药资源;生物活性物质;毒性物质;用药安全
蜈蚣始载于《神农本草经》,距今已沿用2000多年,性温,味辛,归肝经。具有熄风镇痉、通络止痛、攻毒散结的功能。临床上蜈蚣的适应症广泛,常用于治疗各种疑难杂症。
现代临床上蜈蚣的主要作用和适应症有:1)抗凝、抗血栓,用于中风、偏瘫以及各种血液系统凝血功能异常的预防和治疗;2)抗惊厥,治疗癫痫、惊厥、抽搐等[1];3)镇痛,临床上可用于治疗神经性头痛、偏头痛以及坐骨神经痛[2];4)抗肿瘤,可与其他药物配伍治疗胃癌、食管癌、结肠癌、肝癌、肺癌、宫颈癌、乳腺癌等[3-5];5)糖尿病及并发症,治疗糖尿病并发高血压、冠心病、脑血管病变、周围神经病变及视网膜病变[6];6)降压,临床上可用于治疗原发性高血压[7-8];7)其他,如风湿性关节炎、间质性肺炎、风疹、皮肤真菌感染、结核病、带状疱疹以及毒蛇咬伤等。这些作用主要集中在神经系统、血液循环系统、免疫系统,随着研究的深入,蜈蚣的其他作用也逐渐被发现[9-10]。
分布于我国境内的蜈蚣科动物共有3个属20种,见表1[11]。目前国内主要的药材来源为少棘蜈蚣(金头蜈蚣)ScolopendrasubspinipesmutilansL.Koch,占国内市场的95%,并且在我国分布最广泛。陕西、河南、湖北、四川、江苏、安徽、浙江均有分布,以湖北、浙江产量最多。湖北、山东、浙江等地已实现人工养殖。少棘蜈蚣作为药用来源是根据历代本草记载和实地调查逐步确定的[12]。其他作为地方药用的蜈蚣品种还有广西的多棘蜈蚣S.multidensNewport、云南的墨江蜈蚣S.mojiangicaZhang et Chi、黑头蜈蚣S.negrocapitisZhang et Wang[13],此外还有模棘蜈蚣S.subspinipesLeach、哈氏蜈蚣S.dehaaniBrant、马氏蜈蚣S.mazbiiGravely等[14],这些品种均来自于蜈蚣属。
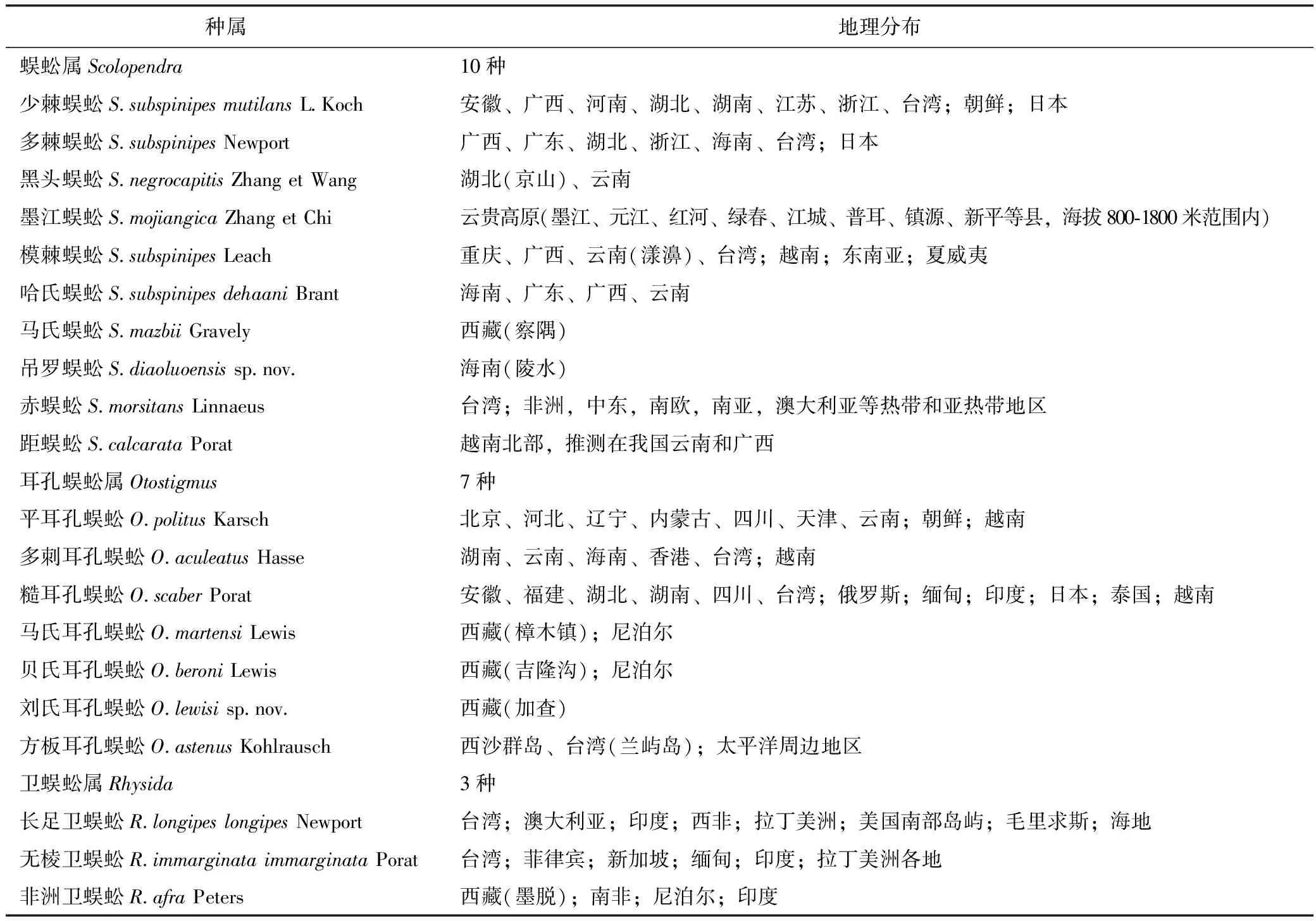
表1 我国蜈蚣科药用动物种类及分布概况
1 与治疗疾病相关的活性物质基础
根据目前的研究成果,蜈蚣活体及药材中的活性物质绝大部分为蛋白多肽类,少数为小分子环肽或多糖类,这些活性物质根据活性可分为6个方面。
1.1 抗凝、抗血栓的物质基础
临床上蜈蚣的活血化瘀作用表现最为明显,其活性物质主要为生物大分子,其中比较确切的成分包括:1)蛋白酶类,蜈蚣纤溶酶(SSFE)由新鲜少棘蜈蚣活体中分离,较低剂量下对小鼠的体内外凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血酶时间(APTT)均有延长作用。SSFE不会导致溶血,不但能溶解血栓,还能抑制动脉血栓形成,6 mg·kg-1皮下注射时抑制率达到65.8%。SSFE有可能开发成比尿激酶更有效,比肝素更安全的抗血栓、抗凝药物[15]。丝氨酸蛋白酶Scolonase具有人类纤溶酶原激活功能,可将纤溶酶Arg561和Val562之间的肽键裂解,使之转化成纤溶酶,进而发挥溶解血栓的作用[16];2)多肽类,少棘蜈蚣药材中的抗凝物质主要是多肽类,特别是经过蛋白酶处理得到的肽抗凝作用较强,其分子量850~5300 Da[17],且药材经不同的酶解工艺处理后,活血作用也各不相同。其中仿生酶提取法在凝血酶原时间、纤溶活性、大鼠凝血时间、静脉血栓重量等4方面均显著优于单独的胃蛋白酶、胰蛋白酶提取、水煎煮、冷浸等方法[18];3)寡肽类,少棘蜈蚣药材粉末中可提取抗血栓三肽(Ser-Gln-Leu,SQL),其作用特点为延长APTT,而对PT无影响,表明它作用于凝血因子。另外SQL还和其他抗血栓三肽一样,能够抑制血小板聚集,其机制尚未明确[19]。少棘蜈蚣毒液中的五肽(Thr-Asn-Gly-Tyr-Thr)可剂量依赖性地抑制抗凝因子FXa。分子对接表明,该寡肽能够结合FXa分子部分残基,抑制Fxa的功能,但效价较低。然而该寡肽体内抗凝活性是体外的8倍,表明体内存在其他活性位点[20]。
另据报道,少棘蜈蚣药材碱性溶液提取物(CAP)可通过降低动脉粥样硬化大鼠血脂水平,改善血液粘稠度,从而间接改善凝血功能异常状态[21]。CAP对心肌具有保护作用,能够抑制心肌纤维化,减轻脂质过氧化损伤,增强心房肌收缩力[22-23],这些作用可能与α、β受体和钙离子通道有关[24]。
1.2 抗菌的物质基础
该类物质主要由蜈蚣的毒腺分泌,并称为抗菌肽(AMPs)。蜈蚣属于节肢动物,这类动物没有特异性免疫系统。而蜈蚣常栖身于杂草丛或石下阴暗潮湿的角落,因此必须具有足够的非特异性免疫能力,才能抵御微生物的侵袭。蜈蚣分泌的AMPs具有活性稳定、抗菌谱广的特点。少棘蜈蚣活体经过微生物诱导后,其毒腺中分泌出大量AMPs,该类物质不但可直接发挥抗菌作用,且能激活巨噬细胞,有利于机体对细菌的抵抗[25-26]。
其中Scolopin 1和Scolopin 2长度分别为21和25个氨基酸残基,最小抑菌浓度下,6 min之内即可杀死大肠杆菌,相较之下,青霉素G产生同等效应需要6小时以上,且摩尔浓度需抬高至Scolopins的10倍[27]。利用基因重组技术,Scolopin 1能够大量生产,并且保持强烈的杀菌活力。不利的是,Scolopins可导致溶血,并促使肥大细胞释放组胺,引起炎症,敏化痛觉[28]。
另一个抗菌肽LBLP与乳铁蛋白肽B具有34%的相似性,具有抑制真菌生长的作用,尤其是念珠菌属。LBLP在80 μmol·L-1浓度下也不产生溶血作用,用药安全性较好[29]。类似的还有Scolopendrin I、Scolopendrasin II等,均有较好的安全性[30-33]。另外,Scolopendrasin VII还可通过激活巨噬细胞,间接发挥抗菌作用[34]。这些AMPs为研究新型抗生素提供了方向。
1.3 抗肿瘤的物质基础
蜈蚣毒液中的AMPs也可能同时具有抗肿瘤作用,例如Scolopendrasin VII通过特异性作用于磷酯酰丝氨酸,从而诱导白血病细胞株凋亡[35]。少棘蜈蚣药材中抗肿瘤活性物质不仅来源于毒液,其躯干中也存在抗肿瘤物质,且活性较强。实验表明,少棘蜈蚣药材的头足、躯干以及全虫对裸鼠Bel-7407肝癌细胞的抑制率分别可达47%、40%、41%[36]。
在临床癌症治疗方面,少棘蜈蚣药材水煎液主要用于肝癌,疗效较好,其次也被用来治疗乳腺癌、脑胶质癌、结肠癌等。其物质基础主要为水溶性多肽、多糖类物质,其中能有效抑制肝癌细胞增殖的小分子肽类分子量集中在1~5 KD[37-38]。蜈蚣多糖蛋白复合物(SPPC)能浓度依赖性减少斑马鱼胚胎肠下静脉长度,具有显著的抑制血管生成作用[39],并且无细胞毒性,但能够增加体内自然杀伤细胞、淋巴B细胞、CD4+T细胞的比例,增强机体免疫功能[40]。SPPC分子量为128 KD,含多糖91.8%,具有良好的水溶性、热稳定性,且无明显的溶血和凝集活性,可开发成治疗和预防肺癌、肝癌、口腔表皮癌、结肠癌和乳腺癌的药物。
另外,少棘蜈蚣药材乙醚提取液、乙醇提取液可抑制宫颈癌和黑色素瘤,可见蜈蚣抗肿瘤物质基础较为复杂,脂肪油类、环肽类物质不容忽视[3-5,41]。少棘蜈蚣对体外的肉瘤S180、H22等无明显作用[42],说明其抗肿瘤活性物质对不同类型的肿瘤具有较强的针对性。
1.4 镇痛的物质基础
在临床上少棘蜈蚣药材水煎液可用以镇痛,其中含有的一种多肽,在1.5 mg·kg-1剂量下对醋酸所致小鼠扭体的抑制率达到73%,与100倍该剂量下的阿司匹林相当[43]。该多肽的结构和作用机制尚不清楚。
少棘蜈蚣毒液中含有钠离子通道抑制剂,其中μ-SLPTX-Ssm6a对钠离子通道亚型NaV1.7有特异性。NaV1.7是伤害性和神经性痛觉产生的关键蛋白,该通道受抑制后可使患者痛觉减轻或消失。实验表明,μ-SLPTX-Ssm6a能剂量依赖性减轻福尔马林所致小鼠神经性疼痛、炎性疼痛以及醋酸所致的疼痛和热痛,因此其可用于制备新型镇痛药物,治疗各种疾病性疼痛,有望取代吗啡等毒品[44]。
1.5 调节体免疫功能的物质基础
少棘蜈蚣毒液也含有免疫抑制活性物质。少棘蜈蚣毒液中的神经毒素κ-SLPTX-Ssm4a对钾离子通道亚型KV1.3有专一性抑制作用。由于钾离子通道亚型KV1.3主要分布于免疫T细胞表面,是效应T细胞持续异常活化的关键因素,与自身免疫性疾病,如类风湿性关节炎、银屑病、肝炎、多发性硬化、肥胖症、移植排斥和炎症性神经病密切相关。所以推测κ-SLPTX-Ssm4a对这些疾病有一定治疗作用。在小鼠银屑病模型和乙肝模型中,κ-SLPTX-Ssm4a表型出良好的治疗效果[45]。
1.6 抗炎的物质基础
少棘蜈蚣药材水提物可用于治疗脑干、运动皮层和脊髓中运动神经元损伤所致的肌萎缩性脊髓侧索硬化症[10],其作用在于减少神经炎症的发生,抑制因氧化应激导致的血红素加氧酶HO1和醌氧化还原酶抗体NQO1的表达,减轻运动神经元的损伤。该水提物还能通过抑制c-Jun氮末端激酶、p38和NF-κB的表达,对抗雨蛙素诱导的急性胰腺炎,并缓解胰腺炎导致的肺损伤[9,46]。然而,具体的抗炎活性成分仍不清楚。
2 与致毒相关的活性物质基础
蜈蚣药材具有致过敏、肝肾毒性、妊娠毒性、神经毒性等[47],少棘蜈蚣水提液长期喂食果蝇可加速其衰老,且量效关系明显[48]。少棘蜈蚣水提液又可降低早期妊娠小鼠孕酮的分泌[49]。蜈蚣药材中的致毒物质基础研究相对薄弱,更多的研究关注蜈蚣毒液中的活性肽。蜈蚣药材经过加工炮制等处理,其中残存的毒液可能会逐渐降解,然而具体降解过程及其产物并不清楚。
蜈蚣毒液是蜈蚣捕食和防卫的武器,蜈蚣叮咬可造成局部红肿热痛、肌肉溶解、淋巴结肿大、心悸、恶心呕吐,甚至造成过敏性休克、昏迷和死亡[50-52]。
2.1 致过敏、致炎等毒性物质基础
蜈蚣药材加工、储存过程中会产生组织胺。组织胺是机体自身的一种传导物质,与系统性炎症、变态反应有关。长期大量服用蜈蚣药材可能导致过量摄入组织胺,引发过敏性中毒[53]。近年来研究还发现,少棘蜈蚣和多棘蜈蚣干燥虫体的醇提物中含有喹啉类、烷基酚、环二肽类等小分子化合物[54-56],这些物质具有潜在的致过敏、致突变、干扰内分泌等毒性作用。蜈蚣药材特别是其中残留的毒液中含有结构较为稳定的外源性蛋白,服用后可能导致免疫系统异常[57-58]。研究证明,少棘蜈蚣药材头足(残存毒液较多)、全虫、躯干的水煎液以14 g·kg-1(生药计)对大鼠进行长期毒性试验,均可见肝肾损伤、凝血功能异常,初期还引起胃肠功能紊乱[36]。说明蜈蚣药材中除了残存的毒液,虫体蛋白及其降解产物对于毒性的发挥也起重要作用。
2.2 局部组织损伤及溶血的物质基础
少棘蜈蚣的毒液中含有蛋白水解酶、磷酸酯酶等物质,蜈蚣咬伤后,这些酶能够迅速造成组织损伤和溶血,并且溶血特性与蛇毒类似[59]。酶谱分析表明,该类毒液具有多种水解酶活性,包括酪蛋白水解活性、纤维蛋白原水解活性、明胶水解活性、透明质酸酶活性、磷酯酶A2活性[60]。这些水解酶均能不同程度破坏内脏组织和血液循环系统,其中透明质酸酶能够加速伤口的扩大和毒液的扩散,磷脂酶A2能水解外源性的卵磷脂,其产物可导致溶血。除水解酶之外,毒液中的溶血肽也是直接的溶血因子[61]。
蜈蚣药材中该类物质是否能够有效避开消化系统破坏,或者其消化产物是否仍具有溶血作用未见报道。
2.3 神经毒性物质基础
该类物质主要为毒液中的毒性肽,其结构新颖,多具有离子通道激活或抑制活性,能够干扰外周或中枢神经系统功能[62-63]。赖仞研究团队对少棘蜈蚣毒液中的神经毒性肽进行了系统的分离和分析,研究表明,蜈蚣毒液中含有一类作用于大鼠背根节神经细胞电压门控通道的肽类,分子量3~9 KD,分子内包含2~4个二硫键;其中μ-SLPTX-Ssm1a是钠离子通道(TTX-S Nav)抑制剂,可特异性作用于钠离子通道亚型Nav1.7;κ-SLPTX-Ssm1a、κ-SLPTX-Ssm2a、κ-SLPTX-Ssm3a是钾离子通道(Kv)抑制剂,κ-SLPTX-Ssm4a还能特异性抑制钾离子通道亚型Kv1.3,SsmTx-I特异性作用于钾离子通道亚型Kv2.1;ω-SLPTX-Ssm1a是钙离子通道(Cav)通道激动剂;ω-SLPTX-Ssm2a是Cav通道抑制剂。通过Edman降解法和少棘蜈蚣毒腺cDNA文库末端快速克隆,得到了上述肽分子的cDNA和氨基酸全长序列。将这些序列与蜘蛛毒素、蛇毒等动物毒素进行比较,发现除了ω-SLPTX-Ssm2a以外,其他分子与已知毒素肽相似性极低,表明这些分子具有新颖的三维结构,有可能成为新的药物分子或杀虫剂[44-45,64-65]。
2.4 心肌损伤的物质基础
蜈蚣叮咬会引发心肌损伤,严重时造成缺血性心肌梗塞,心脏骤停[66]。这些毒性也是毒液中的多肽毒素引发的。其中来源于哈氏蜈蚣毒液的多肽SSD609具有三重螺旋结构,能够与心肌细胞钾通道辅助蛋白KCNE1的19位谷氨酸残基发生亲和,从而阻断钾离子传输,阻碍心肌电信号传导[67]。
2.5 致痛的物质基础
蜈蚣咬伤局部的“热痛”感也已经得到了解释。少棘蜈蚣毒液中的多肽毒素RhTx仅含有27个氨基酸残基,可直接激活辣椒素受体TRPV1,导致强烈的热痛感,以及局部体温升高[68]。
3 蜈蚣用药安全性的探讨
3.1 药材加工与减毒
蜈蚣以干燥全虫入药,其毒性主要来自于毒液。蜈蚣头部的毒腺以及胸部、尾部基板下腺体中均有毒液,其中的毒性肽结构稳定(含有较多二硫键),不易受到破坏,而简单的加工过程如开水烫、烘焙等未必能完全消除毒性物质。因此,迫切需要新的加工工艺,在保持蜈蚣药效的前提下,尽量去除其中的毒性肽,保存药效相关的活性肽;或者将蜈蚣药材中不同功用的多肽进行拆分,加强某种活性而去除其他活性,针对不同目的分别制定用药方案,避免用药时投鼠忌器的弊端。目前,仿生酶水解法能够较好地模拟人体消化过程,且水解过程产生大量结构不同的多肽,能够进一步分离加工,将不同功用的多肽进行拆分,或将毒性肽类转化为低毒肽类。该加工工艺研究需要进一步深入。
3.2 不同疾病状态与安全剂量
目前认为,蜈蚣水煎液常规剂量下毒性较低,属于小毒范围[69]。中华人民共和国药典规定,蜈蚣的常规用量为成人每日3~5 g,按体重50 kg计算,为0.6~1 g·kg-1。然而,蜈蚣的安全剂量仍存在较多不确定性。蜈蚣药材中的蛋白质要经过消化系统的水解转变成药效活性肽,而不同个体或同一个体不同状态下消化能力不同,特别是疾病状态下人体的消化功能可能较弱,对蛋白质消化不完全或消化缓慢,而蜈蚣含有诸多毒蛋白,对神经系统、血液系统都可能造成伤害,特别是溶血蛋白和各种水解酶可能造成肾功能衰竭,这些蛋白在胃肠道停留时间越长就越有可能被吸收。因此,蜈蚣的毒性和药效在不同疾病状态下显然是有差异的[42],需要进一步针对病情规定用药剂量。
3.3 用药方式与安全性
临床上蜈蚣的常规用法是水煎内服或入散剂,然而也有采用酒浸内服或研磨外敷的情况,中华人民共和国药典并未加以规定。不同用药方式下蜈蚣的毒性差别显著,因此有必要分别规定安全剂量。例如当作散剂应用时,蜈蚣全部成分都要经过胃肠道消化吸收,其中药效活性物质与致毒活性物质的吸收比例目前仍然不清楚。又例如,少棘蜈蚣醇提液中烷基酚等毒性物质更易溶出,故毒性较大,以10 g·kg-1(生药计)剂量口服即可造成小鼠肝脏损伤,40 g·kg-1(生药计)剂量还可致突变[42,70]。
4 结语
目前,蜈蚣药材中的药效活性物质和致毒活性物质均为生物大分子,包括蛋白质、肽类、多糖类,其中多肽占主要地位。蜈蚣毒液中既有药效活性物质又有致毒活性物质,其中的肽类结构新颖多样、活性强,有待于进一步挖掘。由于蛋白质组学大规模分离、鉴定技术和基因组学的应用,少棘蜈蚣毒液中已知的蛋白质序列超过40条,而哈氏蜈蚣超过1000条[57,64]。蜈蚣药材经过加工、储藏、酶解后产生大量结构新颖的多肽,活性广泛,包含了抗血栓、抗凝、抗肿瘤、镇痛镇静、免疫调节等各方面,但仍然需要进行系统的蛋白质组学分析[71]以及高通量的活性筛选,进一步明确具体的活性与多肽结构之间的对应关系。在此基础上,进行蜈蚣加工工艺优化研究、剂型研究、个体用药研究,进一步发挥蜈蚣的医疗价值,减弱甚至避免毒性作用。除了少棘蜈蚣,其他种类的蜈蚣也有相似或独特的疗效[72],需要进一步研究挖掘,充分发挥蜈蚣类药材资源的医疗价值和社会经济效益。
[1] 何苗,蔡际群,杜娃.蜈蚣等复方中药对震颤大鼠癫痫小发作的作用[J].中国医科大学学报,2004,33(2):104-106.
[2] 赵建一.研究两种有毒虫类中药的镇痛药理与临床应用[J].中医临床研究,2013,15(2):30-30.
[3] 周恩相.蜈蚣提取液治疗乳腺癌的实验研究[D].长沙:中南大学,2011.
[4] 周永芹,韩莉,刘朝奇,等.蜈蚣提取物对小鼠宫颈肿瘤生长的影响及其作用机制的实验研究[J].中药材,2011,34(6):859-864.
[5] 单小松.蜈蚣提取物对胶质瘤细胞的体外抑制作用实验研究[D].石家庄:河北医科大学,2005.
[6] 周强,刘桂芳,王佳,等.小议蜈蚣在糖尿病并发症中的运用[J].中华中医药杂志,2010,25(11):1806-1808.
[7] 殷鑫.速效降压搽剂治疗高血压病200例[J].陕西中医,1998,19(9):400-401.
[8] 郑平香,张贵平,张维文.少棘巨蜈蚣对某些动物血压的影响[J].广州医学院学报,1996,24(1):17-19.
[9] Jo I J,Bae G S,Park K C,et al.Scolopendra subspinipes mutilans protected the cerulein-induced acute pancreatitis by inhibiting high-mobility group box protein-1[J].World J Gastroenterol,2013,19(10):1551-1562.
[10] Cai M,Choi S M,Song B K,et al.Scolopendra subspinipes mutilans attenuates neuroinflammation in symptomatic hSOD1(G93A) mice[J].J Neuroinflammation,2013,(10):131.
[11] 宋志顺.中国蜈蚣目的分类研究[D].保定:河北大学,2004.
[12] 张崇洲,王克勤.两种药用蜈蚣的简介[J].动物学杂志,1995,30(4):51-54.
[13] 迟程,罗天诰,冉永禄.云南墨江药用蜈蚣分布及活动规律研究[J].中国中药杂志,1991,16(7):401-403.
[14] 李晓东,李欣,屈桂群,等.药用蜈蚣的生物学研究进展[J].大众科技,2013,15(9):85-88.
[15] 陈少鹏,韩雅莉,郭桅,等.少棘蜈蚣纤溶活性蛋白的抗血栓作用[J].中国药理学通报,2007,23(8):1088-1092.
[16] You W K,Sohn Y D,Kim K Y,et al.Purification and molecular cloning of a novel serine protease from the centipede,Scolopendra subspinipes mutilans[J].Insect Biochem Mol Biol,2004,34(3):239-250.
[17] 黄能听,王玉蓉,许文博,等.蜈蚣胃蛋白酶酶解混合多肽体外抗凝活性与组分分析研究//2009全国中药创新与研究论坛论文集[C].运城:中国学术期刊电子出版社,2009.
[18] 代龙,张红.蜈蚣不同提取工艺抗凝血及溶栓作用的比较研究[J].中华中医药学刊,2009,27(8):1777-1779.
[19] Kong Y,Huang S L,Shao Y,et al.Purification and characterization of a novel antithrombotic peptide from Scolopendra subspinipes mutilans[J].J Ethnopharmacol,2013,145(1):182-186.
[20] Kong Y,Shao Y,Chen H,et al.A Novel Factor Xa-Inhibiting Peptide from Centipedes Venom[J].Int J Pept Res Ther,2013,19(4):303-311.
[21] 蒋晔,王菊素,司秋菊,等.提取蜈蚣酸性蛋白的方法及其用该方法提取的蜈蚣酸性蛋白在制备治疗心脏病药物中的应用:CN101113162[P].2008-01-30.
[22] 赵志国.蜈蚣酸性蛋白抗心肌肥厚的作用及机制研究[D].石家庄:河北医科大学,2008.
[23] 赵志国,关胜江,张伟,等.蜈蚣酸性蛋白对AngⅡ诱导心肌细胞凋亡的影响[J].北京中医药大学学报,2010,33(6):394-397.
[24] 李军云.蜈蚣酸性蛋白抗动脉粥样硬化作用及对离体心房、血管的影响[D].石家庄:河北医科大学,2007.
[25] 任文华,张双全,宋大祥,等.少棘蜈蚣水提取物的抗菌活性[J].中药材,2007,30(1):10-14.
[26] 任文华,张双全,宋大祥,等.少棘蜈蚣抗菌肽粗品对小鼠巨噬细胞的体外激活作用[J].中药材,2007,30(12):1491-1494.
[27] Peng K,Kong Y,Zhai L,et al.Two novel antimicrobial peptides from centipede venoms[J].Toxicon,2010,55(2/3):274-279.
[28] Hou H,Yan W,Du K,et al.Construction and expression of an antimicrobial peptide scolopin 1 from the centipede venoms of Scolopendra subspinipes mutilans in Escherichia coli using SUMO fusion partner[J].Protein Expr Purif,2013,92(2):230-234.
[29] Choi H,Hwang J S,Lee D G.Antifungal effect and pore-forming action of lactoferricin B like peptide derived from centipede Scolopendra subspinipes mutilans[J].Biochim Biophys Acta,2013,1828(11):2745-2750.
[30] Ren W H,Zhan S Q,Song D X,et al.Induction,purification and characterization of an antibacterial peptide scolopendrin I from the venom of centipede Scolopendra subspinipes mutilans[J].INDIAN JOURNAL OF BIOCHEMISTRY & BIOPHYSICS,2006,43(2):88-93.
[31] Kwon Y N,Lee J H,Kim I W,et al.Antimicrobial activity of the synthetic peptide scolopendrasin ii from the centipede Scolopendra subspinipes mutilans[J].J Microbiol Biotechnol,2013,23(10):1381-1385.
[32] Lee H,Hwang J S,Lee J,et al.Scolopendin 2,a cationic antimicrobial peptide from centipede,and its membrane-active mechanism[J].Biochim Biophys Acta,2015,1848(2):634-642.
[33] Yoo W G,Lee J H,Shin Y,et al.Antimicrobial peptides in the centipede Scolopendra subspinipes mutilans[J].Funct Integr Genomics,2014,14(2):275-283.
[34] Park Y J,Lee H Y,Jung Y S,et al.Antimicrobial peptide scolopendrasin VII,derived from the centipede Scolopendra subspinipes mutilans,stimulates macrophage chemotaxis via formyl peptide receptor 1[J].BMB Rep,2015,48(8):479-484.
[35] Lee J H,Kim I W,Kim S H,et al.Anticancer activity of the antimicrobial peptide scolopendrasin VII derived from the centipede,Scolopendra subspinipes mutilans[J].J Microbiol Biotechnol,2015,25(8):1275-80.
[36] 尹强.蜈蚣不同部分提取液对肝癌细胞Bel-7404移植瘤的抑制作用及毒理学研究[D].长沙:中南大学,2011.
[37] 唐卉.蜈蚣小分子肽类对裸鼠肝癌原位移植瘤的抑制作用及机制的研究[D].长沙:湖南中医药大学,2012.
[38] 廖兴华.蜈蚣小分子多肽类有效部位的分离纯化及抗肿瘤活性筛选[D].长沙:湖南中医药大学,2011.
[39] 邓秀梅,陈丽,余伟,等.蜈蚣多糖蛋白复合物抗斑马鱼胚胎血管生成活性研究[J].咸宁学院学报(医学版),2011,25(1):9-11.
[40] Zhao H,Li Y,Wang Y,et al.Antitumor and immunostimulatory activity of a polysaccharide-protein complex from Scolopendra subspinipes mutilans L.Koch in tumor-bearing mice[J].Food Chem Toxicol,2012,50(8):2648-2655.
[41] 刘兵,谭竹钧,孔祥平,等.少棘蜈蚣活性蛋白对舌癌细胞Tea-8113的抑制作用研究[J].时珍国医国药,2013,24(6):1543-1544.
[42] 徐晓琳,王春梅,赓迪,等.蜈蚣提取物对S180及H22荷瘤小鼠的影响及其毒性的实验研究[J].中药材,2010,33(4):499-503.
[43] 邹吉利.蜈蚣多肽的提取分离及镇痛活性研究[D].长沙:湖北中医药大学,2010.
[44] 赖仞,容明强,杨仕隆,等.少棘蜈蚣多肽毒素mu-SLPTX-Ssm6a及其基因和应用:CN102977201A[P].2013-03-20.
[45] 赖刃,容明强,杨仕隆,等.少棘蜈蚣多肽毒素kappa-SLPTX-Ssm4a及其基因和应用:CN102993289A[P].2013-03-27.
[46] Shen X,Li W Q.High-mobility group box 1 protein and its role in severe acute pancreatitis[J].World J Gastroenterol,2015,21(5):1424-1435.
[47] 车景超.中药蜈蚣药用历史沿革及其安全性探讨[J].中医临床研究,2013,5(12):118-119.
[48] 崔小冬,王超然,张长清,等.蜈蚣提取物对果蝇寿命的影响[J].中药材,2007,30(9):1065-1067.
[49] 徐敏,李青,肖敏.蜈蚣汤对小鼠早期妊娠影响的实验研究[J].时珍国医国药,2012,23(9):2243-2244.
[50] 曹春水,黄亮.蜈蚣咬伤[J].中国实用乡村医生杂志,2008,15(6):19.
[51] Kimura L F,Prezotto-Neto J P,Tavora B C,et al.Local inflammatory reaction induced by Scolopendra viridicornis centipede venom in mice[J].Toxicon,2013,76:239-246.
[52] 冯海军.蜈蚣咬伤1例报告[J].中国社区医师(医学专业半月刊),2009,11(9):102.
[53] 方红,邓芳.蜈蚣药材中毒性成分组织胺的含量测定[J].中草药,1997,28(8):472-473.
[54] Yoon M A,Jeong T S,Park D S,et al.Antioxidant effects of quinoline alkaloids and 2,4-di-tert-butylphenol isolated from Scolopendra subspinipes[J].Biol Pharm Bull,2006,29(4):735-739.
[55] Noda N,Yashiki Y,Nakatani T,et al.A novel quinoline alkaloid possessing a 7-benzyl group from the centipede,Scolopendra subspinipes[J].Chem Pharm Bull (Tokyo),2001,49(7):930-931.
[56] 付银丹,李振麟,濮社班,等.多棘蜈蚣化学成分的研究(I)[J].中草药,2013,44(13):1726-1729.
[57] Liu Z C,Zhang R,Zhao F,et al.Venomic and transcriptomic analysis of centipede Scolopendra subspinipes dehaani[J].J Proteome Res,2012,11(12):6197-6212.
[58] Gutierrez M C,Abarca C,Possani L D.A toxic fraction from scolopendra venom increases the basal release of neurotransmitters in the ventral ganglia of crustaceans[J].Comp Biochem Physiol C Toxicol Pharmacol,2003,135(2):205-214.
[59] 汪猷,陈耀全,韩友娣,等.蜈蚣粗毒的生物活性[J].科学通报,1985,30(3):218-220.
[60] Malta M B,Lira M S,Soares S L,et al.Toxic activities of Brazilian centipede venoms[J].Toxicon,2008,52(2):255-263.
[61] 任文华,张双全,宋大祥,等.少棘蜈蚣毒液溶血肽的分离纯化[J].动物学报,2007,53(3):519-523.
[62] Rates B,Bemquerer M P,Richardson M,et al.Venomic analyses of Scolopendra viridicornis nigra and Scolopendra angulata (Centipede,Scolopendromorpha):shedding light on venoms from a neglected group[J].Toxicon,2007,49(6):810-826.
[63] Rong M,Yang S,Wen B,et al.Peptidomics combined with cDNA library unravel the diversity of centipede venom[J].J Proteomics,2015,114:28-37.
[64] Yang S,Liu Z,Xiao Y,et al.Chemical punch packed in venoms makes centipedes excellent predators[J].Mol Cell Proteomics,2012,11(9):640-650.
[65] Chen M,Li J,Zhang F,et al.Isolation and characterization of SsmTx-I,a Specific Kv2.1 blocker from the venom of the centipede Scolopendra Subspinipes Mutilans L.Koch[J].J Pept Sci,2014,20(3):159-164.
[66] Ureyen C M,Arslan S,Bas C Y.Cardiovascular collapse after myocardial infarction due to centipede bite[J].Wien Klin Wochenschr,2015,127(13/14):577-579.
[67] Sun P,Wu F,Wen M,et al.A distinct three-helix centipede toxin SSD609 inhibits I(ks) channels by interacting with the KCNE1 auxiliary subunit[J].Sci Rep,2015,5:13399.
[68] Yang S,Yang F,Wei N,et al.A pain-inducing centipede toxin targets the heat activation machinery of nociceptor TRPV1[J].Nat Commun,2015,6:8297.
[69] 张广平,叶祖光.有毒中药的“毒性”与毒性分级[J].世界中医药,2014,9(2):175-177.
[70] 肖辉.蜈蚣醇提液的毒理学研究[D].长沙:中南大学,2008.
[71] 陈霞,文红梅,刘睿,等.纳升级反相液相色谱-串联质谱法分析蜈蚣提取蛋白质[J].分析化学,2014,42(2):239-243.
[72] 王硕,覃文慧.多棘蜈蚣与少棘蜈蚣抗肿瘤作用研究[J].中国实验方剂学杂志,2011,17(13):156-158.
ResearchProgressesinBioactiveandToxicCompoundsfromBiologicalResourcesofCentipedes
YUJingao,LIUPei,DUANJin’ao*
(JiangsuCollaborativeInnovationCenterofChineseMedicinalResourcesIndustrialization,andNationalandLocalCollaborativeEngineeringCenterofChineseMedicinalResourcesIndustrializationandFormulaeInnovativeMedicine,NanjingUniversityofChineseMedicine,Nanjing210023,China)
Centipedes is a widely used animal (insect) medicinal material fromScolopendrasubspinipesmutilansL.Koch and closely related species,and catches attentions of researchers due to its extensive bioactivities and biomolecules including proteins,peptides and polysaccharides.The peptides can be secreted by the poison gland or generated by the degradation of the crude drug,both with various novel structures and widespread activities.The paper reviews the biological resource groups of centipedes and the isolation,purification,identification and bioactivities of the containing peptides of important medicinal resources as well as the relationships between the bioactivities and peptide structures through literature study and knowledge mining.This review presents the directions of the medicinal research or resource development of centipedes,so as to help finding the resource value and industrial prospect of centipedes objectively for scholars and entrepreneurs.It also clarifies the poisonous material basis of centipedes and guides the clinical medication to be safe and reasonable under different processing methods,dosage forms and disease status.
Centipedes;animal medicinal resources;bioactive compounds;toxic compounds;medication safety
10.13313/j.issn.1673-4890.2016.11.027
2015-08-28)
*
段金廒,教授,研究方向:中药资源化学;Tel:(025)85811116,E-mail:dja@njucm.edu.cn
