赤皮青冈幼胚愈伤组织诱导的研究
2016-09-24张明星杨模华杨石浪李志辉
杨 壮,张明星,杨模华,杨石浪,李志辉
(中南林业科技大学林学院,湖南 长沙 410004)
赤皮青冈幼胚愈伤组织诱导的研究
杨 壮,张明星,杨模华,杨石浪,李志辉
(中南林业科技大学林学院,湖南 长沙 410004)
以赤皮青冈幼胚为外植体,以MS为基本培养基,探讨了2,4-D和6-BA两种激素共同作用下对赤皮青冈幼胚诱导的影响,以及在4℃条件下不同冷藏天数(5、15、30 d)和不同激素(6-BA和2,4-D)浓度组合对赤皮青冈幼胚诱导的影响。结果表明:6-BA对愈伤组织诱导的影响较大;接种在“MS+1.0 mg/L 2,4-D +0.5 mg/L 6-BA +30 g/L蔗糖+0.1g/L肌醇+1.0g/L水解酪蛋白”培养基上的幼胚,以4℃冰箱中冷藏15 d的幼胚愈伤组织诱导率最高(41.1%)。在此基础上,选取冷藏15 d的赤皮青冈幼胚,探究了不同基本培养基种类(MS、1/2MS和WPM)和不同激素(6-BA和2,4-D)浓度组合对赤皮青冈幼胚诱导的影响。结果表明:3种培养基对愈伤组织诱导的影响没有显著差异,但是每一种培养基中诱导率最高的激素组合各不相同。
赤皮青冈;幼胚 ;激素;冷藏;愈伤组织
赤皮青冈[Cyclobalanopsis gilva (Bl.) Oerst.]为壳斗科青冈属植物,产于台湾、广东、湖南、贵州及华东等地区,生于海拔200~1 500 m范围内,生态适应性较强、较耐干旱瘠薄[1]。赤皮青冈的心材呈深红褐色,边材呈黄褐色,纹理直,是我国林业生产中重要的用材。一方面,赤皮青冈树大、干直、树龄长、长速快,是较好的园林绿化树种,有观赏、防风等价值,可在东南丘陵山地推广种植;另一方面,赤皮青冈属于中上等用材(商品材称作红椆),可用于家具、工艺品制作等;此外,赤皮青冈的树皮和壳斗含有单宁,果实淀粉含量可观,可用于栲胶、食物制作等领域[2-3]。
目前,我国城镇化速度不断加快,人们对红椆这种优良木材的需求大大增加[4],但是赤皮青冈种子属于顽拗性种子,其萌发时间很长,发芽率较低,且难以保存母本的优良性状,高品质红椆用材供不应求,因此赤皮青冈快繁技术的研究具有重要意义。运用幼胚诱导愈伤组织进而大量诱导胚状体的过程能为该树种建立了一条有效的快繁途径,还可以结合分子生物学技术进行新品种的培育,大大缩短了育种育苗的周期。研究采用双因子试验设计,探索了不同冷藏天数、不同激素组合以及不同基本培养基对诱导赤皮青冈幼胚愈伤组织的影响,以期为赤皮青冈快繁体系建立、分子诱变育种和工厂化组织培养奠定基础。
1 材料与方法
1.1材料来源与处理
以2015年7月10日采自湖南省张家界市一株300 a树龄赤皮青冈母树的未成熟种子为试验材料,种子采下后立即放入冰盒保存,返回试验室后将未成熟种子放置在4℃的冰箱中冷藏备用。
1.2外植体的处理
从冰箱中取出赤皮青冈未成熟种子,先用少量洗衣粉洗去其表面的粉尘,然后置于流水下冲洗4 h。在超净工作台进行消毒灭菌处理:75%酒精消毒30 s,无菌水冲洗3~4次,0.1% HgCl2灭菌10 min,无菌水冲洗4~6次。在超净无菌工作台上用灭菌的枝剪剪开外面的壳斗和坚硬的外种皮,按试验方案将带胚乳的幼胚接种在诱导培养基上,最后将接种的培养基存放在23℃经过消毒的培养温室里进行暗培养。
1.3 不同激素组合试验
为筛选出赤皮青冈幼胚愈伤组织诱导最佳激素组合,采用在4℃冷藏15 d的赤皮青冈未成熟种子为外植体(图1A),以MS+30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白(pH值5.6)为基本培养基,选择2,4-D和6-BA各4种浓度梯度,按双因子试验设计共16个处理(表1),每个处理接种90个外植体,共需接种1 440个外植体,定期观察,接种40 d后统计出诱导率和褐化率。诱导率=(诱导出愈伤组织的外植体数/接种外植体数)×100%,褐化率=(褐化的外植体数/接种外植体数)×100%。

表1 不同激素组合试验设计 (mg/L)
1.4不同冷藏天数试验
为筛选出赤皮青冈幼胚愈伤组织诱导的最佳冷藏天数,以MS+30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白(pH值5.6)为基本培养基,采用3种激素组合,分别冷藏5、15和30 d后接种。按双因子试验设计,共9个处理(表2),每个处理接种90个外植体,共接种810个外植体,定期观察,接种40 d后统计诱导率,并采用SPSS软件进行方差分析。
1.5不同基本培养基试验

表2 不同冷藏天数试验设计
为筛选出赤皮青冈幼胚愈伤组织诱导最佳基本培养基种类,以4℃冷藏15 d的赤皮青冈幼胚为外植体,采用上述3种激素组合,选用MS,1/2MS和WPM 3种基本培养基,添加30 g/L蔗糖、0.1 g/L肌醇和1.0 g/L水解酪蛋白,pH值5.6。按照双因子试验设计,共9个处理(表3),每个处理接种90个外植体,共需接种外植体810个,定期观察,接种40 d后统计诱导率,并采用SPSS软件进行方差分析。

表3 不同基本培养基试验设计
2 结果与分析
2.1激素种类及浓度对赤皮青冈幼胚愈伤组织诱导的影响
采用双因子设计的16个处理中,在接种10 d后,处理11的幼胚开始膨胀,出现少量白色愈伤组织(图1A);接种15~20 d后,愈伤组织逐渐增多,同时部分种子褐化,培养基并开始变色,该现象以处理2、3和14最为严重。接种25 d后,各处理幼胚愈伤组织均明显增多(图1B),微距观察到愈伤组织生长良好(图1C)。
从表4中可以看出,2,4-D和6-BA两种激素对于赤皮青冈胚性愈伤组织的诱导有一定的影响。在6-BA激素浓度为0.5和1.0 mg/L的8个处理中,幼胚能诱导产生愈伤组织,其中处理6、11和12的诱导率分别达到了40.0%、44.4%和50.0%,这表明在赤皮青冈胚性愈伤组织的诱导中起主导作用的激素是6-BA。试验获得的最佳培养基组合是MS+2.0 mg/L 2,4-D +1 mg/L 6-BA +30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白,pH值5.6。
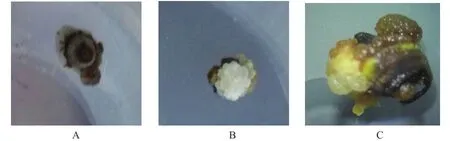
图1 不同激素组合组织培养及微距观察(A.组织培养外植体-幼胚;B.接种25 d;C.接种25 d 10倍镜下观察)

表4 不同激素组合对赤皮青冈幼胚愈伤组织诱导的影响
2.2激素种类及浓度对外植体褐化的影响
在不同激素组合愈伤组织诱导中,记录了外植体接种40 d后的褐化状况(图2A,表4),而且还对褐化外植体进行了显微结构观察(图2B),发现虽然外植体褐化,但是愈伤组织生长良好。

图2 幼胚褐化状况观察及显微结构观察(A.接种40 d后外植体褐化状况;B.褐化外植体10倍镜下观察)
由表4可知,处理13的褐化率(5.6%)最低,处理9的褐化率最高,达83.3%。结合诱导率分析,处理11的褐化率仅为10.0%,而诱导率高达44.4%,因此认为该处理(MS+1.0 mg/L 2,4-D +1.0 mg/L 6-BA +30 g/L蔗糖+0.1g/L肌醇+1.0g/L水解酪蛋白)较适用于赤皮青冈幼胚愈伤组织诱导。
2.3冷藏天数对赤皮青冈幼胚愈伤组织诱导的影响
双因子设计的9个处理在接种后,分别进行定期观察记录,发现处理e接种第15 d后幼胚开始膨大,中部出现少量乳白色愈伤组织,同时部分处理的幼胚出现褐化现象,以处理f褐化最为严重。接种20 d后,各处理幼胚不再膨胀,愈伤组织持续增多(图3A)。接种33 d后,各处理出现较多愈伤组织,且褐化率也增高了,微距观察诱导出的愈伤组织,生长状况良好(图3B)。
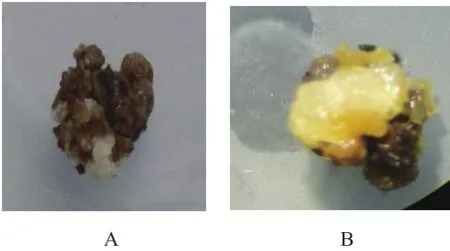
图3 不同冷藏天数组织培养及微距观察(A.接种20 d;B.接种20 d的愈伤组织10倍镜下观察)
从表5中可以看出,除了冷藏天数为30 d的处理i没有诱导出愈伤组织外,其他处理均诱导出了愈伤组织,而且冷藏15 d的幼胚愈伤组织诱导率最高,与其他两个处理(冷藏5 d和30 d)有一定差异;但经单因素方差分析,Sig值为0.295,说明冷藏5、15、30 d对愈伤组织的诱导率差异不显著。冷藏15 d中以B组合(1.0 mg/L 2,4-D +0.5 mg/L 6-BA)的诱导效果最好(即处理e),达到了41.1%,因此认为冷藏15d对幼胚愈伤组织的诱导效果最好,且最佳培养基组合为MS+1.0 mg/L 2,4-D +0.5 mg/L 6-BA +30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白,pH值5.6。

表5 不同冷藏天数对赤皮青冈幼胚愈伤组织诱导的影响
2.4基本培养基对赤皮青冈幼胚愈伤组织诱导的影响
双因子设计的9个处理中,在接种后15 d处理B的幼胚膨大,幼胚中部裂开,出现极少量白色愈伤组织。接种24 d后部分幼胚出现褐化,各处理均有反应,出现乳白的愈伤组织(图4A);按双因子设计配方继代培养一次,愈伤组织生长扩大,如图4B所示。

图4 不同基本培养基组织培养及继代培养观察(A.接种24 d;B.继代培养一次)
单因素方差分析显示,组间Sig值为0.999,说明3种基本培养基之间的诱导效果并不存在显著性差异;但是组内差异较大,说明在愈伤组织诱导的过程中植物激素的作用大于基本培养基的作用。从表6中可以看出,每组基本培养基组合中各有1个诱导率较高的组合,分别为处理B(MS+1.0 mg/L 2,4-D +0.5mg/L 6-BA +30 g/L蔗糖+0.1g/L肌醇+1.0g/L水解酪蛋白)、处理D(1/2 MS +0.5 mg/L 2,4-D +0.5 mg/L 6-BA +30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白)和处理I(WPM+1.0 mg/L 2,4-D +1.0 mg/L 6-BA +30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白),诱导率分别达到了40.0%、32.2%和33.3%。虽然这3个组合诱导率差异不大,但是所采用的激素浓度却不相同,说明基本培养基和植物激素之间存在协同作用。

表6 不同基本培养基对赤皮青冈幼胚愈伤组织诱导的影响
3 结论与讨论
体细胞胚胎发生是细胞工程中植株再生的重要途径之一,可作为基因工程的受体系统,同时也是研究细胞全能性、细胞分化及其形态建成的理想试验体系[5]。而愈伤组织的诱导是重中之重,只有诱导出良好的愈伤组织才能为体细胞胚胎发生奠定好基础。在赤皮青冈幼胚愈伤组织诱导过程中,2,4-D和6-BA两种激素发挥了极其关键的作用,2,4-D属于生长素类似物,在愈伤组织诱导和生根方面有着重要作用,在某些植物的组织培养中还会诱导不定胚的形成;6-BA属于细胞分裂素,在培养基中添加细胞分裂素,其目的在于促进细胞分裂,诱导愈伤组织、不定芽和不定胚的产生;生长素与细胞分裂素配合使用,对于器官形成和植株再生有着重要的调控作用[6],该试验结果也进一步说明了这两种激素的关键作用,其中6-BA占主导地位。
试验中采种时间对愈伤组织的诱导很重要,过早和过晚都不能得到良好的愈伤组织,而且不同发育时期的未成熟合子胚对激素配比要求也有一定差异[7]。由于赤皮青冈采种的难度较大(树比较高),大小年现象严重,采种距离较远,试验中未探究赤皮青冈未成熟种子的最佳采种时间,需进行后续研究。据相关报道[6-10],适度冷藏对可溶性蛋白、淀粉酶和可溶性糖分有一定的影响,从而对愈伤组织的诱导起到一定作用,但是冷藏时间过短或者过长也会对愈伤组织诱导产生不利影响,所以适量冷藏天数对愈伤组织的诱导很关键[11]。研究分析了不同冷藏天数对赤皮青冈幼胚愈伤组织诱导的影响,结果表明不同冷藏时间对赤皮青冈胚性愈伤组织诱导有显著性差异。其中,4 ℃冷藏15 d的幼胚接种在“MS+1.0 mg/L 2,4-D +0.5 mg/ L 6-BA +30 g/L蔗糖+0.1 g/L肌醇+1.0 g/L水解酪蛋白”培养基上,愈伤组织诱导率最高,为41.1%。
植物组织培养中,不同植物的生物学特性不同,同一种植物不同部位的组织、同一部位组织的不同生长阶段均对营养的要求也不同,只有满足它们各自的要求才能使其正常生长。因此,选择合适的培养基对植物组织培养十分重要[12]。MS培养基是一种应用十分广泛的培养基,其无机盐类浓度较高,尤其是铵盐和硝酸盐,元素平衡较好,缓冲性能好,微量元素和有机成分含量较齐全且较丰富,能够满足快速增长的组织对营养元素的要求,但是它不适合生长缓慢、对无机盐类要求比较低的植物(尤其是不适合铵盐过高易导致毒害的植物);1/2MS培养基是将MS培养基的大量元素减半,适合无机盐需求浓度低的植物;WPM培养基主要用于木本植物的组织培养[6]。通过试验研究,发现MS、1/2MS和WPM 3种基本培养基对赤皮青冈幼胚愈伤组织的诱导没有特别显著的区别,与不同激素组合获得不同诱导率,说明不同基本培养基最佳协同激素种类及浓度各不相同。
褐化现象,又被称为酚污染,当外植体组织被切割和接种时,损伤切面细胞中酚类物质被氧化成醌,切面迅速变成棕褐色或暗褐色,这些褐色物会逐渐扩散到培养基中,抑制其他酶的活性,毒害整个外植体组织[13-16]。赤皮青冈幼胚里含有单宁物质[2,17],接种时切面很快就会有褐化现象产生,影响外植体的生长,采用连续移植外植体的方法可以缓解褐化[18]。在赤皮青冈幼胚愈伤组织诱导的试验过程中,由于赤皮青冈幼胚壳斗上绒毛较多且存在许多隐蔽难以完全灭菌的地方,因此试验中往往容易出现的问题就是污染和褐化,然而污染可以尽量避免,但是幼胚褐化问题无法规避。通过上面的试验以及有关研究表明外植体虽然出现了褐化现象,但是只要有细胞存活就能产生愈伤组织,这与前人研究结果一致[12-13]。
愈伤组织的保持与增殖是一个关键难题[19],只有解决了这个难题,才能得到更多的胚状体,达到赤皮青冈高效快速扩繁的目的,为赤皮青冈基因工程和分子水平的研究奠定基础。
赤皮青冈作为珍贵树种,又是优良的用材树种,迫切需要建立一个高效快速稳定的扩繁体系,其幼胚体细胞胚胎发生体系是解决这个问题的有效途径,研究初步建立了赤皮青冈幼胚愈伤组织的诱导体系,但成功获得体细胞胚并培育成无菌苗还需要进一步深入研究。
[1] 祈承经,汤庚国. 树木学(南方本)第二版[M]. 北京:中国林业出版社,2005.
[2] 汪 丽. 赤皮青冈快繁技术研究[D]. 长沙:中南林业科技大学,2014. 4-10.
[3] 端木折. 我国青冈属资源的综合利用[J]. 北京林业大学学报,1995,17(2):109-110.
[4] 李志辉,李柏海,祁承经,等. 我国南方珍贵用材树种资源的重要性及其发展策略[J].中南林业科技大学学报,2012,32(11):1-8.
[5] 卜学贤,陈维伦. 活性碳在植物细胞组织培养中的作用[J]. 植物学通报,1988,(1):1-5.
[6] 王 蒂,陈劲枫. 植物组织培养[M]. 北京:中国农业出版社,2013.
[7] 陈春伶. 栓皮栎体胚再生植株培养方案的优化研究[D]. 杨陵:西北农林科技大学,2010.
[8] 黄利斌. 北美栎树引种栽培技术研究[D]. 南京:南京林业大学,2007.
[9] 张立才. 金森女贞和青冈栎的抗寒性和耐荫性研究[D]. 泰安:山东农业大学,2011.
[10] 杨锋利. 成龄栓皮栎组培繁殖技术的研究[D]. 杨陵:西北农林科技大学,2005.
[11] 杨模华,张冬林,李志辉,等. 马尾松幼胚体细胞胚胎发生研究[J].植物生理学报,2011,(9):904-912.
[12] 邹英宁,吴强盛. 基本培养基对海湾红宝石李增殖和生根的影响[J].河南农业科学,2009,(4):104-106.
[13] 曾艳玲,张 琳,谭运德,等. 云实叶片体细胞胚发生及植株再生[J].中南林业科技大学学报,2012,32(2):89-94.
[14] Hernández I,Celestino C,Toribio M. Vegetative propagation of Quercus suber L. by somatic embryogenesis. I. Factors affecting the induction in leaves from mature cork oak trees[J]. PubMed Journal,2003,(21):759-764.
[15] 周俊辉,周家容,曾浩森,等. 园艺植物组织培养中的褐化现象及抗褐化研究进展[J]. 园艺学报,2000,(S1):481-486.
[16] 李浚明. 植物组织培养教程[M]. 北京:中国农业大学出版社,1996. 345
[17] 胡芳名,李建安,李若婷. 湖南省主要橡子资源综合开发利用的研究[J]. 中南林学院学报,2000,(4):41-45,95.
[18] 陈 芳,陈少瑜,吴 涛,等. 丽江云杉体细胞胚胎发生[J]. 林业科学,2010,(8):162-167.
[19] 张存旭,姚曾玉. 栎属植物体细胞胚胎发生研究现状的[J]. 西北植物学报,2004,24(2):356-362.
(责任编辑:成 平)
Study on Immature Embryo Callus Induction of Cyclobalanopsis gilva
YANG Zhuang,ZHANG Ming-xing,YANG Mo-hua,YANG Shi-lang,LI Zhi-hui
(Forestry College, Central South University of Forestry and Technology, Changsha 410004, PRC)
Took Cyclobalanopsis gilva immature embryos as explants and MS as basic medium, discussed the induced effect of Cyclobalanopsis gilva immature embryos under combined action of hormones 2, 4-D and 6-BA, and the induced effect of Cyclobalanopsis gilva immature embryos under the condition of 4℃ refrigeration in different days (5 days, 15 days, 30 days) and different hormone (6-BA and 2,4-D) concentrations and combinations. The result showed that 6-BA had greater induced effect on callus; the immature embryos on the medium of “MS+1.0 mg/L 2,4-D +0.5 mg/L 6-BA +30 g/L sucrose+0.1g/L inositol+1.0g/L hydrolyzed casein”, the induction rate of immature embryos callus in refrigerator at 4℃ for 15 days was highest (41.1%). On this basis, selected the refrigerated 15 days of Cyclobalanopsis gilva immature embryo, explored the induced effects of different basic culture medium (MS, 1 / 2 ms and WPM) and different hormone (6-BA and 2,4-D) concentrations and combinations on Cyclobalanopsis gilva immature embryos. The results showed that there was no significant difference in the effect of 3 kinds of medium on the callus induction, but the highest induction rate hormone combination in each medium was different.
Cyclobalanopsis gilva; immature embryo; hormone; cold storage; callus
Q813.1+2
A
1006-060X(2016)08-0001-05
10.16498/j.cnki.hnnykx.2016.08.001
2016-05-20
国家“十二五”科技支撑计划资助项目(2012BAD21B03);中南林业科技大学大学生研究性学习和创新性实验计划项目(2015)
杨 壮(1994-),男,湖北鄂州市人,本科生,专业为林学。
李志辉
