扩散张量成像各向异性分数在足月新生儿缺氧缺血性脑病中的应用
2016-09-24葵XIANGKui
向 葵XIANG Kui
干芸根1GAN Yungen
王宏伟1WANG Hongwei
杜 牧2DU Mu
扩散张量成像各向异性分数在足月新生儿缺氧缺血性脑病中的应用
向 葵1XIANG Kui
干芸根1GAN Yungen
王宏伟1WANG Hongwei
杜 牧2DU Mu
作者单位
1.深圳市儿童医院放射科 广东深圳 518038
2.深圳市妇幼保健院 广东深圳 518028
2016-02-05
中国医学影像学杂志
2016年 第24卷 第4期:248-252
Chinese Journal of Medical Imaging
2016 Volume 24 (4): 248-252
目的 探讨磁共振扩散张量成像(DTI)的各向异性分数(FA)值在足月新生儿缺氧缺血性脑病(HIE)早期诊断及病情评估中的应用,为临床治疗提供依据。资料与方法 收集58例临床确诊的足月HIE患儿,其中轻度HIE 28例,中度HIE 19例,重度HIE 11例,并选取20例正常足月新生儿为对照组,行颅脑常规MRI及DTI扫描,测量内囊前肢、内囊后肢、豆状核、胼胝体膝部及胼胝体压部的FA值,比较各组不同部位的FA值。结果 对照组内囊前后肢、胼胝体膝部和压部的FA值均高于中度HIE组和重度HIE组,对照组胼胝体膝部的FA值高于轻度HIE组,轻度HIE组和中度HIE组内囊前后肢、胼胝体膝部和压部的FA值高于重度HIE组,轻度HIE组内囊后肢FA值高于中度HIE组,差异均有统计学意义(P<0.05);各组豆状核的FA值差异均无统计学意义(P>0.05)。在各部位中,内囊后肢FA值诊断HIE的准确度最高,曲线下面积为0.802,当内囊后肢FA值的截断点取0.543时,诊断灵敏度为61.2%,特异度为85.0%,Youden指数为0.462。结论 DTI FA值可以早期、定量评价HIE新生儿脑损伤的程度,为HIE的早期诊断及病情评估提供客观依据。【关键词】缺氧缺血,脑;磁共振成像;扩散张量成像;各向异性分数;婴儿,新生;足月分娩
【Abstract】Purpose To investigate the feasibility of fractional anisotropy (FA) in the evaluation of neonatal hypoxic ischemic encephalopathy (HIE) using magnetic resonance diffusion tensor imaging (DTI).Materials and Methods Fifty-eight neonates with HIE confirmed clinically (28 mild,19 moderate and 11 severe HIE neonates,respectively) and twenty age-matched controls were recruited to have conventional brain MRI and DTI scans. FA values at anterior and posterior limbs of internal capsule,lenticular nucleus,and genu and splenium of corpus callosum were measured respectively. FA values among different groups were compared.Results FA values at anterior and posterior limbs of internal capsule,and genu and splenium of corpus callosum in the control group were higher than those of the moderate and the severe HIE groups. FA value at genu of corpus callosum was exhibited greater in the controls than that in the mild HIE group. Higher FA values were found at anterior and posterior limbs of internal capsule,and genu and splenium of corpus callosum in the mild and moderate groups compared to the severe group. FA value at posterior limb of internal capsule in the mild HIE group was found to be greater than that of the moderate group (P<0.05). No significant difference of FA value at lenticular nucleus was observed among different groups (P>0.05). Specially,FA value at posterior limb of internal capsule proved to be superior in diagnosis of HIE with area under the curve of 0.802. When FA threshold at posterior limb of internal capsule was set to be 0.543,the diagnosis susceptibility and specificity were 61.2% and 85.0%,respectively,with the Youden index of 0.462.Conclusion The index of FA can facilitate the quantitative evaluation of neonatal brain injury with HIE,which may provide important information for early diagnosis and disease assessment.
【Key words】Hypoxia-ischemia,brain; Magnetic resonance imaging; Diffusion weighted imaging; Fractional anisotropy; Infant,newborn; Term birth
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由于围生期窒息引起的缺氧缺血性脑损伤,主要见于足月儿,可导致脑白质损伤,造成永久性的神经系统缺陷,是致残的重要原因之一。早期诊断和及时干预治疗是减少后遗症的关键[1]。目前MRI检查是诊断本病的最佳方法,特异度和敏感度最高[2]。扩散张量成像(diffusion tensor imaging,DTI)可以无创性地活体显示脑白质纤维束的方向性和完整性,其主要参数各向异性分数(FA)值能客观反映轴突的完整性,定量评估髓鞘化程度。本研究拟以DTI FA值评估HIE神经纤维束的发育,探讨其应用价值。
1 资料与方法
1.1 研究对象 收集2013年11月—2015年6月深圳市儿童医院收治的58例HIE足月新生儿,病例资料均完整,其中男31例,女27例;孕龄38~41周;平均出生体重(3250±380)g。HIE诊断及分度标准按照中华医学会儿科分会新生儿学组2004年修订的《新生儿缺氧缺血性脑病诊断标准》[3],其中轻度28例,中度19例,重度11例。随机抽取20例足月正常新生儿为对照组,其中男11例,女9例;孕龄38~41周,平均出生体重(3310±350)g。MRI检查时的日龄为3~15 d。两组患儿的性别、胎龄、出生体重、日龄比较,差异无统计学意义(P>0.05)。所有患儿家长均签署知情同意书,本研究经医院伦理委员会批准。
1.2 仪器与方法 采用Siemens 3.0T skyra MR扫描仪,头部20通道相控阵列线圈,用海绵固定头部,戴上专用耳机减少噪声影响。先行常规轴位T1WI、T2WI、液体衰减反转恢复(FLAIR)及DWI扫描(b=800 s/mm2),层数16,层厚5 mm,层间距1 mm。DTI扫描采用SE序列单次激发平面回波成像(single shot echo planar imaging,SS-EPI),扫描参数:TR 4100 ms,TE 95 ms,20个扩散敏感梯度方向,b值为0、800 s/mm2,层厚4 mm,30层,间隔0 mm,矩阵128×128,激励次数3,采集时间约5 min。所有患儿检查前约30 min给予10%水合氯醛0.5~1.0 ml/kg,口服或用灌肠镇静,待患儿熟睡后行MRI检查。检查时备氧气袋,由1名有经验的新生儿科主治医师陪同。
1.3 图像分析 利用Siemens 3.0T Skyra自带工作站中的Neuro 3D软件,自动生成FA图和彩色编码张量图。在FA图上于轴位基底节层面依次手动选择内囊前肢、内囊后肢、豆状核、胼胝体膝部及胼胝体压部作为感兴趣区(ROI),ROI的选择要结合T1WI图,以便清楚地分辨上述解剖结构,避免邻近组织部分容积效应的影响(图1B)。每个部位的ROI大小约为(10±2)mm2,置于该部位中央,两侧对称。对于双侧对称的解剖结构包括内囊前后肢和豆状核,左、右两侧分别测量;每个ROI测量3次取平均值。
1.4 统计学方法 采用SPSS 17.0及MEDCALC 15.6软件,采用单因素方差分析比较对照组和不同程度HIE组相应ROI的FA值,两两比较采用LSD法;方差不齐则采用多个独立样本秩和检验。采用受试者操作特征(ROC)曲线评价ROI的FA值对HIE患儿的诊断效能,并计算其FA阈值、曲线下面积,P<0.05表示差异有统计学意义。
2 结果
2.1 对照组和不同程度HIE组各部位FA值比较 对内囊前后肢、豆状核的双侧FA值进行配对样本t检验,结果显示双侧FA值差异无统计学意义(P>0.05),故取左、右侧FA值的平均值为该部位的FA值。对照组和不同程度HIE组间各部位FA值见表1,由表1可见除豆状核外,HIE组内囊前后肢、胼胝体膝部和压部的FA值较对照组降低,且FA值随着HIE程度加重越来越低。
2.2 对照组和不同程度HIE组FA值比较 对照组内囊前后肢、胼胝体膝部和压部的FA值均高于中度HIE组和重度HIE组,对照组胼胝体膝部的FA值高于轻度HIE组,轻度HIE组和中度HIE组内囊前后肢、胼胝体膝部和压部的FA值高于重度HIE组,轻度HIE组内囊后肢FA值高于中度HIE组,差异均有统计学意义(P<0.05)。豆状核的FA值在各组间差异均无统计学意义(P>0.05),见图1、2。

表1 对照组和不同程度HIE组各部位FA值比较

图1 男,出生孕周37周+4,出生后2 d,正常足月新生儿。T1WI未见明显异常(A),FA图(ROI的选择:1.胼胝体膝部;2.内囊前肢;3.内囊后肢;4.胼胝体压部;5.豆状核)(B)和彩色编码张量图(C)显示脑白质纤维束边缘清晰光滑,走行清晰、自然,显示出良好的各向异性

图2 男,出生孕周37周+5,出生后5 d,重度HIE。T1WI示双侧侧脑室扩张,脑室内积血(箭头,A); FA图(B)和彩色编码张量图(C)示脑白质纤维束结构紊乱,边缘毛糙,信号混杂,颜色变淡(箭)
2.3 各部位FA值诊断HIE符合度的ROC曲线 内囊前肢、内囊后肢、豆状核、胼胝体膝部及压部FA值诊断HIE准确度的ROC曲线见图3及表2。除豆状核外,对照组和不同程度HIE组各部位FA值差异均有统计学意义(P<0.05)。5个部位ROC曲线两两比较结果见表3,内囊前肢和内囊后肢、内囊后肢和豆状核、豆状核和胼胝体膝部的ROC曲线下面积差异有统计学意义(P<0.05)。由ROC曲线下面积得知,内囊后肢的FA值诊断准确度最高,曲线下面积为0.802,当FA值的截断点取0.543时,诊断敏感度为61.2%,特异度为85.0%,Youden指数为0.462。

图3 内囊前后肢、豆状核、胼胝体膝部及压部的FA值诊断HIE准确度的ROC曲线
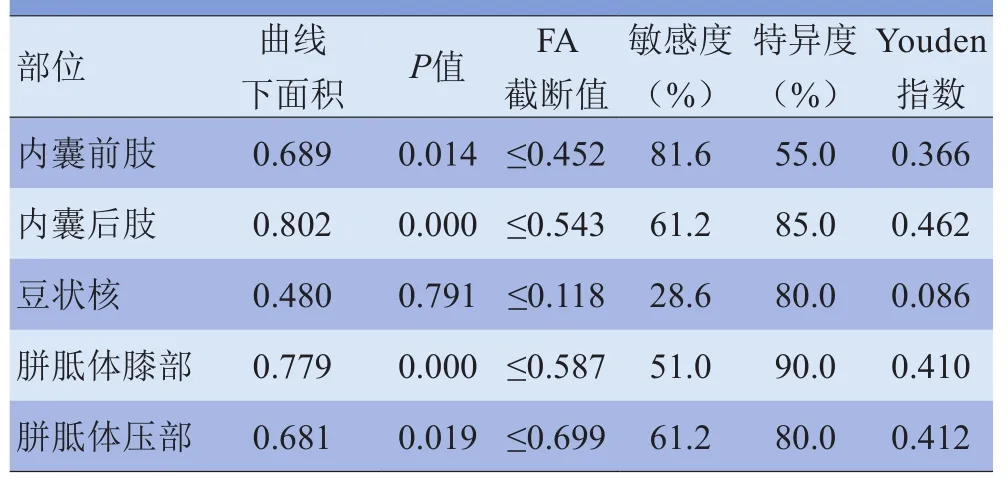
表2 FA值诊断HIE符合度的ROC曲线评价结果

表3 不同部位ROC曲线下面积两两比较结果
3 讨论
新生儿HIE是由于窒息引起的围生期脑组织缺血缺氧,包括急性全面性窒息和部分性或慢性窒息[4]。急性全面性窒息时,脑血流可完全阻断,多引起能量代谢较高的脑区损伤,如中心灰质(基底节和丘脑)、背侧脑干、海马及外侧膝状体,且损伤较重,多见于重度HIE;部分性或慢性窒息时,损伤相对较轻,此时血流优先分配给代谢旺盛的脑区,脑半球血流减少,脑皮层尤其是分水岭区皮层会因血流量减少而受损,主要见于轻度HIE。因此,HIE的病理改变与损伤程度密切相关,包括脑水肿、脑出血梗死、基底节损伤、脑室周围白质软化等[5]。HIE导致的脑白质损害是日后发生脑瘫和智力落后的重要原因,故评估HIE患儿脑白质损伤对早期诊断和早期干预治疗有重要意义[6]。
在人体中枢神经系统中,受细胞膜、髓鞘、神经纤维束等组织结构的影响,水分子在不同方向上的扩散能力不同,即各向异性。DTI以各向异性为基础,根据脑组织水的扩散情况,主要参数用FA值表示。FA值是扩散各向异性与整个扩散的比值,其范围为0~1。FA值越接近1,表明扩散趋于各向异性,提示纤维束的细胞膜、髓鞘及轴索完整性好;FA值越接近0,表明扩散趋于各向同性,即水分子扩散在各个方向上受到的限制趋于一致,提示纤维束受到破坏或发育不成熟,影响细胞膜、髓鞘及轴索方向的一致性[7]。本研究结果显示,HIE组ROI的FA值较对照组降低,且随着病情加重,下降趋势越来越明显,证实了上述观点。常规MRI在显示HIE患儿脑损伤方面具有明显的延迟性,而DTI可以在新生儿出生24 h内敏感地发现脑组织的缺血缺氧性改变。因此,FA值降低可作为早期脑白质损伤的敏感标志,在疾病早期即可以准确判断脑白质受损程度[8],其原因是缺血缺氧引起髓鞘形成障碍,甚至缺失、坏死,轴突生长障碍及数量减少,破坏了白质纤维束的完整性,水分子各向异性程度减低,导致FA值降低。左克扬[9]研究认为FA值下降程度与病情轻重呈明显正相关,可以客观地反映HIE的轻重程度,量化评估HIE患儿的病情。
本研究发现,对照组及不同程度HIE组胼胝体、内囊及豆状核的FA值依次降低,这种现象符合髓鞘发育从中心到外周、从背侧到腹侧、从尾端到头端的特点。Shimony等[10]的研究也证实了这一结论,联合纤维(胼胝体)、投射纤维(内囊)的各向异性依次减低,并且脑白质的各向异性明显高于灰质。比较HIE组和对照组各部位FA值差异显示,除豆状核外,其余各部位的FA值均低于对照组,两两比较差异均有统计学意义(P<0.05),表明缺血缺氧破坏了白质纤维束的完整性,与文献[11]报道相符。豆状核属于灰质,主要由神经元和血管组成,轴突髓鞘和白质纤维含量较少,扩散趋于各向同性,故在HIE中白质FA值减低的同时,灰质的FA值可以无明显变化,Sotak[12]的研究也得到类似的结果,因此FA值并不适用于评价灰质核团。本研究中,对照组与不同程度HIE组两两比较显示,对照组与轻度HIE组仅胼胝体膝部FA值差异有统计学意义(P<0.05),其余差异均无统计学意义(P>0.05),这可能是由于轻度缺血缺氧时脑损伤程度轻,神经细胞肿胀,部分细胞选择性凋亡,轴突及髓鞘膜数量无明显减少,白质纤维束完整性较好。但最早的白质损伤部位是否为胼胝体膝部,尚需要大数据研究进一步探讨。
各部位FA值对诊断HIE准确度进行ROC曲线分析,结果发现FA值诊断HIE的敏感度不是太高,最高者敏感度仅为81.6%,表明不能仅依靠FA值减低来诊断HIE,这可能是由于FA值反映的是白质损伤,而HIE引起脑损伤的病因复杂,FA值减低的影响因素也很多。此外,由于本研究中多为轻度HIE,中度及重度HIE病例较少,轻度HIE的FA值减低程度轻,共同影响了诊断HIE的敏感度,以后还需要更多大样本研究进一步证实。一般认为,ROC曲线下面积越大,诊断效能越高。本研究结果显示,内囊后肢的曲线下面积为0.802,截断点FA值为0.543,在各部位中的诊断效能最高。沈全力[13]研究内囊后肢FA值在≤7 d组中的ROC曲线下面积为0.863,在>7 d组中为0.904,均大于其他各部位的ROC曲线下面积,提示内囊后肢FA值变化在各部位中诊断HIE的准确度最高,与本研究结论一致。早期MRI研究发现,内囊后肢信号强度的改变是诊断HIE的可靠依据,重度HIE患儿内囊后肢T1WI信号常减低,内囊后肢损害常提示预后不良。本研究结果发现,内囊后肢的FA值除在对照组和轻度HIE组差异无统计学意义(P>0.05)外,其余两两组间比较差异均有统计学意义(P<0.05),可作为评估HIE病情轻重的参考,其原因可能是由于内囊后肢含有皮质脊髓束、丘脑中央辐射、视辐射、听辐射、皮质红核束及顶枕颞桥束等重要的白质投射纤维,受损后可能导致严重的神经运动功能损害,早期康复训练有助于减轻后遗症[14],对临床医师准确全面地了解病情,继而选择合理的治疗方案有很大帮助。
本研究的局限性在于:由于单次激发EPI技术伪影,部分图像出现扭曲;HIE患儿病情较危重,如何缩短检查时间;服用镇静药物后扫描,是否对DTI的FA值有影响;成像设备及参数设置不同使得FA值存在一定的差异,限制了FA值在临床上的广泛应用;样本量较小,缺乏大样本的对照研究;上述不足仍需进行大量更深入的研究。但随着DTI技术的不断发展和研究的不断深入,DTI在新生儿方面将会有更大的应用价值。
总之,DTI技术在新生儿HIE的早期诊断中具有重要意义,FA值可以量化评价脑损伤程度,其减低与脑损伤程度密切相关,其中内囊后肢FA值的诊断价值最大,能够为HIE的早期诊断和早期干预提供客观依据。
[1]Mary R,Christina M,Amy M,et al. Magnetic resonance imaging in hypoxic-ischaemic encephalopathy. Early Hum Dev,2010,86(6): 351-360.
[2]Gano D,Chau V,Poskitt KJ,et al. Evolution of pattern of injury and quantitative MRI on days 1 and 3 in term newborns with hypoxic-ischemic encephalopathy. Pediatr Res,2013,74(1): 82-87.
[3]中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准. 中国当代儿科杂志,2005,7(2): 97-98.
[4]Huang BY,Castillo M. Hypoxic-ischemic brain injury: imaging findings from birth to adulthood. Radiographics,2008,28(2):417-439,quiz 617.
[5]Thayyil S,Chandrasekaran M,Taylor A,et al. Cerebral magnetic resonance biomarkers in neonatal encephalopathy: a meta-analysis. Pediatrics,2010,125(2): e382-e395.
[6]Eilish T,Anne T,Stephanie R,et al. MR imaging of term infants with hypoxic-ischemic encephalopathy as a predictor of neuro-developmental outcome and late MRI appearances. Pediatric Radiol,2010,40(9): 1526-1535.
[7]陈锦佳,曾洪武,干芸根,等. 磁共振弥散张量成像在儿童偏瘫型脑瘫中的应用. 中国CT和MRI杂志,2013,11(5):10-13,41.
[8]Brissaud O,Amirault M,Villega F,et al. Efficiency of fractional anisotropy and apparent diffusion coefficient on diffusion tensor imaging in prognosis of neonates with hypoxic-ischemic encephalopathy: a methodologic prospective pilot study. Am J Neuroradiol,2010,31(2): 282-287.
[9]左克扬. MR-DTI在监测评价HIE患儿脑髓鞘发育及预后中的作用. 广州: 暨南大学,2005.
[10]Shimony JS,Mckinstry RC,Akbudak E,et al. Quantitative diffusion tensor anisotropy brain MR imaging:normative human data and anatomic analysis. Radiology,1999,212(3):770-784.
[11]Malik GK,Trivedi R,Gupta RK,et al. Serial quantitative diffusion tensor MRI of the term neonates with hypoxicischemic encephalopathy (HIE). Neuropediatrics,2006,37(6):337-343.
[12]Sotak CH. The role of diffusion tensor imaging in the evaluation of ischemic brain injury - a review. NMR Biomed,2002,15(7/8): 561-569.
[13]沈全力. 磁共振弥散张量成像在新生儿缺氧缺血性脑病中的应用及临床相关性研究. 上海: 复旦大学,2009.
[14]Schulz R,Park CH,Boudrias M,et al. Assessing the integrity of corticospinal pathways from primary and secondary cortical motor areas after stroke. Stroke,2012,43(8): U456-2248.
(本文编辑 张春辉)
Fractional Anisotropy of Diffusion Tensor Imaging in Evaluating Neonatal Hypoxic-ischemic Encephalopathy
杜 牧
2015-12-09
10.3969/j.issn.1005-5185.2016.04.003
Shenzhen Maternity and Child Healthcare Hospital,Shenzhen 518028,China
Address Correspondence to: DU Mu E-mail: dudumumu@163.com
深圳市科创委基础研究项目
(JCYJ20140416141331480,JCYJ20140414144755473)。
R722.1;R445.2
