响应面法优化酶解海洋低值鱼肉制备抗氧化肽工艺
2016-09-23曾健辉朱宝君孔繁茂马广智黄儒强
曾健辉,朱宝君,王 娟,孔繁茂,马广智,3*,黄儒强*
(1.华南师范大学生命科学学院,广东广州 510631;2.华南理工大学食品科学与工程学院,广东广州 510600;3.广东科学技术职业学院,广东珠海 519090)
接下表
响应面法优化酶解海洋低值鱼肉制备抗氧化肽工艺
曾健辉1,朱宝君1,王 娟2,孔繁茂1,马广智1,3*,黄儒强1*
(1.华南师范大学生命科学学院,广东广州 510631;2.华南理工大学食品科学与工程学院,广东广州 510600;3.广东科学技术职业学院,广东珠海 519090)
[目的]优化碱性蛋白酶制备海洋低值鱼抗氧化肽的工艺。[方法]以DPPH自由基清除率为指标,在酶解温度、pH、加酶量、底物浓度等条件下进行单因素试验,在此基础上运用响应面法优化碱性蛋白酶酶解低值鱼肉制备抗氧化肽的工艺条件。[结果]在温度54 ℃、pH 8.8、底物浓度200 g/L、加酶量2 500 U/g的条件下酶解3 h,得到抗氧化肽的DPPH自由基清除率理论值为62.66%,实际值为61.87%,相对误差为1.26%。[结论]该研究为低值鱼抗氧化肽的开发利用提供理论依据。
响应面法;酶解;低值鱼;抗氧化肽
随着我国经济与科技的快速发展,水产品的产量及加工能力不断提高,我国鱼类加工业较20年前已取得了很大进步,但与发达国家水产品加工业相比,仍存在基础研究薄弱、加工与综合利用率低、附加值低等问题[1-3]。低值鱼占海洋渔获物的60%~70%,具有体型小、营养丰富、种类繁多及产量巨大的优点,但由于其极易腐烂、价格较低使得捕捞与存储较为困难,再加上无有效的加工方法,造成生物资源的极大浪费[4-5]。提高低值鱼的精深加工与综合利用水平,对于我国经济和社会发展都有重要意义。
生物活性肽是指对生物机体的生命活动有益或具有生理作用的肽类化合物[6]。研究发现,生物活性肽比氨基酸更易吸收,具有抗高血压[7]、抗氧化[8]等作用。人类健康在内生或者外生自由基和氧化应激作用下稳态会失调,使细胞、组织和DNA受到损伤[9],同时自由基过多也会导致许多疾病如心血管疾病、癌症等的发生[10]。目前许多合成的抗氧化剂如叔丁基羟基茴香醚(BHA)、没食子酸丙酯(PG)等已广泛应用于食品保存或者抑制脂质过氧化[11],但合成抗氧化剂也有一定的危害[12]。来源于天然食品的抗氧化肽逐渐被广泛关注,目前研究者已从多种天然食品如鸭皮[13]、豆类[14]、扇贝[15]等中分离得到了抗氧化肽。笔者以海洋低值鱼为原料,通过碱性蛋白酶解鱼肉蛋白制备抗氧化肽,以DPPH自由基清除率为指标,利用响应面法设计优化低值鱼蛋白的酶解工艺条件,探索低值鱼的深加工途径,提高资源利用率和经济价值,为低值鱼抗氧化肽的开发利用提供理论参考。
1 材料与方法
1.1材料与试剂海洋低值鱼购自于市场,碱性蛋白酶(20万U/g)购自于江苏瑞阳生物有限公司,1,1-二苯基-2-三硝基苯肼(DPPH)购自美国Sigma公司,其他化学试剂均为分析纯。
1.2设备 电热恒温水浴锅:HWS12,上海一恒仪器公司;pH计:PB-10型,赛多利斯科学仪器有限公司;冷冻干燥机:VirTis,美国SP公司;台式高速冷冻离心机:CT15RT,天美科学仪器有限公司;恒温磁力搅拌器:85-2,上海思乐仪器厂;分析天平:BSA224S,赛多利斯科学仪器有限公司;紫外可见分光光度计:UV-5100B,上海元析仪器有限公司;粉碎机:DT-10A,广州市绿向生物科技有限公司。
1.3方法
1.3.1工艺流程。其工艺流程:低值杂鱼→清洗→取肉→匀浆→酶解→离心→上清液→冷冻干燥→成品分析。操作要求:①清洗匀浆。将新鲜的杂鱼去掉头、尾和内脏,清洗干净,然后取肉绞碎成鱼糜,按比例加入一定量的水,将鱼糜打成浆状。②酶解。将匀浆后的鱼肉在漩涡振荡器中混匀后置于恒温水浴锅中保温15 min,调节pH,加入适量酶进行酶解,酶解结束后立即在沸水浴中加热10 min灭酶,离心15 min(4 ℃,8 000 r/min),上清液冷冻干燥备用。
1.3.2DPPH清除率测定[16]。以95%乙醇溶液溶解DPPH,配成一定浓度溶液。吸取2 mL的酶解液,加入2 mL DPPH溶液,摇匀后,在室温下放置30 min,以95%乙醇溶液调零,测定517 nm处的吸光值A1,同时测定2 mL酶解液与2 mL 95%乙醇混合溶液在517 nm处的吸光值A2,再测定2 mL DPPH溶液与2 mL蒸馏水在517 nm处的吸光值A0,每组试验重复3次。
1.3.3单因素试验。在前期研究基础上,选用碱性蛋白酶对低值鱼肉进行酶解,以DPPH自由基清除率为指标研究加酶量(U/g)、酶解时间(h)、pH、酶解温度(℃)和底物浓度(g/L)5个单因素对酶解的影响。
1.3.4响应面试验。在单因素试验的基础上,在一定酶解时间(3 h)下,根据Box-Behnken的中心组合试验设计原理,进行4因素3水平的响应面分析试验,以加酶量(A)、pH(B)、温度(C)和底物浓度(D)4个因素为自变量,以DPPH自由基清除率为响应值,利用Design Expert 8.0.5b软件进行数据拟合,确定各因素对酶解物DPPH自由基清除率影响的显著性和各条件的最佳组合。编码水平见表1。
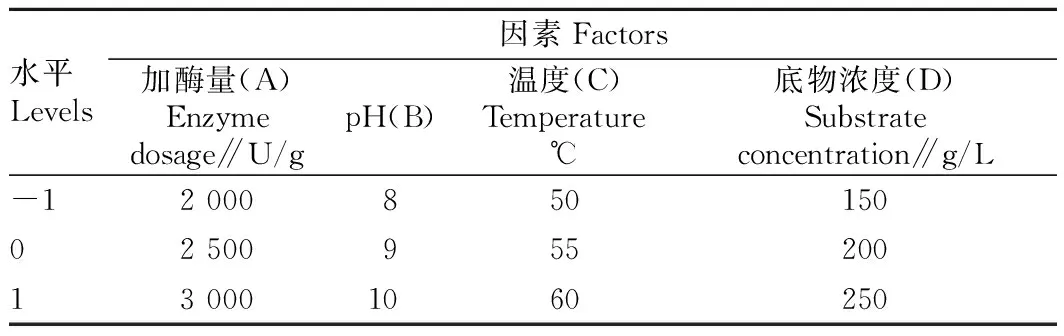
表1 响应面试验的因素和水平
2 结果与分析
2.1单因素试验
2.1.1时间对酶解的影响。由图1可知,随着时间的延长,酶解物的DPPH自由基清除率逐渐增大,当酶解时间超过3 h后DPPH自由基清除率逐渐下降,反应初期酶和底物浓度较大,反应速度快,当超过3 h后,由于底物被消耗,同时酶解产物对反应有一定的影响,DPPH自由基清除率上升缓慢,因此,选择酶解时间为3 h。
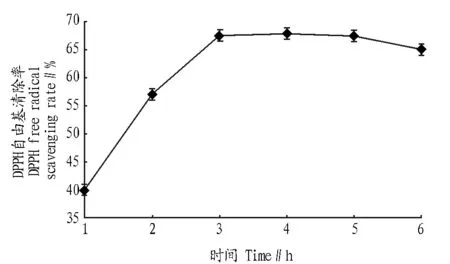
图1 时间对酶解的影响Fig.1 The influence of time to enzymatic hydrolysis
2.1.2底物浓度对酶解的影响。由图2可知,随着底物浓度的增大,酶解物的DPPH自由基清除率呈先上升后下降的趋势,在底物浓度为100~200 g/L时,酶解物的DPPH自由基清除率随底物浓度的增大而增大,底物浓度为200 g/L时达到最高,当底物浓度继续增大时,反应速率变化较小,因此,选择底物浓度为200 g/L。
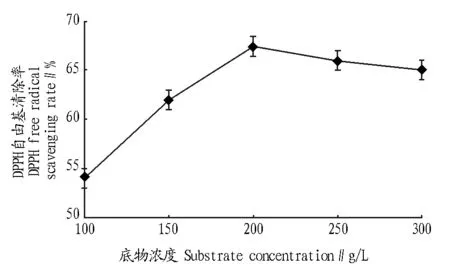
图2 底物浓度对酶解的影响Fig.2 The influence of substrate concentration to enzymatic hydrolysis
2.1.3温度对酶解的影响。由图3可知,酶解物的DPPH自由基清除率随温度的升高呈先上升后下降的趋势,在40~55 ℃,DPPH自由基清除率随着温度的升高而增大,55 ℃时达到最大,当温度高于55 ℃时,DPPH自由基清除率开始下降,这是因为酶有适宜的温度范围,温度过高会影响酶的活性,因此,选择酶解温度55 ℃。
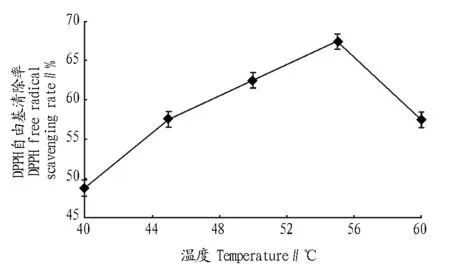
图3 温度对酶解的影响Fig.3 The influence of temperature to enzymatic hydrolysis
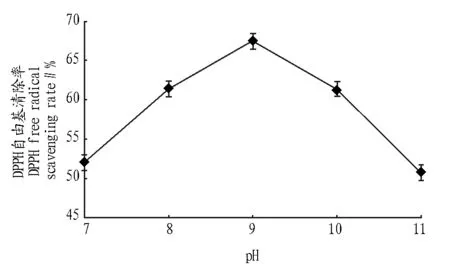
图4 pH对酶解的影响Fig.4 The influence of pH to enzymatic hydrolysis
2.1.4pH对酶解的影响。由图4可知,酶解物的DPPH自由基清除率随pH的升高呈先上升后下降的趋势。在pH 7~9时,DPPH自由基清除率随pH增大而增大。当pH为9时,DPPH自由基清除率达到最大。当pH超过9时,DPPH自由基清除率开始下降,酶解pH会影响酶的活性,过酸或者过碱都不利于反应的进行,因此,选择pH为9。
2.1.5加酶量对酶解的影响。由图5可知,随着加酶量的增大,酶解物的DPPH清除率呈先上升后稳定的趋势。在加酶量1 500~2 500 U/g时,DPPH自由基清除率逐渐增大,当加酶量大于2 500 U/g时,DPPH自由基清除率基本保持不变,为了节约成本选择加酶量2 500 U/g。
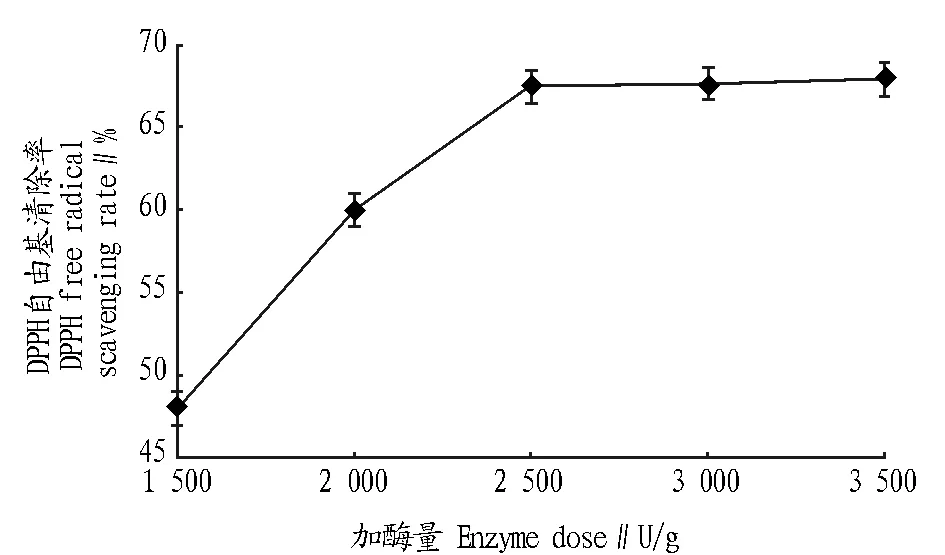
图5 加酶量对酶解的影响Fig.5 The influence of enzyme dose to enzymatic hydrolysis
2.2响应面法优化酶解海洋低值鱼肉制备抗氧化肽的工艺
2.2.1二次响应面回归模型的建立。选用中心复合模型,设计4因素3水平共29个试验点,其中24个析因点,5个中心点。响应面试验结果见表2。
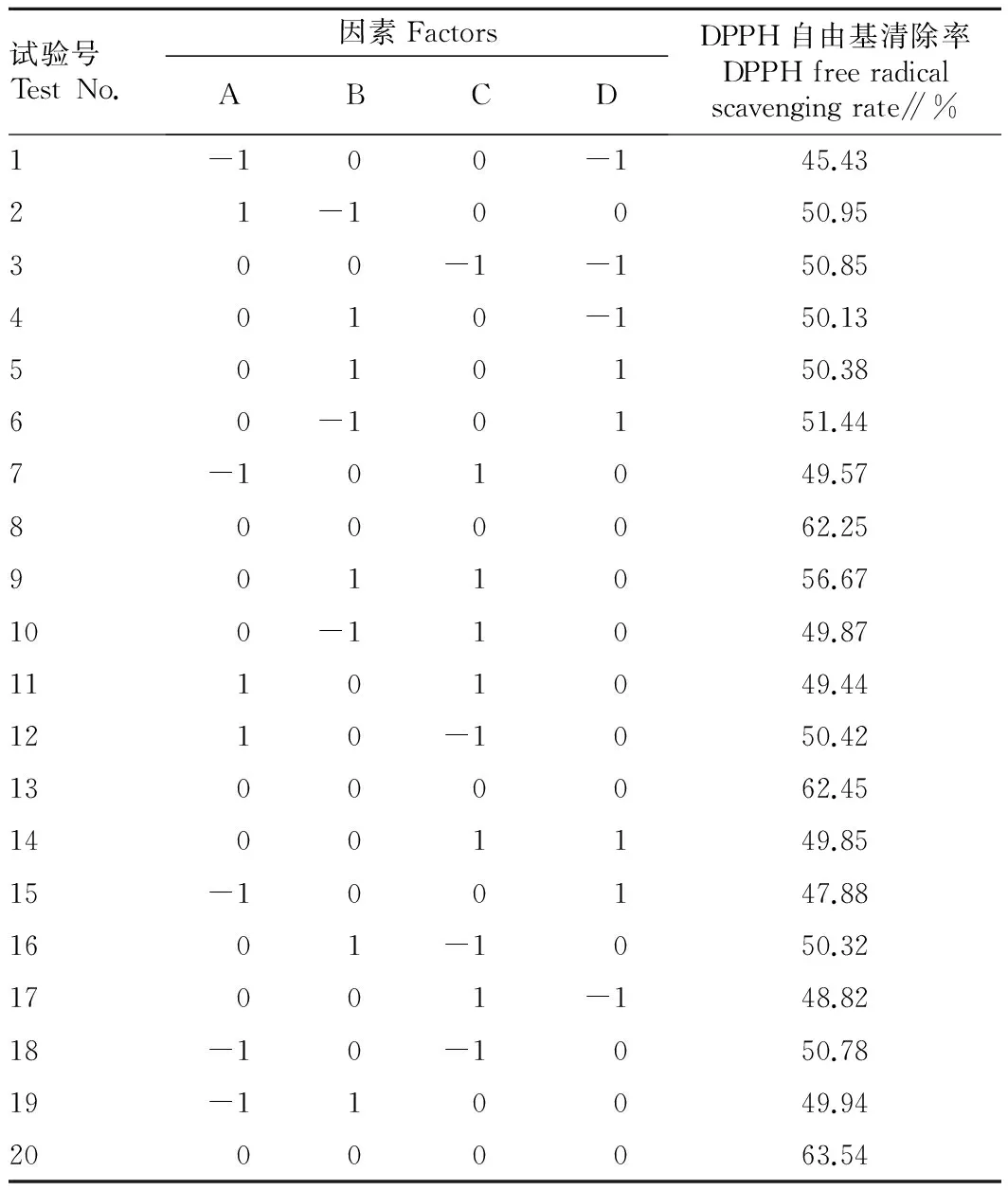
表2 响应面试验结果
接下表
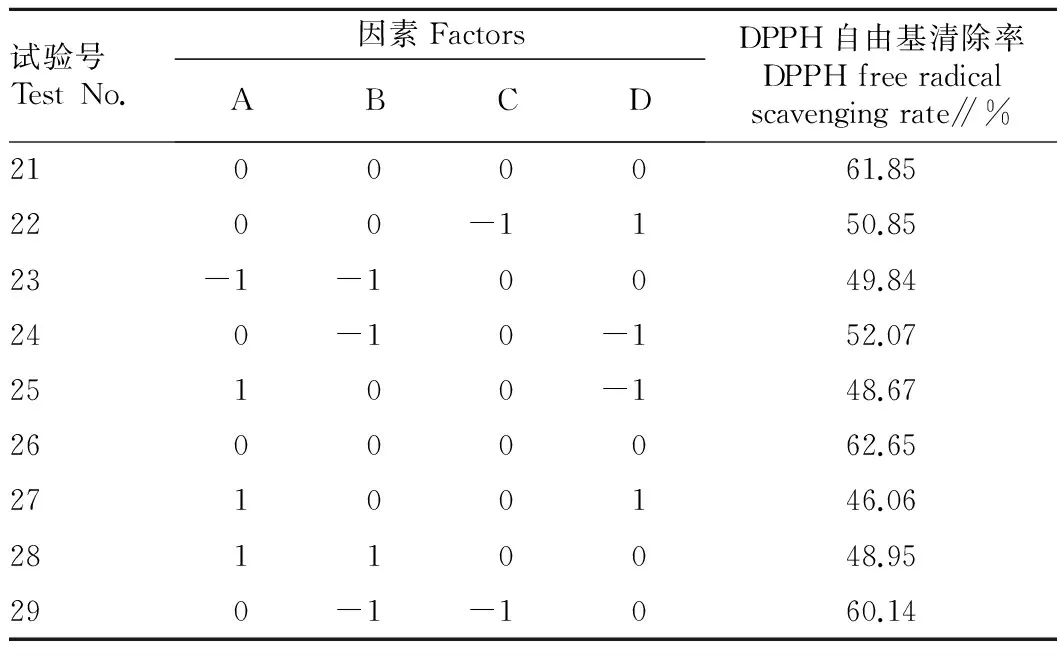
续表2
对响应面结果进行多元回归拟合,得到相应回归方程:DPPH自由基清除率 =62.55+0.088A-0.66B-0.76C+0.041D-0.53AB+0.057AC-1.27AD+4.16BC+0.22BD+0.26CD-8.17A2-4.07B2-4.46C2-7.61×D2,用 Design Expert8.0.5b软件对表2中的数据进行多元回归分析,回归统计分析结果表明,以DPPH自由基清除率为响应值时,回归方程拟合检测P<0.000 1,差异极显著,同时失拟项P=0.652 2>0.05,差异不显著,说明未知因素对试验干扰很小,模型拟合度较好,同时回归方程相关系数R2=0.994 2,说明响应值的变化有99.42%来源于所选变量。这说明试验方法可靠,能较好地描述各因素与响应值之间的真实关系。各因素对DPPH自由基清除率的影响程度由大到小依次为C(温度)、B(pH)、A(加酶量)、D(底物浓度),方差分析结果表明,AD、BC之间交互作用极显著,二次项A2、B2、C2、D2均极显著(P<0.001),表明各考察因素对酶解工艺参数的影响具有交互作用,而不是简单的线性关系。
2.2.2各因子交互作用的影响。图6是根据回归方程所绘制的响应面图,其中,各图表示A、B、C、D中任意2个变量取零水平时,其余2个变量对DPPH自由基清除率的交互影响,它们能直观地描述2个因素对响应值的交互影响。由图6可知,响应值随着加酶量、底物浓度、温度和pH的增大呈先增后降的趋势,说明这4个因素在所选范围内能产生最佳的响应值。

图6 各因子交互作用对抗氧化肽DPPH清除率的响应曲面Fig.6 The response surface of the influence of each factor interaction to DPPH scavenging rate
2.2.3验证试验。响应面分析得到的优化条件:加酶量2 505.13 U/g,温度54.19 ℃,底物浓度199.8 g/L,pH 8.84,根据实际情况调整参数为加酶量2 500 U/g,温度54 ℃,底物浓度200 g/L,pH 8.8进行验证试验,重复3次得到DPPH的自由基清除率为61.87%,相对误差为1.26%。
3 结论
该试验以DPPH自由基清除率为指标,在单因素试验的基础上进行响应面试验,利用响应面法得到了加酶量、温度、底物浓度和pH对DPPH自由基清除率的影响。各因素对DPPH自由基清除率的影响由大到小依次为温度、pH、加酶量、底物浓度,通过响应面分析得到低值鱼制备抗氧化肽的酶解条件:加酶量2 500 U/g,温度54 ℃,底物浓度200 g/L,pH 8.8,在此条件下,DPPH的自由基清除率为61.87%。
[1] 赵永锋,胡海彦,蒋高中,等.我国大宗淡水鱼的发展现状及趋势研究[J].中国渔业经济,2012,59(30):91-99.
[2] 柏芸,熊善柏.我国淡水鱼加工业现状、问题与对策[J].湖北农业科学,2010,49(12):3059-3061.
[3] 张玫,霍增辉,易法海.我国水产品加工业规模与结构的现状与对策[J].改革与战略,2006,10:96-98.
[4] 陈培基,李刘冬,李来好,等.利用小杂鱼、低值鱼提取浓缩鱼蛋白[J].湛江海洋大学学报,1993,19(1):38-43.
[5] 段蕊,张俊杰.海洋低值小杂鱼的加工方向和现状[J].食品与发酵工业,2000,26(6):63-56.
[6] 李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3-8.
[7] GHASSEM M,BABJI A S,SAID M,et al.Angiotensin I-converting enzyme inhibitory peptides from snakehead fish sarcoplasmic protein hydrolysate[J].Journal of food biochemistry,2014,38:140-149.
[8] NIMALARATNE C,BANDRAR N,WU J P.Purification and characterization of antioxidant peptides from enzymatically hydrolyzed chicken egg white[J].Food chemistry,2015,188:467-472.
[9] PARK P J,JUNG W K,NAM K S,et al.Purification and characterization of antioxidant peptides from lecithin-free egg yolk[J].Journal of American oil chemistry society,2001,78:651-656.
[10] HARNEDY P A,FITZGERALD R J.Bioactive peptides from marine processing waste and shellfish:A review[J].Journal of functional foods,2012,4:6-24.
[11] WILLIAMS G M,IATROPOULOS M J,WHYSNER J.Safety assessment of butylated hydroxyanisole and butylated hydroxytoluene as antioxidant food additives[J].Food and chemical toxicology,1999,37:1027-1038.
[12] CHALAMAIAH M,KUMAR D B,HEMALATHA R,et al.Fish protein hydrolysates:Proximate composition,amino acid composition,antioxidant activities and applications:A review[J].Food chemistry,2012,135:3020-3038.
[13] LEE S J,CHEONG S H,KIM Y S,et al.Antioxidant activity of a novel synthetic hexa-peptide derived from an enzymatic hydrolysate of duck skin by-products[J].Food and chemical toxicology,2013,62:276-280.
[14] MORA P G,FRIAS J,PENAS E,et al.Simultaneous release of peptides and phenolics with antioxidant,ACE-inhibitory and anti-inflammatory activities from pinto bean(PhaseolusvulgarisL.var.pinto)proteins by subtilisins[J].Journal of functional foods,2015,18:319-332.
[15] 曾庆祝,许庆陵,林鲁萍.扇贝边酶解物抗氧化作用研究[J].中国生化药物杂志,2005,26(2):86-89.
[16] WU H C,CHEN H M.Free amino acids and peptides as related to antioxidant propertiesin protein hydrolysates of mackerel(Scomberaustriasicus)[J].Food reserch international,2003,36(9/10):949-957.
Optimization of Enzymatic Hydrolysis of Antioxidant Peptides from Low Value Fish by Response Surface Methodology
ZENG Jian-hui1, ZHU Bao-jun1, WANG Juan2, MA Guang-zhi1,3*, HUANG Ru-qiang1*et al
(1. School of Life Science, South China Normal University, Guangzhou, Guangdong 510631; 2. School of Food Science and Engineering, South China University of Technology, Guangzhou, Guangdong 510600; 3.Guangdong Institute of Science and Technology, Zhuhai, Guangdong 519090)
[Objective] Optimization of antioxidant peptides from marine low value fish by alkaline protease was studied. [Method] The enzymatic hydrolysis conditions for the preparation of antioxidant peptides were optimized using the response surface methodology based on single factor experiments, including hydrolysis temperature, hydrolysis pH, enzyme dose and substrate concentration. [Result] The results showed that the optimal enzymatic hydrolysis conditions were as follows: substrate concentration 200 g/L, enzyme dose 2 500 U/g, pH 8.8, hydrolysis temperature 54 ℃ for 3 h, under these conditions the theoretical value of DPPH free radical scavenging rate was 62.66%, the actual value was 61.87%, the relative error was 1.26%. [Conclusion] The study can provide theoretical basis for development and utilization of antioxidant peptide of low value fish.
Response surface methodology; Enzymatic hydrolysis; Low value fish; Antioxidant peptides
广东省产学研项目(2013B090600153);广东省科技计划项目(2013B020312004);广东省海洋渔业科技推广专项科技攻关项目(A201301C10)。
曾健辉(1989- ),女,山西大同人,硕士研究生,研究方向:天然产物的提取与分离。*通讯作者,马广智,教授,博士,博士生导师,从事水生动物毒理学方面的研究。*通讯作者,黄儒强,教授级高级工程师,博士,硕士生导师,从事天然产物分离方面的研究。
2016-06-17
S 985.1
A
0517-6611(2016)22-080-04
