蜂胶对烟曲霉抑菌机制的体外研究
2016-09-23陈艺杰徐晓兰缪晓青吴珍红
沈 菲 陈艺杰 徐晓兰 缪晓青 吴珍红
(1福建农林大学,福州350002;2福建农林大学蜂疗研究所,福州 350002;3天然生物毒素国家地方联合工程实验室,福州 350002)
蜂胶对烟曲霉抑菌机制的体外研究
沈菲1,2陈艺杰1,2徐晓兰1,2,3缪晓青1,2,3吴珍红1,2,3
(1福建农林大学,福州350002;2福建农林大学蜂疗研究所,福州 350002;3天然生物毒素国家地方联合工程实验室,福州 350002)
探讨蜂胶对烟曲霉的抗菌作用及其作用机制,为蜂胶临床治疗由烟曲霉引起的疾病提供参考依据。本文采用不同浓度(10、20、30、40、50、100、150、200 mg/ml)的蜂胶乙醇提取物(EEP)处理烟曲霉孢子,结果发现,其存在剂量依赖性,接着琼脂稀释法测定蜂胶的最小抑菌浓度(MIC),将烟曲霉与1/2MIC50EEP孵育3d后发现,蜂胶组烟曲霉菌丝的重量和呼吸速率显著低于对照组,且蜂胶组孢子的超微结构严重受损。通过半定量PCR分析磷脂腺肌醇信号通路相关的表达情况,发现蜂胶组PKC基因与对照组相比呈现下调趋势。这些结果暗示,蜂胶能够抑制烟曲霉的生长,具有治疗由烟曲霉引起的疾病的潜力,是一种有前途的生物活性化合物。
蜂胶;烟曲霉;体外研究;PKC;作用机制
引言
蜂胶是蜜蜂采集胶源植物芽孢或树脂,与上颚腺、蜡腺分泌物混合加工得到的具有特殊芳香性的胶状产物[1],含有类黄酮、氨基酸、维生素等多种成分[2]。它拥有广泛的生物属性,包括抗氧化[3]、抗菌[4]、消炎[5]、保肝[6]、抗肿瘤[7]及免疫调节[8]等。最常见的应用之一就是其对许多革兰氏阳性和革兰氏阴性细菌、酵母和真菌的抗菌活性。最近,一些研究表明,蜂胶具有很强的抗真菌活性,如抑制炭疽菌的遗传转化及球二孢属、意大利青霉和青霉属的生长[9]。
烟曲霉是浅部感染的常见病原菌,主要感染免疫低下患者,其导致的侵袭性曲霉病死亡率达到30~90%。同时烟曲霉也会侵袭皮肤,导致皮肤发炎[10]。目前治疗由烟曲霉引起的疾病的药物主要是化学合成的。随着这些药物的广泛应用,在抗真菌治疗中遇到了耐药性、不良反应多等问题,导致治疗真菌感染越来越困难,因此迫切需要寻找天然的抗真菌药物[11]。
蛋白激酶C(PKC)是由相关蛋白构成的一个大家族[12],参与酵母菌菌丝及哺育动物细胞周期进程的调控和信号传导[13]。同时PKC参与磷脂酰肌醇信号通路,调节Ca2+离子通路,为生物的生长发育的重要途径[14]。
蜂胶为天然产品,具有广谱抗菌、不良反应小、较少出现耐药等优点。因此,蜂胶可以用于治疗真菌引起的疾病。虽然蜂胶抗真菌的研究开发已引起人们的重视,但主要还是局限于蜂胶对白色念珠菌的抑制作用,对其机制的研究和报道很少[15-19]。因此,深入研究蜂胶对烟曲霉的抑菌机理,寻找蜂胶对烟曲霉的作用靶点,为蜂胶治疗由烟曲霉引起的疾病提供科学依据。
1 材料
烟曲霉分离株,分离号:AS3.3572,购自上海北诺生物科技有限公司。毛胶购自神蜂科技开发有限公司,阳性药物伊曲康唑购自某药店。乳酸酚棉蓝染色液为上海源叶生物科技有限公司。微量呼吸仪,SKW-3型,上海科技大学。
2 方法
2.1EEP的制备
将毛胶置于-20℃冰箱中冷冻2 h以上,经粉碎机粉碎后,过80目筛网,粉末按料液比为1∶4加入70%乙醇(v/v),25℃恒温振荡48 h后,过滤除杂,40℃真空旋转蒸发去除酒精,然后放入60℃烘箱干燥至恒重,得到蜂胶浸提膏。用时,70%乙醇配成不同浓度,0.22μm无菌过滤膜过滤灭菌。
2.2孢子悬液的制备
烟曲霉在35℃的恒温箱中培养3天后,用0.1%的吐温80的生理盐水冲洗培养基,无菌纱布除去洗脱液中的菌丝,用血球细胞计数板调整分生孢子悬液的浓度为1.0×106~5.0×106CFU/ml,4℃保存24 h。
2.3不同浓度EEP抑制烟曲霉生长
利用打孔琼脂培养法分别测定浓度为10、20、30、40、50、100、150 mg/ml的EEP对烟曲霉菌的抑菌圈大小。70%乙醇作为阴性对照,无菌水作为空白对照,伊曲康唑作为阳性对照。
2.4琼脂稀释法测定EEP的MIC
EEP按不同体积加入到培养基中,使其终浓度分别为:100 μg/ml、200 μg/ml、300 μg/ml、400 μg/ml、500 μg/ml、1000μg/ml。待冷却至室温后,用枪头吸取5μL孢子悬液扎入培养基中,同时设立溶剂组(加70%乙醇),阳性对照组(添加伊曲康唑),阴性对照组(不加药物也不加孢子悬液),空白对照组(加无菌水)。35°C连续培养7 d后观察结果,将固体培养基中无菌落生长的浓度确定为最小抑菌浓度(MIC)。
2.5EEP对烟曲霉菌丝重量及细胞超微结构的影响
2.5.1菌丝称量
所有菌丝体采用液体培养,加入EEP,使其终浓度为1/2MIC50,加入孢子悬液,使其终浓度为106CFU/ml,同时设立如2.4所示的溶剂组、阳性对照组、空白对照组。35°C、180rpm培养3d后收集菌丝,用pH=7.4的无菌PBS12000rpm离心10min,共漂洗3次,弃去废液,将菌丝挑出移到一干净的离心管中,置于干燥箱中干燥至恒重后,称量菌体干重。
2.5.2显微观察
用接种针挑取实验2.4中1/2MIC50平板上的烟曲霉孢子到载玻片上,用乳酸酚棉蓝染色。将载玻片置于普通光学显微镜观察,比较其菌丝及孢子形态和孢子数量的变化。
2.6EEP对烟曲霉呼吸的影响
烟曲霉的呼吸率表示为耗氧量。耗氧量测量是利用微量呼吸仪进行测定的。具体方法如下,0.1ml 1.0× 106CFU/ml孢子悬液和EEP添加进10ml PDA液体培养基中,混匀后吸取2ml到微量呼吸瓶中,添加0.5 ml 0.1mol/L的NaOH吸收瓶中,吸收瓶中另加1×3cm的滤纸片,以增大吸收面。整个反应装置在35℃水浴摇动培养,每4h记录液面下降的高度。通过公式:
XO2=K·h(1)
其中:XO2为耗氧量 (uL/h),K为反应瓶常数,h为测压管开口端液面下降量。
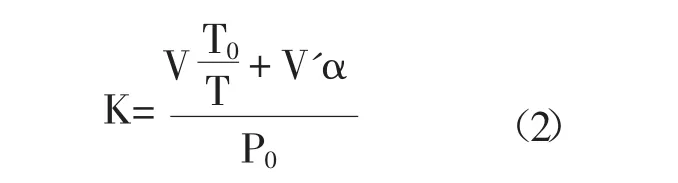
其中:K为反应瓶常数,V为反应瓶至测压臂右端规定刻度之空间容积减去V'和NaOH溶液、滤纸的体积,V'加入反应瓶中的溶液量,T0为273+水浴温度(35℃),T为273,α为O2在37℃下液体中的溶解度,P0在一个大气压下,压力计中胆酸钠液面应呈现的高度,通常以1000计算。
未添加EEP作为空白对照组,添加70%乙醇作为溶剂组。
2.7RNA提取和RT-PCR
1/2MIC50EEP处理烟曲霉后,离心收集菌丝,利用TransZol up(北京全式金有限公司)提取菌丝体的RNA,参照TaKaRa公司PrimeScripTM RT reagent Kit with gDNA Eraser试剂盒合成cDNA。然后用北京艾德莱生物技术有限公司super PCR mix反应体系进行半定量PCR。以GAPDH为内参,引物序列如下。GAPDHF:5’-GAAGAGTGCGACCTATGA-3’和GAPDHR:5’-CGAGATACCAGCCTTGATA-3’)及PKCF:5’-AAGTTCTGTTGGCTCTCA-3’和PKCR:5’-AATCTTGATGTGTCCGTCTA-3’)。PCR条件为:94℃预变性3 min,然后94℃变性30 s,60℃退火30 s,72℃延伸10 min,共36个循环,循环结束后72℃保持10 min。PCR结束后,取5 μL进行琼脂糖电泳检测,将琼脂糖胶拍照后对其条带用J Image软件进行灰度分析。
3 数据分析
4 结果
4.1不同浓度EEP对烟曲霉抑制作用
不同浓度蜂胶处理烟曲霉后,蜂胶组抑菌圈直径显著高于对照组(P<0.05),且呈现剂量依赖性,但是当蜂胶浓度达到100 mg/ml时达到饱和状态(如图1)。
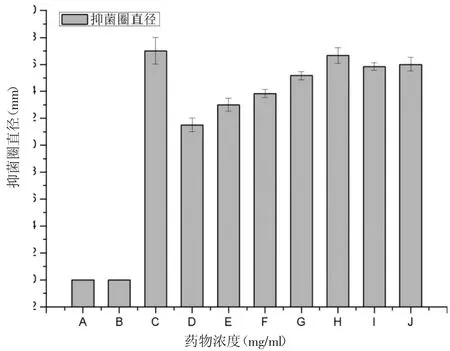
图1 不同浓度EEP对烟曲霉抑菌圈直径的影响注:A表示无菌水;B表示溶剂组;C表示阳性对照组;D、E、F、G、H、I、J分别表示10、20、30、40、50、100、150 mg/ml的EEP。
4.2平板稀释法测定EEP对烟曲霉的MIC
本文比较了烟曲霉在蜂胶含量不同的PDA平板上7d的生长情况,结果显示当EEP浓度为1000μg/ml时,烟曲霉不能生长,即EEP的MIC为1000μg/ml(图2)。从图2中可以看出:空白对照组的生长速度明显要快于蜂胶组。
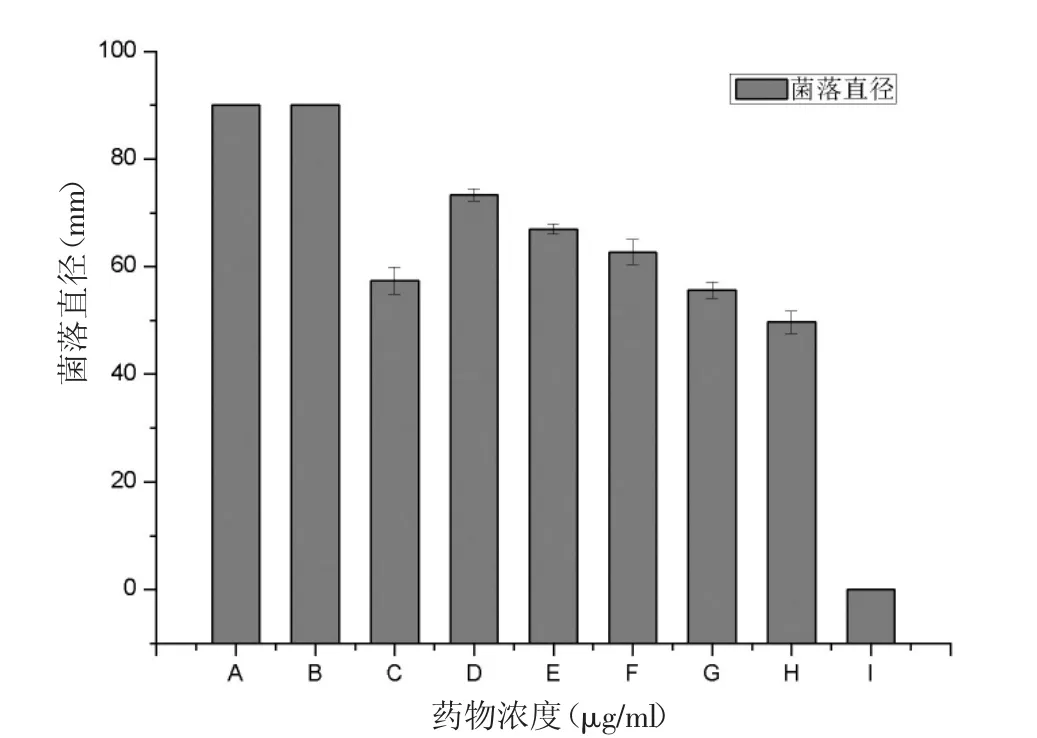
图2 蜂胶抗烟曲霉琼脂平板稀释法药敏实验注:A表示空白对照组;B表示溶剂组;C表示阳性对照组;D、E、F、G、H、I分别表示 100、200、300、400、500、1000μg/ml的EEP。
4.3EEP对烟曲霉菌丝重量及超微结构的影响
表1 蜂胶对烟曲霉菌丝重量的影响(±s)
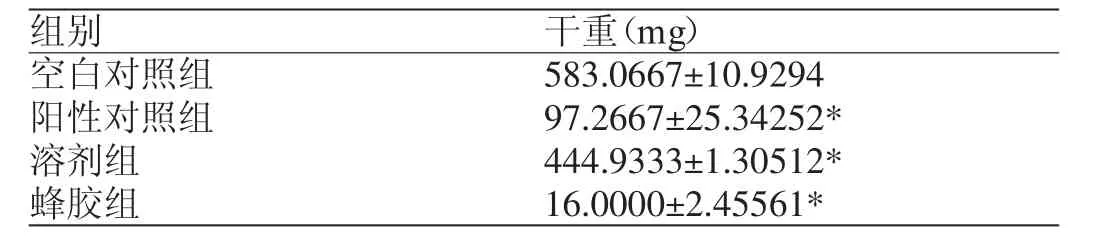
表1 蜂胶对烟曲霉菌丝重量的影响(±s)
注:与空白对照组相比,*P<0.05;n=3
组别 干重(mg)空白对照组 583.0667±10.9294阳性对照组 97.2667±25.34252*溶剂组 444.9333±1.30512*蜂胶组 16.0000±2.45561*
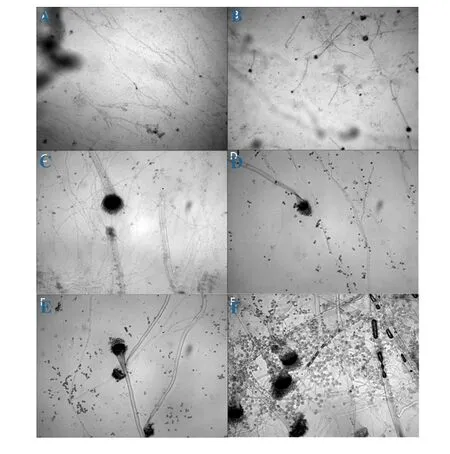
图3 蜂胶对烟曲霉形态的影响注:A、C表示空白对照组,B、D、E、F表示500μg/ml蜂胶处理组
表1结果表明,对照组烟曲霉的干重为583.0667± 10.9294 mg,而蜂胶组的干重为16.0000±2.4556 mg,阳性对照组的干重为97.2667±25.3425 mg。说明蜂胶和伊曲康唑都抑制了烟曲霉的生长。
乳酸酚棉兰染色后,在200和400倍光学显微镜下可以清楚的看到空白对照组和蜂胶组的烟曲霉,其显微结构存在显著差异(图3):正常烟曲霉的分生孢子梗无分隔,分生孢子头为柱状,顶囊呈半圆形,菌丝排列整齐(图3-A、C);而蜂胶作用后的烟曲霉形态发生了改变,在图3-B、D、E、F组中,可以看出此时的烟曲霉的分生孢子链变长,分生孢子梗出现分隔(图3-F),部分细胞顶囊发育不完全(图E);从图3-A、B的对比可以看出,蜂胶组的烟曲霉菌丝明显较空白对照组烟曲霉菌丝不规则。
4.4EEP对烟曲霉呼吸的影响
如图4所示,蜂胶明显降低烟曲霉孢子的呼吸率。培养20 h后,蜂胶组烟曲霉的耗氧速率(2.067±0.5686 μL/h)显著低于空白对照组(6.000±0.2646 μL/h)。因此,蜂胶干扰烟曲霉孢子萌发和菌丝的生长阶段的能量代谢系统。
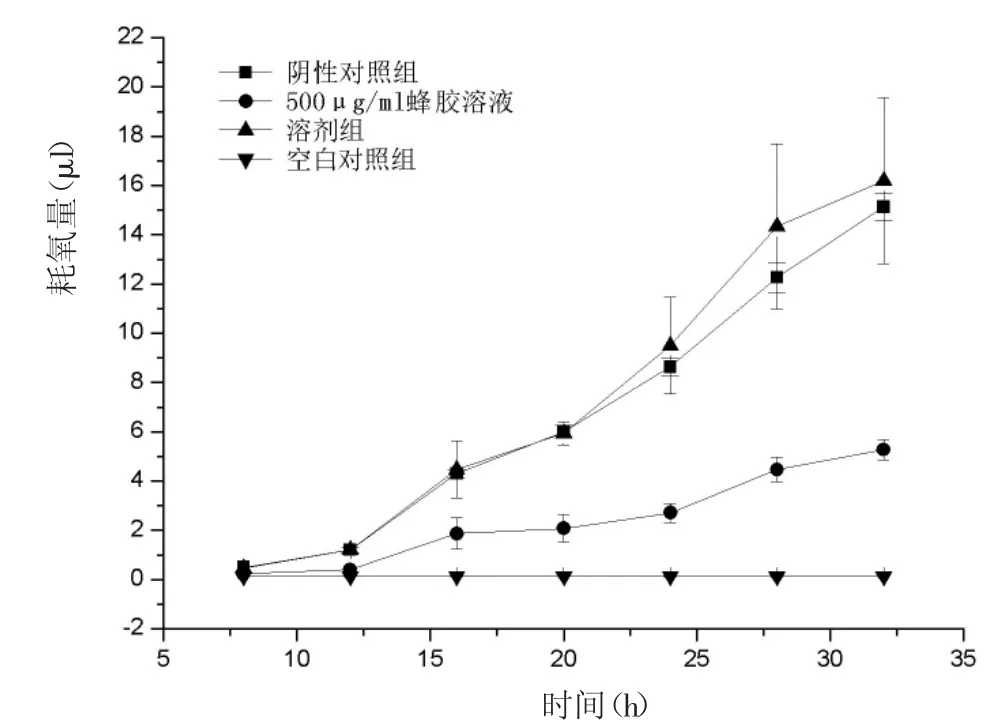
图4 EEP对烟曲霉呼吸的影响
4.5EEP对烟曲霉PKC基因的影响
将图5中得到的琼脂糖电泳图各条带进行灰度分析,将目标基因PKC条带的灰度值与内参基因GAPDH进行比较,发现烟曲霉PKC基因在实验组中比对照组中表达降低了37.2倍(图6)。因此,蜂胶对烟曲霉PKC基因的表达有下调作用,推测蜂胶可以通过抑制烟曲霉PKC基因的表达抑制烟曲霉菌的生长。
5 讨论与结论
蜂胶是一种比较复杂的化合物,可能的单体化合物有200多种,其中最主要的两大类成分为黄酮和酚酸。现目前能够分离出来的活性成分主要有咖啡酸酯、高良姜素、咖啡酸苯乙酯、松属素等。高良姜素、咖啡、肉桂酸是蛋白酶抑制剂,负责阻止细菌生长和增殖。其他黄酮类化合物,如槲皮素,影响膜电位,从而导致细胞膜透性上升,抑制细菌活性。很明显,蜂胶的抗菌活性的机制是复杂的[20]。蜂胶具有抗真菌活性主要归功于黄酮类、酚酸类以及酯类,这些化合物统称酚类化合物[21]。黄酮类成分中高良姜素、松属素、槲皮素等已确认对真菌有很强的抑制作用[22];最近,Agüero等人从阿根廷当地的蜂胶中分离出来的木酚素、白杨素、松属素和高良姜素鉴定为当地蜂胶的主要抗真菌化合物[23]。酚酸类物质及其衍生物也表现强烈的活性,Boonsai等从泰国意蜂蜂胶中分离出了腰果酚,发现腰果酚是泰国意蜂蜂胶的主要抗菌化合物之一,该结果与Silva等研究的巴西蜂胶中抗菌化合物结果一致,酚类化合物的含量越高,抗菌效果越好[24-25]。萜类物质也有很强的抑菌作用:Sirikarn等从Tetragonula laeviceps蜂胶中分离出氧杂蒽酮,三萜烯和木酚素。其中三萜烯是这种蜂胶的主要抗菌活性成分[26]。
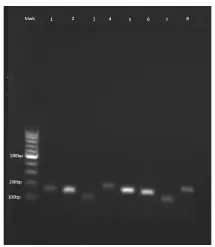
图5 烟曲霉PKC基因半定量PCR琼脂糖电泳图
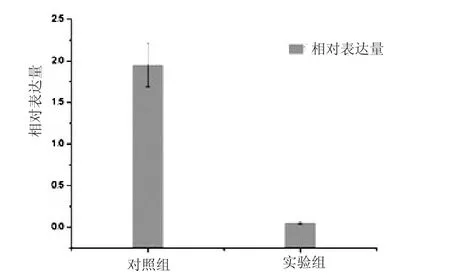
图6 EEP对烟曲霉PKC基因的影响
FaLcao等人研究了不同蜜源植物的蜂胶对三种真菌的抑制作用,其中对烟曲霉的抗菌活性最强,且随着酚类物质含量的不同,抗菌活性也有所不同[15]。该结果与本文的研究结果相同,随着蜂胶浓度的升高,酚类物质的含量也相应升高,所形成的抑菌圈也相应的增大,当浓度达到100 mg/ml时,蜂胶在琼脂平板中的扩散达到饱和。
烟曲霉的繁殖周期分为二个时期:茵丝发育的营养生长期和产生分生孢子的无性繁殖期[27]。因此,影响烟曲霉繁殖周期都会导致烟曲霉的生长受到抑制。本文的研究结果首次表明,蜂胶可以改变烟曲霉的形态,使其产孢率减少,从而抑制烟曲霉的繁殖与生长。通过电子显微镜观察(如图3-B、D、E、F),得出很有可能是蜂胶通过某些抗菌活性物质通过渗透方式进入烟曲霉细胞内,干扰细胞内的某些信号通路和相关基因的表达,抑制烟曲霉的生长及分生孢子的产生,从而达到抑制烟曲霉的目的。
呼吸是大多数微生物萌发和生长过程中所需的能量主要来源,破坏微生物的能量系统是某些药物具有抗菌活性机制之一,如壳聚糖、甘草查尔酮A和C[28-30]。有研究表明,蜂胶中的松属素对意大利青霉呼吸会产生影响,松属素通过直接抑制线粒体的呼吸,导致ATP、能量载体减少,进而导致烟曲霉的代谢紊乱[9]。本文首次提出蜂胶抑制烟曲霉的呼吸,抑制孢子萌发与菌丝的生长,干扰菌体的能量代谢系统。
PKC参与磷脂酰肌醇信号通路,参与Ca2+的调节[14]。在磷脂酰肌醇信号通路中磷脂酶C(PLC-β)与PKC为最主要的调控蛋白之一,活化的PLC-β使4,5-二磷酸磷脂酰肌醇(PIP2)水解成1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DG),DG可活化PKC,IP3与其配体结合打开钙调磷酸酶信号通路。PKC可以使丝氨酸/苏氨酸残基磷酸化,导致不同的细胞产生不同的反应,如细胞分泌、细胞增殖和分化等[31]。因此,当PKC基因表达受到抑制后,就会导致钙调通道及其磷脂酰肌醇信号通路受到影响,可能会导致烟曲霉生长受到抑制。
[1]王储炎,范涛,吴传华,等.蜂胶的研究[J].农产品加工.学刊,2009 (1):16-18.
[2]Bankova V S,de Castro S L,Marcucci M C.Propolis:recent advances in chemistryand plant origin[J].Apidologie,2000,31(1):3-16.
[3]Lima B,Tapia A,Luna L,et al.Main flavonoids,DPPH activity,and metal content allowdetermination ofthe geographical origin ofpropolis from the province of San Juan Argentina[J].Journal of agricultural and food Chemistry,2009,57(7):2691-2698.
[4]Majiene D,Trumbeckaite S,Pavilonis A,et al.Antifungal and antibacterial activity of propolis[J].Current Nutrition&Food Science,2007,3(4):304-308.
[5]Büyükberber M,Sava MC,Ba ci C,et al.The beneficial effect of propolis on cerulein-induced experimental acute pancreatitis in rats[J].Turk J Gastroenterol,2009,20(2):122-8.
[6]杜夏,孙丽萍,徐响.蜂胶及活性成分保肝作用的研究进展[J].食品科学,2012,33(5):305-308.
[7]Kawabe M,Lin C,Kimoto N,et al.Modifying effects of propolis on MeIQx promotion of rat hepatocarcinogene sis and in a female rat two-stage carcinogenesis model after multiple carcinogen initiation[J]. Nutrition and cancer,2000,37(2):179-186.
[8]Sforcin J M.Propolis and the immune system:a review[J].Journal ofethnopharmacology,2007,113(1):1-14.
[9]Peng L,Yang S,Cheng Y J,et al.Antifungal activity and action mode of pinocembrin from propolis against Penicillium italicum[J]. Food Science and Biotechnology,2012,21(6):1533-1539.
[10]Jousson O,Léchenne B,Bontems O,et al.Secreted subtilisin gene familyin Trichophyton rubrum[J].Gene,2004,339:79-88.
[11]Iwazaki R S,Endo E H,Ueda-Nakamura T,et al.In vitro antifungal activity of the berberine and its synergism with fluconazole[J]. Antonie van Leeuwenhoek,2010,97(2):201-205.
[12]张文玲,黄秀英,孙方臻.PKC亚型在细胞周期调控中的作用[J].细胞生物学杂志,2002,24(2):90-93.
[13]Darieva Z,Han N,Warwood S,et al.Protein kinase C regulates late cell cycle-dependent gene expression[J].Molecular and cellular biology,2012,32(22):4651-4661.
[14]LENDENFELD T,KUBICEK C.Characterization and properties of protein kinase C from the filamentous fungus Trichoderma reesei[J]. Biochem.J,1998,330:689-694.
[15]Falc o S I,Vale N,Cos P,et al.In Vitro Evaluation of Portuguese Propolis and Floral Sources for Antiprotozoal,Antibacterial and Antifungal Activity[J].PhytotherapyResearch,2014,28(3):437-443.
[16]de Castro P A,Bom V L P,Brown N A,et al.Identification of the cell targets important for propolis-induced cell death in Candida albicans[J].Fungal Genetics and Biology,2013,60:74-86.
[17]Pereira ES,JrMartins RS,lama SM,el a1.Effect of commercial ethanol propolis extracton the in vitro growth of Candida albicans collected fromHIV-seropositive and HIV-seronegalive Brazilian patients with oral candidiasis[J].JOral Sci,2002,44:41-48.
[18]Shinobu CS,Oliveira AC,Longhini R,e ta1.Antifungal activity of propolis extract against yeasts isolated from onychomycosis lesions[J]. MemInst OswaldoCruz,2006,101:493-497.
[19]Unterkircher C,Ota C,Fantinato V,et a1.Antifungal activity of Propolis on different species of Candida[J].Mycoses,2001,44:375-378.
[20]Grenho L,Barros J,Ferreira C,et al.In vitro antimicrobial activity and biocompatibility of propolis containing nanohydroxyapatite [J].Biomedical Materials,2015,10(2):025004.
[21]Ghisalbert E.Propolis:a review[J].Bee World,1979,60:59-84.
[22]Burdock GA.Review of the biological properties and toxicity of
bee propolis[J].Food Chem Toxic,1998,36:347-363.
[23]Agüero M B,Svetaz L,Baroni V,et al.Urban propolis from San Juan province(Argentina):Ethnopharmacological uses and antifungal activity against Candida and dermatophytes[J].Industrial Crops and Products,2014,57:166-173.
[24]Boonsai P,Phuwapraisirisan P,Chanchao C.Antibacterial activity of a cardanol from Thai Apis mellifera propolis[J].International journal of medical sciences,2014,11(4):327.
[25]Silva MSSS,de Lima G,Oliveira EH,et al.Anacardic acid derivatives from Brazilian propolis and their antibacterial activity. Ecletica Quimica.2008;33:53-8.
[26]Sanpa S,Popova M,Bankova V,et al.Antibacterial Compounds from Propolis of Tetragonula laeviceps and Tetrigona melanoleuca(Hymenoptera:Apidae)from Thailand[J].2015.
[27]高磊.天然药物小檗碱抑制烟曲霉作用机制的研究[D].吉林大学,2012.
[28]de Paulo Martins V,Dinamarco T M,Curti C,et al.Classical and alternative components of the mitochondrial respiratory chain in pathogenic fungi as potential thera peutic targets[J].Journal of bioenergetics and biomembranes,2011,43(1):81-88.
[29]Haraguchi H,Tanimoto K,Tamura Y,et al.Mode of antibacterial action of retrochalcones from Glycyrrhiza inflata[J].Phytochemistry,1998,48(1):125-129.
[30]Raafat D,Von Bargen K,Haas A,et al.Insights into the mode of action of chitosan as an antibacterial compound[J].Applied and environmental microbiology,2008,74(12):3764-3773.
[31]Parekh D B,Ziegler W,Parker P J.Multiple pathways control protein kinase C phosphorylation[J].The EMBO journal,2000,19 (4):496-503.
Propolis on Aspergillus fumigatus antifungal mechanisms in vitro
Shen Fei1,2Chen Yijie1,2Xu Xiaolan1,2,3Miao Xiaoqing1,2,3Wu Zhenhong1,2,3
(1 Fujian Agriculture and Forestry University,Fu Zhou 350002;2 Apitherapy institute of fujian agriculture and forestry university,Fu Zhou 350002;3 Natural biological toxin national local joint engineering laboratory,Fuzhou 350002)
To investigate the effects of propolis on A.fumigatus,so as to provide guidance for clinical treatment of the A.fumigatus infection.Using different concentrations(10,20,30,40,50,100,150,200 mg/ml)of ethanolic extract of propolis(EEP)to deal with A.fumigatus spores found that a dose-dependent relationship between propolis and bacteriostatic ring size.Next,the minimum inhibitory concentrations(MIC)of propolis were determined by agar dilution method,A.fumigatus mycelium weights and spores respiratory rate were significantly inhibited when exposure to 1/ 2MIC50of propolis.Unltrastructure of spore was seriously damaged with propolis incubation for 3d,which was further confirmed by soluble protein loss of A.fumigatus mycelia treated with propolis.Seni-quantitative PCR found Phosphatidylinositol signal pathway related PLC gene expression down-regulated.These results suggest propolis can inhibit the growth of A.fumigates.and have a promising potential to treat pneumonia caused by A.fumigates.
propolis;Aspergillus fumigatus;in vitro;PKC;mechanism
国家蜂产业技术体系项目(CARS-45-KXJ19)
沈菲(1990-),女,湖北孝感人,在读硕士,研究方向:蜂产品医疗与保健。
吴珍红(1964-),女,研究员,研究方向:蜂产品医疗与保健,E-mail:wzh516@126.com。
