浙江金华地区越冬意蜂群大量死亡原因调查与分析
2016-09-23郑火青贡红日苏晓玲陈秀贤华启云赵东绪胡福良
郑火青贡红日苏晓玲陈秀贤华启云赵东绪胡福良
(1浙江大学动物科学学院,杭州310058;2金华市农业科学研究院,金华321000)
浙江金华地区越冬意蜂群大量死亡原因调查与分析
郑火青1贡红日1苏晓玲2陈秀贤1华启云2赵东绪2胡福良1
(1浙江大学动物科学学院,杭州310058;2金华市农业科学研究院,金华321000)
2014年冬,浙江多地意蜂群出现大量死亡。为了探究这一突发事件的原因,我们实地察看了现场、发放了调查问卷,并取样进行了病毒和微孢子虫的检测分析。结果表明,本次突发事件的主要原因可以排除急性农药中毒和急性污染物中毒的可能性。在病毒感染率上,患病蜂群DWV的感染率显著高于健康蜂群,但健康蜂群BQCV的感染率却显著高于患病蜂群。在病毒多重感染水平和病毒滴度上,患病蜂群显著高于健康蜂群;同时,患病蜂群N.ceranae的感染率和感染水平都要显著高于健康蜂群。本研究提示多重病毒感染、DWV和IAPV的高病毒滴度及N.ceranae的感染和这次蜜蜂死亡事件密切相关。鉴于狄斯瓦螨在促进病毒病方面的作用,蜂螨也有可能是蜂群死亡的间接原因之一。此外,本研究同时表明,几乎所有的表面健康蜂群同时感染多种病原,健康情况堪忧。为避免类似死亡事件的发生,一方面需力求降低病原体的感染水平,另一方面可以调整饲养管理方式促进蜜蜂的健康水平,同时减少外界不良因素的刺激。
意蜂;蜂群死亡;病毒;多重感染;微孢子虫;狄斯瓦螨
1 前言
蜜蜂在维持生物多样性以及提高农业生产力方面发挥着重要作用[1,2]。然而,近些年国际上报道了大量西方蜜蜂蜂群死亡的现象。尽管目前还没有确切的答案来解释这种现象,但是很多因素包括寄生虫、病原微生物[3]、农药中毒[4]以及气候参数[4]被认为是造成蜂群损失的主要原因[5]。
至今为止,已从蜂群中检测出22种蜜蜂病毒[6-8],其中蜜蜂急性麻痹病毒(acute bee paralysis virus,简称ABPV)、蜜蜂黑蜂王台病毒(black queen cell virus,简称BQCV)、蜜蜂慢性麻痹病毒(chronic bee paralysis virus,简称CBPV)、蜜蜂卷翅病毒(deformed wing virus,简称DWV)、蜜蜂以色列急性麻痹病毒(israeli acute paralysis virus,简称IAPV)、蜜蜂克什米尔病毒(kashmir bee virus,简称KBV)以及蜜蜂囊状幼虫病毒(sacbrood virus,简称SBV)最为常见。一般情况下,这些病毒以隐性感染的形式存在于蜂群中[6],可是当外界环境以及饲养条件对蜂群健康产生压力时,就有可能诱导蜂群出现症状并最终致死[9]。另外,西方蜜蜂的微孢子虫病特别是由N.ceranae引起的孢子虫病同样被看作是蜂群损失的主要诱导因素之一[10]。
我国蜜蜂饲养管理精细,一直以来未见有如美国大范围蜜蜂死亡现象的报道。但是近年来,在浙江及周边地区不时有蜂农反映蜜蜂死亡严重。2014/2015年越冬期间在浙江省金华、慈溪和平湖等地出现大量蜂群死亡现象,有不少蜂场全场覆没。针对这一问题,我们在金华地区对蜂群死亡原因开展了调查,同时取样分析了病毒和微孢子虫的感染情况。
2 材料与方法
2.1问卷调查
向金华地区34家转地蜂场发放调查问卷。调查内容包括蜂群损失程度、周边环境、蜜蜂死亡症状、治螨情况等。其中,蜂群损失程度分严重(蜂群损失达50%以上)、中等(蜂群损失30~50%左右)、轻微(蜂群损30%以下)和正常四个等级。
2.2样本收集
2014年12月至2015年1月间,从15个有明显损失的蜂场收集42群患病群的样本,同时从10个蜂场收集40群健康群的样本。每群取约100只蜜蜂。
2.37种常见蜜蜂病毒检测
取30只蜜蜂加入2 ml水研磨,取170 μl研磨液用于检测病毒,另取30 μl研磨液用于微孢子虫种鉴定。分别参照北京艾德莱生物科技有限公司的试剂盒(RN03)以及东洋纺(上海)生物科技有限公司的试剂盒(FSQ-201)步骤说明进行总RNA提取和反转录,其中10 μl的反转录体系中含有1 μg的RNA。参照GenStar康润生物科技有限公司的PCR mix试剂盒(A112-10)进行病毒检测。病毒检测的引物参照文献[11,12]。PCR的反应体系为12.5 μl水,1.25 μl 10μM的正向和反向引物,2 μl的模板,12.5 μl的2×Taq PCR StarMix,总体积为25 μl。PCR反应过程:94℃2 min。35个循环:94℃30 s;54℃30 s;72℃30 s。最后72℃,延伸5 min。
2.4DWV和IAPV的qRT-PCR分析
已有大量报道表明DWV和IAPV与蜂群损失有关,而且我们的样本中这两种病毒流行率非常高,因此我们对这两种病毒进行了绝对定量分析[3,10]。以蜂场为单位,将每个蜂场取到的所有健康样本或者患病样本分别视为一个大的混合样本,每个大混合样本含有70只蜜蜂。RNA提取以及反转录过程同上。DWV和IAPV病毒的标准曲线绘制如下:引用已发表文献的引物[12,13]制备重组质粒,用于制备标准曲线。绝对定量qPCR反应中采用SYBR Green法对DWV和IAPV进行定量,反应体系为10 μl THUNDERBIRD SYBR qPCR Mix(QPS-201,Toyobo,Shanghai),1 μl 10 μM的正R向和反向引物,6 μl的水,2 μl的模板,总体积为20 μl。反应程序:95℃ 1min;40个循环反应:95℃ 15s;60℃1min;溶解曲线分析:95℃15 s;60℃15 s;95℃15 s。60℃至95℃的反应总时间为20 min。取6 μl PCR产物在2%的琼脂糖凝胶进行电泳观察,根据阳性对照(阳性质粒)看其条带大小。
2.5微孢子虫孢子计数和种的鉴定
从每群蜂样本中取30只蜜蜂,取腹部加30 ml水研磨,通过镜检法检测孢子数[14]。将30只蜜蜂加2 ml水研磨得到的30 μl研磨液进行DNA提取。DNA提取参照Favorgen公司试剂盒(FATGK001,Taiwan,China)步骤说明。采用Nosema apis和Nosema ceranae特异性引物进行PCR扩增,取6 μl PCR产物进行2.5%琼脂糖凝胶电泳,根据引物扩增结果确定微孢子虫种类。
2.6数据统计处理
采用Shapiro-wilk法测试各组数据是否服从正态分布。正态分布的数据采用参数检验Student's-test比较,非正态分布的数据采用非参数检验Mann-Whitney U test。卡方检验用于比较蜂群中微孢子和病毒感染水平的差异。P值小于0.05为差异显著。
3 结果
3.1调查结果
3.1.1损失程度:调查的34家转地蜂场中,损失严重的蜂场达16家(47%),损失中等8家,损失轻微2家,未见异常的有8家。
3.1.2死亡原因:本次调查的蜂场分布于金华地区不同区域,场地都是往年返场后同期的放蜂场地,周边未见有毒蜜粉源植物开花。损失严重的蜂场中有1家明确是农药中毒。所有蜂场都进行规律地治螨,损失严重和损失中等的蜂场中各有1家蜜蜂螨害严重,其余所有蜂场蜜蜂在死亡前表现健康,能排除螨害和农药中毒的原因,且在春繁开始后就自然好转。后续分析中剔除螨害严重和农药中毒的3家蜂场。
损失严重的14家蜂场(已除去农药中毒和螨害严重的各1家蜂场),10家蜂场明确附近无工业污染源,4家蜂场附近有不同程度的污染源,另有2家蜂场附近有药厂,不能排除污染的影响。损失中等的7家蜂场,5家明确附近无工业污染源,1家受螨害、大肚病和污染源的共同影响;另有2家蜂场附近有药厂,不能排除污染的影响。损失轻微的蜂场,有1家反映附近有污染源和甘露蜜。
3.1.3死亡症状:死亡原因未知的损失严重和损失中等的21家蜂场中,有19家蜂场强群死亡更严重,有2家蜂场强群和弱群死亡相当。
15家蜂场幼蜂、壮年蜂和老蜂均有死亡,4家主要是幼蜂死亡,1家主要是壮年蜂死亡,1家主要是壮年蜂和老年蜂死亡;所有损失中等以上的蜂场都在箱门口看见大量死蜂,有5家蜂场在箱内也能见大量死蜂。
17家蜂场蜜蜂有爬蜂症状,16家蜂场死亡蜜蜂有伸吻现象,15家有展翅现象,16家腹部内弯,13家蜂场反映蜜蜂死亡前较往常暴躁,仅有4家蜂场有反映死亡蜜蜂有大肚子现象。蜂场损失情况、污染源情况及蜜蜂死亡症状统计见表1。

表1 蜂场损失程度、污染源情况和蜜蜂死亡症状
3.2蜂群的病毒感染情况
3.2.1感染率比较:检测结果显示(图1),蜜蜂病毒感染很普遍,BQCV、DWV和IAPV三种病毒不管在健康群还是患病群中的感染率都超过了75%,其中BQCV在健康群中的感染率达95%,IAPV在健康群和患病群中的感染率分别达90%和87.4%。CBPV、KBV和SBV检出率较低,本研究未检测到ABPV。患病蜂群的DWV感染率显著高于健康蜂群的感染率(P=0.046),而BQCV在健康蜂群的感染率却显著高于在患病蜂群中的感染率(P=0.029)。此外,健康蜂群的CBPV、IAPV、KBV以及SBV的感染率与患病蜂群的感染率之间均不存在显著性差异(P>0.05)。
3.2.2多重感染比较:所有蜂群都能检测到病毒,除1群外,所有蜂群都被2种或2种以上蜜蜂病毒感染(表2)。患病蜂群中以感染3种和4种蜜蜂病毒为主,感染率分别是35.1%和47.4%。健康蜂群以感染3种蜜蜂病毒(47.5%)为主,其次是2重感染(25%)和4重感染(22.5%)。患病蜂群和健康蜂群在感染3种蜜蜂病毒的比例上不存在显著差异(P=0.279),但患病蜂群4重感染率显著高于健康蜂群(P=0.017),2重感染率显著低于健康蜂群(P=0.01)。

图1 患病蜂群和健康蜂群6种常见蜜蜂病毒的感染率(“*”表示P<0.05)

表2 蜂群中蜜蜂病毒多重感染情况
3.2DWV和IAPV病毒滴度
DWV病毒在患病蜂群和健康蜂群中的病毒滴度分别为(1.95±1.58)×108和(8.31±1.39)×106,且二者存在显著性差异(t=2.202,P=0.038)。患病蜂群的IAPV病毒滴度((3.72±1.68)×107)也显著高于健康蜂群的病毒滴度[(1.35±1.57)×106](U=34,P=0.035)(图2)。
3.3微孢子虫的计数和鉴定
患病蜂群微孢子虫的检出率(66.7%)极显著的高于健康蜂群(17.5%)(P<0.001)。同时患病蜂群感染微孢子虫孢子数平均达到了(2.12±0.72)×106,极显著地高于健康蜂群的微孢子虫孢子数(4.3±0.19)×105(U=435,P<0.001,图3)。
微孢子虫种鉴别结果表明所有蜂群微孢子虫均为N.ceranae,没有发现N.apis。
4 讨论

图2 患病蜂群和健康蜂群DWV和IAPV病毒滴度比较(“*”表示P<0.05)
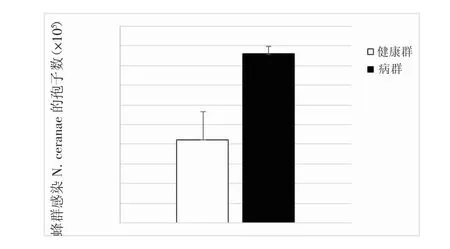
图3 患病蜂群和健康蜂群的微孢子虫孢子数比较(“***”表示P<0.001)
针对国外大量的蜂群死亡现象,研究逐渐指向是病原、农药及环境等因素共同作用的结果[3,4,10]。近几年来,已在浙江省连续出现越冬蜂大量死亡的现象,而且逐年越发严重。通过调查,我们基本能排除急性农药中毒或环境污染作为主要因素的可能性。狄斯瓦螨是西方蜜蜂的首要病害,但在这次事件中,蜂农都明确蜂螨都得到了有效控制,我们的实地勘察也确认了这一点,可以排除蜂螨作为直接致病因素的可能性;但鉴于蜂螨在促进蜜蜂病毒病爆发方面的关键作用,我们并不能排除蜂螨作为间接致病因素的可能性。
已有多项研究表明,DWV和IAPV与国际上的蜂群损失有密切关系[3,10]。本研究病毒检测结果表明,患病蜂群DWV和IAPV滴度都要显著高于健康蜂群,说明DWV和IAPV滴度与蜂群死亡有着密切关系。
本研究中几乎所有的蜂群都有1种以上的蜜蜂病毒感染。患病蜂群以同时感染3种或4种病毒为主,健康蜂群以同时感染3种病毒为主,患病蜂群和健康蜂群相比,多重感染情况更为严重。这一结果表明,病毒的多重感染与蜂群死亡有关。
同时,需要指出的是,本研究检测到了除ABPV之外的6种病毒,且所有蜂群都有病毒感染,尤其是BQCV、DWV和IAPV在健康蜂群或患病蜂群的感染率都在75%以上,此外BQCV在健康蜂群的感染率显著高于患病蜂群的感染率,说明蜜蜂健康状态堪忧。在气候适宜、生产强度不大和营养充足等条件下,蜂群能够不表现任何症状,一旦环境条件恶劣、生产强度大或营养缺失等不良因素出现,蜂群可能就会出现衰败或崩溃。而越冬期间,外界条件恶劣,蜂群营养缺失,是蜂群健康最敏感的时期。
N.ceranae在很多国家被认为是引起蜂群损失的重要原因。本研究中,患病蜂群的检出率和孢子数都要显著高于健康蜂群,说明N.ceranae也与本次蜜蜂死亡事件密切相关。本研究中N.ceranae在健康蜂群中的检出率偏低,可能与取样的季节有关。
总之,本研究表明,多重病毒感染、DWV和IAPV的高病毒滴度及N.ceranae的感染和这次蜜蜂死亡事件密切相关。同时表明,即使是表面健康的蜂群也同时受到多种病原的感染,甚至在病毒感染率上与患病蜂群没有太大差异。这些病原的感染降低了蜜蜂的健康水平,但还未到出现明显症状的水平,一旦加以外界不良因素的刺激,原本脆弱的健康可能崩溃。
本研究提示,越冬期间蜜蜂突然死亡可能是外界不良因素的刺激和原本潜伏于蜜蜂体内的病原共同作用的结果。为避免类似死亡事件的发生,一方面需降低病原物的感染水平,另一方面可以调整饲养管理促进蜜蜂的健康水平,同时减少外界不良因素的刺激。
[1]Delaplane KS,Mayer DR,Mayer DF.Crop Pollination by Bee [M].Cabi,2000.
[2]Gallai N,Salles JM,Settele J,et al.Economic valuation of the vulnerability of world agriculture confronted with pollinator decline [J].Ecol Econ,2009,68:810-821.
[3]Cox-Foster DL,Conlan S,Holmes EC,et al.A metagenomic survey of microbes in honey bee colony collapse disorder[J].Science,2007,318:283-287.
[4]Goulson D,Nicholls E,Botías C,et al.Bee declines driven by combined stress from parasites,pesticides,and lack of flowers[J]. Science,2015,347:1255957.
[5]Smith KM,Loh EH,Rostal MK,et al.Pathogens,pests,and economics:Drivers of honey bee colony declines and losses[J].Eco-Health,2013,10:434-445
[6]Chen YP,Siede R.Honey bee viruses[J].Adv Virus Res,2007,70:33-80.
[7]Runckel C,Flenniken ML,Engel JC,et al.Temporal analysis of the honey bee microbiome reveals four novel viruses and seasonal prevalence of known viruses,Nosema,and Crithidia[J].PLoS ONE,2011,6:e20656.
[8]Dong S,Stam R,Cano LM,et al.Effector specialization in a lineage of the Irish potato famine pathogen[J].Science,2014,343:552-555.
[9]Nordstroem S,Fries I,Aarhus A,et al.Virus infections in Nordic honey bee colonies with no,low and severe Varroa jacobsoni infestations[J].Apidologie,1999,30:475-484.
[10]Higes M,Martín-Hernández R,Garrido-Bailón E,et al.Honeybee colony collapse due to Nosema ceranae in professional api-aries[J].Env Microbiol Rep,2009,1:110-113.
[11]Tentcheva D,Gauthier L,Zappulla N,et al.Prevalence and seasonal variations of six bee viruses in Apis mellifera L.and Varroa destructor mite populations in France[J].Appl Environ Microb,2004,70:7185-7191.
[12]Di Prisco G,Pennacchio F,Caprio E,et al.Varroa destructor is an effective vector of Israeli acute paralysis virus in the honeybee,Apis mellifera[J].J Gen Virol,2011,92:151-155.
[13]Chen Y,Higgins J,Feldlaufer M.Quantitative real-time reverse transcription-PCR analysis of deformed wing virus infection in the honeybee(Apis mellifera L.)[J].Appl Environ Microb,2005,71:436-441.
[14]Pickard R,El-Shemy A.Seasonal variation in the infection of honeybee colonies with Nosema apis Zander[J].J Apicult Res,1989.
Investigation and analysis of large scale colony losses of Apis mellifera in winter in Jinhua,Zhejiang
Zheng Huoqing1,Gong Hongri1,Su Xiaoling2,Chen Xiuxian1,Hua Qiyun2,Zhao Dongxu2,Hu Fuliang1
(1 College of Animal Sciences,Zhejiang University,Hangzhou310058;2 Academy of Agricultural Sciences of Jinhua,Jinhua,321000)
Large scale colony losses of Apis mellifera happened in several regions in Zhejiang Province in the winter of 2014.In order to explore the causes of the colony losses,we inspected the occurrence sites,issued the questionnaires and analysed the infection of viruses and Nosema.Result indicated that acute pesticide and pollutant poisoning could be excluded as the major causes of the death.DWV infection rate of diseased colonies was significantly higher than that of healthy colonies,however,the BQCV infection rate was opposite.In addition,Nosema ceranae infection rates and spore loads of diseased colonies were significantly higher compared with that of healthy colonies.Our investigation and analysis suggested that multiple virus infections,high DWV and IAPV titers and N.ceranae infection were closely related to the colony losses.Considering the role of Varroa mites in promoting virus proliferation,Varroa destructor might be one of the important indirect causes of the death.Moreover,it is worth noting that almost all apparently healthy colonies were infected with a variety of pathogens,which suggested that the health of these colonies were actually in a serious condition.To prevent similar incidents,efforts should be carried outto decrease infection levels of pathogens.Meanwhile,management manners should be improved to increase the disease resistance of honeybees and the stimulations of environmental adverse factors should be avoided.
Apis mellifera,colony losses,virus,multiple infections,N.ceranae,Varroa destructor
国家蜂产业技术体系专项(CARS-45),金华市农业研究计划项目(2014-2-009)
胡福良,E-mail:flhu@zju.edu.cn
