滨州浅海大型底栖动物次级生产力研究
2016-09-21王志忠张金路巩俊霞
王志忠,张金路,巩俊霞,
山东省淡水渔业研究院,山东省淡水水产遗传育种重点实验室,山东 济南 250013
孙同秋,王玉清,敬中华,曾海祥
(山东省滨州市海洋与渔业研究所,山东 滨州 256616)
滨州浅海大型底栖动物次级生产力研究
王志忠,张金路,巩俊霞,
山东省淡水渔业研究院,山东省淡水水产遗传育种重点实验室,山东 济南 250013
孙同秋,王玉清,敬中华,曾海祥
(山东省滨州市海洋与渔业研究所,山东 滨州 256616)
根据2012年春季、夏季和秋季对山东省滨州浅海大型底栖动物18个站位3航次调查结果,利用Brey的经验公式对大型底栖动物的次级生产力和P/B值进行了研究计算。结果表明:该海域大型底栖动物的次级生产力在0.002~65.000g(AFDW)·m-2·a-1之间,均值为6.210g(AFDW)·m-2·a-1;其去灰干重生物量为0.001~43.680g(AFDW)·m-2,均值为3.980g(AFDW)·m-2;两者均以秋季最高,春季次之,夏季最低。该海域P/B值相对较高,均值为1.80a-1,以夏季最高,其次是春季,秋季最低。该海域个体较小、生活史较短的种类在底栖动物群落组成中占据优势;每年大型底栖动物次级生产力总量(湿重)约为6.9万吨。
滨州浅海;大型底栖动物;次级生产力;P/B值
目前对有关海域的大型底栖动物生态环境、生物量及次级生产力的研究报道相对较多[1~20],但对山东滨州浅海大型底栖动物次级生产力的研究尚未见报道。本研究通过对该海域大型底栖动物生物量现状的调查并计算其次级生产力,旨在为滨州浅海海域底栖生物资源的生态化开发与可持续利用、生态环境保护等提供科学依据。
1 研究方法
1.1研究区域与调查站位
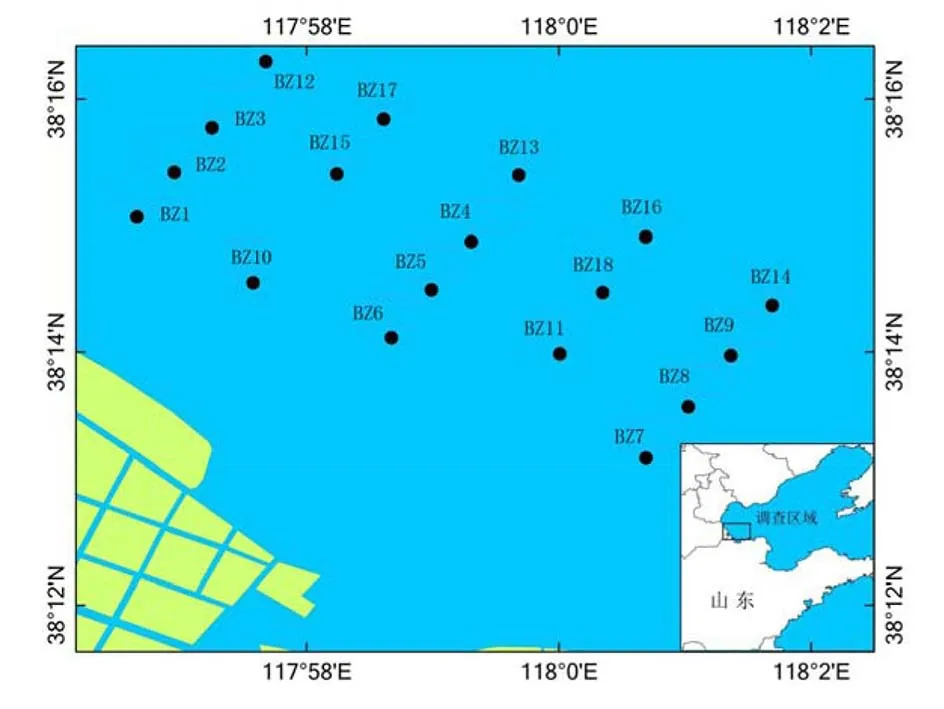
图1 滨州浅海调查站位图
分别于2012年春季(6月)、夏季(9月)和秋季(11月)对山东省滨州浅海大型底栖动物现状进行了3航次的调查。研究区域位于渤海湾南岸的大口河与马颊河入海口之间,共布设18个调查站位,调查站位详见图1。
1.2取样方法
底栖动物定量采样,采用型号为QNC6-1的挖泥斗,每次调查每个站位均采集4次,采样面积为0.1m2,将采得的底泥放入孔径为0.5mm的不锈钢筛子中,用水冲洗,同时捡出筛上的底栖动物,按类别分开装瓶,固定后,写好相应的标签,保存,带回实验室进行种类鉴定、个体计数、生物量称量等。底栖动物样品的处理、保存、计数、称重等均按《海洋调查规范》[21]进行。
1.3大型底栖动物次级生产力的计算
Brey[22]的经验公式是利用年平均生物量和年平均个体质量2个参数,计算各类群的生产力,再将群落中所有类群的生产力相加,得到整个群落的生产力,公式如下:
lgP=a+b1lgB+b2lgW
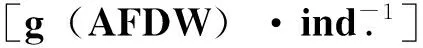
软体动物:lgP=-0.591+1.03lgB-0.283lgW
多毛类:lgP=-0.018+1.022lgB-0.116lgW
甲壳动物:lgP=-0.473+1.007lgB+0.274lgW
棘皮动物和其他类群:lgP=-0.473+1.007lgB+0.274lgW
软体动物、多毛类、甲壳动物、棘皮动物和其他类群的有机碳含量(C),分别为其湿质量的4.1%、5.1%、3.7%、3.16%和3.4%[23~25],1gC=2g(AFDW)[26]。
2 结果与分析
2.1种类数量
共采集到大型底栖动物81种。其中多毛类20种,占37.04%;软体动物27种,占33.33%;甲壳动物18种,占22.22%;棘皮动物1种,占1.23%;其他类5种(纽形动物2种、扁形动物、腕足动物、腔肠动物各1种),占6.17%。可见多毛类和软体动物是构成该海域底栖动物的主要类群,二者均占总种数的30%以上。
春季采集到大型底栖动物78种,其中多毛类28种、软体动物27种、甲壳动物18种、棘皮动物1种和其他类4种(纽形动物、扁形动物、腕足动物、腔肠动物各1种)。夏季采集47种,其中软体动物17种、多毛类17种、甲壳动物10种、棘皮动物1种和其他类2种(纽形动物、腕足动物各1种)。秋季采集39种,其中多毛类15种、软体动物11种、甲壳动物8种、棘皮动物1种和其他类4种(纽形动物2种、扁形动物、腕足动物各1种)。可见,随采集时间的推移,大型底栖动物种类数量逐渐减少,即春季>夏季>秋季。
2.2生物量组成
2.2.1生物量
平均栖息密度为3836.83ind.·m-2。其中春季为435~35250ind.·m-2,均值为6384.09ind.·m-2,最高值出现在BZ8站位,最低值在BZ1站位;夏季为10~3900ind.·m-2,均值为1680.5ind.·m-2,最高值在BZ4站位,最低值在BZ9站位;秋季为260~5920ind.·m-2,均值为3445.91ind.·m-2,最高值在BZ18站位,最低值在BZ12站位(表1)。因此底栖动物栖息密度以春季最高,秋季次之,夏季较低。
平均生物量为48.65g·m-2。其中春季为1.50~201.66g·m-2,均值为49.82g·m-2,最高值是BZ8站位,最低值是BZ5站位;夏季为0.01~54.28g·m-2,均值为11.34g·m-2,最高值是BZ4站位,最低值是BZ9站位;秋季为0.61~532.90g·m-2,均值为84.79g·m-2,最高值是BZ18站位,最低值为BZ8站位(表1)。表明底栖动物生物量以春季最高,秋季次之,夏季较低;其季节变化规律与栖息密度一致。
2.2.2群落组成
栖息密度组成中,各季节均以软体动物最高,达3405.02ind.·m-2,占88.75%;其次为甲壳动物和多毛类,分别为226.56ind.·m-2和196.95ind.·m-2,占5.90%和5.13%;其他类棘皮动物和棘皮动物其他类相对较低,分别为7.53ind.·m-2和0.77ind.·m-2,占0.20%和0.02%。表明软体动物的栖息密度在底栖动物中占绝对优势。软体动物、甲壳动物和其他类的栖息密度变化均为春季>秋季>夏季,而多毛类则为秋季>春季>夏季,棘皮动物为春季>夏季>秋季。
各季节群落生物量均以软体动物最高,达44.85g·m-2,占92.20%;其次为甲壳动物和多毛类,分别为2.90g·m-2和0.65g·m-2,占5.95%和1.34%;其他类和棘皮动物相对较低,分别0.20g·m-2为和0.04g·m-2,占0.42%和0.09%。表明软体动物的生物量在底栖动物中占绝对优势;各群落生物量的总体季节变化规律与栖息密度相同。软体动物、多毛类和其他类的生物量均为秋季>春季>夏季,而甲壳动物和棘皮动物则为春季>秋季>夏季,可见各群落的生物量均以夏季为最低。
2.3大型底栖动物次级生产力与P/B值
滨州浅海大型底栖动物的去灰干重生物量为0.001~43.68g(AFDW)·m-2,均值为3.98g(AFDW)·m-2,最高值出现在秋季BZ18站位,最低值为夏季BZ9站位;其中以秋季最高,达6.95g(AFDW)·m-2;春季次之,为4.05g(AFDW)·m-2;夏季最低,仅为0.92g(AFDW)·m-2。大型底栖动物的次级生产力在0.002~65.00g(AFDW)·m-2·a-1之间,均值为6.21g(AFDW)·m-2·a-1,最高值为秋季BZ18站位,最低值在夏季BZ9站位;其中以秋季最高,达10.22g(AFDW)·m-2·a-1,其次是春季,为6.67g(AFDW)·m-2·a-1,夏季最低,为1.73g(AFDW)·m-2·a-1(表1)。导致大型底栖动物去灰干重和次级生产力均为秋季最高、春季次之、夏季最低的主要原因,可能与软体动物的生物量在底栖动物中占绝对优势,以及软体动物、多毛类和其他类的生物量均为秋季>春季>夏季等因素有关。
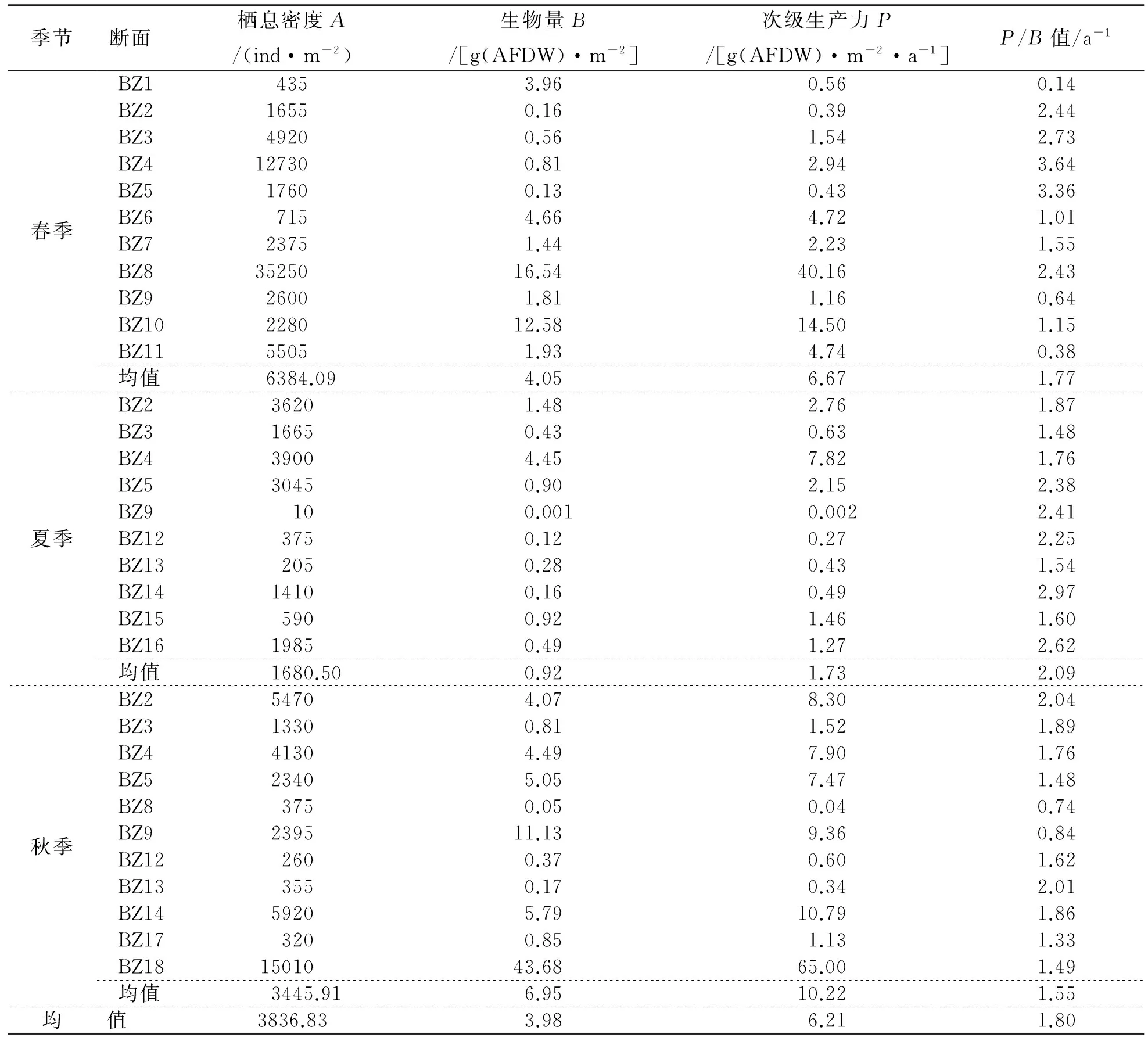
表1 各断面大型底栖动物栖息密度、生物量、次级生产力和P/B值
滨州浅海各站位P/B值在0.14~3.64a-1之间,均值为1.80a-1;最高值出现在春季BZ1站位,最低为春季BZ4站位。其中以夏季最高,达2.09a-1;春季次之,为1.77a-1;秋季最低,为1.55a-1(表1)。
2.4滨州浅海大型底栖动物次级生产力总量估算
由于滨州浅海每年都要通过大口河和马颊河径流带入大量淡水、泥沙和氮磷等污染物等,使其形成了独特的生态环境特征,进而影响了大型底栖动物的群落组成和资源量。滨州浅海海域面积约为20万hm2,按平均次级生产力6.21g(AFDW)·m-2·a-1计算,该海域每年大型底栖动物次级生产力总量(湿重)约为6.9万t。近些年来,随着“山东渔业资源修复行动计划”的有效实施,促进和带动了沿海养殖业的发展,尤其是浅海贝类增养殖业发展迅速,滨州浅海海域也是如此。因此,大型底栖动物次级生产力的估算总量是在自然条件下对该水域次级生产力的保守估算,而不包括人工养殖环境条件下的次级生产力。
3 讨论
滨州浅海大型底栖动物的平均次级生产力为6.21g(AFDW)·m-2·a-1,明显高于长江口及邻近海域的3.52g(AFDW)·m-2·a-1[16]、南黄海4.98g(AFDW)·m-2·a-1[10]和深沪湾0.599g(AFDW)·m-2·a-1[12],而低于胶洲湾及其西部18.65g(AFDW)·m-2·a-1[14]和13.41、47.34g(AFDW)·m-2·a-1[9]、厦门海域9.6g(AFDW)·m-2·a-1[11],但与渤海6.49g(AFDW)·m-2·a-1[13]相接近。
P/B值是生产力与生物量之比,是指生物量轮回的次数,其值高低与生物的生命周期有关,因此,它是一个与生物及其环境因子密切相关的比值[27]。该值也反映了1个生态群落内物种新陈代谢的高低和世代更替的速度。一般个体较小、生活史短、繁殖较快、对环境变化适应性强的物种,P/B值较高;反之,该值较低。滨州浅海各站位P/B值均值为1.80a-1;其中以夏季最高,达2.09a-1;其次是春季,为1.77a-1;秋季最低,为1.55a-1。表明该海域大型底栖动物的平均世代更替速度约为1.8年1代;夏季底栖动物较春季和秋季繁殖快、个体小、对环境变化适应性强。该海域P/B值相对较高,高于长江口及邻近海域1.53a-1[16]、深沪湾1.56a-1[12]、厦门海域1.43a-1[11]、胶洲湾的1.05a-1[14]、南黄海1.10a-1[10]、渤海0.82a-1[13]和胶洲湾西部0.58a-1[9]。说明该海域中个体较小、生活史较短的种类在底栖动物群落组成中占据优势。
[1]孙栋,段登选,刘红彩,等.黄河口水域渔业生态水环境调查与研究[J],海洋科学进展,2010,28(2):229~236.
[2]张志南,图立红,于子山.黄河口及其邻近海域大型底栖动物的初步研究(一)生物量[J].青岛海洋大学学报,1990,20(1):37~45.
[3]王志忠,段登选,张金路,等.2008年黄河入海口潮间带大型底栖动物生物量研究[J].广东海洋大学学报,2010,30(4):29~35.
[4]王延明,李道季,方涛,等.长江口及邻近海域底栖生物分布及与低氧区的关系研究[J].海洋环境科学,2008,27(2):139~143.
[5]韩洁,张志南,于子山.渤海大型底栖动物丰度和生物量的研究[J].青岛海洋大学学报,2001,31(6):889~896.
[6]黄洪辉,林燕棠,李纯厚,等.珠江口底栖动物生态学研究[J].生态学报,2002,22(4):603~607.
[7]袁兴中,陆健健.长江口潮沟大型底栖动物群落的初步研究[J].动物学研究,2001,22(3):211~215.
[8]王志忠,张金路,陈述江,等.黄河入海口潮间带大型底栖动物群落组成及次级生产力[J].海洋环境科学,2012,31(4):657~661.
[9]袁伟,张志南,于子山.胶州湾西部海域大型底栖动物次级生产力初步研究[J].应用生态学报,2007,18(1):145~150.
[10]李新正,于子山,王金宝,等.南黄海大型底栖生物次级生产力研究[J].应用与环境生物学报,2005,11(6):702~705.
[11]周细平,蔡立哲,梁俊彦,等.厦门海域大型底栖动物次级生产力的初步研究[J].厦门大学学报(自然科学版),2008,47(6):902~906.
[12]林和山,蔡立哲,梁俊彦,等.深沪湾大型底栖动物群落及其次级生产力初步研究[J].台湾海峡,2009,28(4):520~525.
[13]于子山,张志南,韩洁.渤海大型底栖动物次级生产初步研究[J].青岛海洋大学学报,2001,31(6):867~871.
[14]李新正,王洪法,张宝琳.胶洲湾大型底栖动物次级生产力初探[J].海洋与湖沼,2005,36(6):527~533.
[15]王金辉,杨春旺,孙亚伟,等.象山港大型底栖动物的生物多样性和次级生产力研究[J].天津农学院学报,2006,13(2):24~28.
[16]刘勇,线薇薇,孙世春,等.长江口及其邻近海域大型底栖动物生物量、丰度和次级生产力的初步研究[J].中国海洋大学学报(自然科学版),2008,38(5):749~756.
[17]金亮,蔡立哲,周细平,等.深圳湾北岸泥滩大型底栖动物次级生产力研究[J].台湾海峡,2007,26(3):413~421.
[18]梁俊彦,蔡立哲,周细平,等.深沪湾沙滩潮间带大型底栖动物群落及其次级生产力[J].台湾海峡,2008,27(4):466~471.
[19]吕小梅,方少华,张跃平,等.福建海坛海峡潮间带大型底栖动物群落及其次级生产力[J].动物学报,2008,54(3):428~435.
[20]吕小梅,方少华,吴萍茹.海坛海峡潮下带大型底栖动物现状及次级生产力的研究[J].厦门大学学报(自然科学版),2008,47(4):591~595.
[21]GBT12763.6.2007,海洋调查规范第6部分海洋生物调查[S].
[22]Brey T.Estimating production of macrobenthic invertebrates frombiomass and mean individual weight[J].Meeresforsch,1990,32:329~343.
[23]Rowe G T.Biomass and production in the deep-sea mac-robenthos[A] Rowe G.The Sea.Deep Sea Biology[C].New York: John Wiley & Sons,1983.
[24]Moodley L,Heip C H R,Middelburg J J.Benthic activity in sediments of the northwestern Adriatic sea: Sediment oxygen consumption,macro- and meiofauna dynamics[J].Journal of Sedimentary Research,1998,40:263~280.
[25]Aller J Y,Stupakof I.The distribution and seasonal characteristics of benthic communities on the Amazon shelf as indicators of physical process[J].Continental Shelf Research,1996,16:717~751.
[26]Waters T F.Secondary production in inland waters[A].Macfadyen A.Advances in ecological research[C].London: Academic Press,1977:91~164.
[27]Tumbiolo M L,Downing J A.An empirical model for the production of secondary production in marine benthic invertebrate populations[J].Marine Ecology Progress Series,1994,114:165~174.
2015-12-14
海洋公益性行业科研专项(201205023)。
王志忠(1968-),男,高级工程师,主要从事渔业生态学研究, zhizhongwang@163.com。
S932
A
1673-1409(2016)21-0029-05
[引著格式]王志忠,张金路,巩俊霞,等.滨州浅海大型底栖动物次级生产力研究[J].长江大学学报(自科版) ,2016,13(21):29~33.
