动物细胞在Production罐和卫星罐中的培养过程
2016-09-21孙明月高敏杰李由然江南大学生物工程学院江苏无锡2422江南大学粮食发酵工艺与技术国家工程实验室江苏无锡2422
孙明月,高敏杰,李由然,2(.江南大学 生物工程学院,江苏 无锡 2422;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 2422)
动物细胞在Production罐和卫星罐中的培养过程
孙明月1,高敏杰1,李由然1,2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
动物细胞培养对工艺参数的控制有很高的要求,尤其是培养液的溶氧水平对细胞的生长有着极大的影响。本文主要研究了卫星罐溶氧校准方法的建立以及动物细胞培养过程。首先建立了卫星罐在空气中校准溶氧100%的方法。其次,在生产中的production反应器与卫星罐中分别对CHO和NS0细胞进行同步培养。结果表明,细胞在production反应器内与卫星罐内的生长代谢情况基本一致,两种细胞的细胞活率在培养初期都比较稳定,后期呈现逐渐下降的趋势,活细胞密度呈现先增长后下降的趋势;而乳酸、葡萄糖、谷氨酸、谷氨酰胺浓度也随着细胞培养时间的变化而呈现出不同的变化趋势。
细胞培养;Production罐;卫星罐
动物细胞培养是指离散的动物活细胞在体外人工条件下的生长、增殖过程。在此过程中,细胞不再形成组织。由于动物细胞培养在体外人工条件下进行,方便观察及调控,从而为当今研究动物的物质代谢过程、遗传物质的表达调控等提供了有效的新方法。同时,伴随着分子生物学、分子遗传学、生物化学以及现代医药学等学科的发展,细胞培养在越来越多的领域得到了应用,表现出了其巨大的发展潜力。由于动物细胞没有细胞壁,它对剪切力十分敏感,从而导致了细胞很难很好地适应体外环境。并且,在体外人工条件下进行培养的细胞,它们没有神经体液的调节和细胞间相互影响的作用,不仅导致它们失去了原有的组织结构,也很难维持原有的细胞形态。因此,在体外人工条件下进行动物细胞培养的过程中,应十分密切地关注细胞的生长代谢状态。
1 材料与方法
1.1细胞
CHO:中国仓鼠卵巢细胞。
NS0:小鼠骨髓瘤细胞。
1.2主要仪器及设备
本论文用到的主要仪器及设备如表1所示。
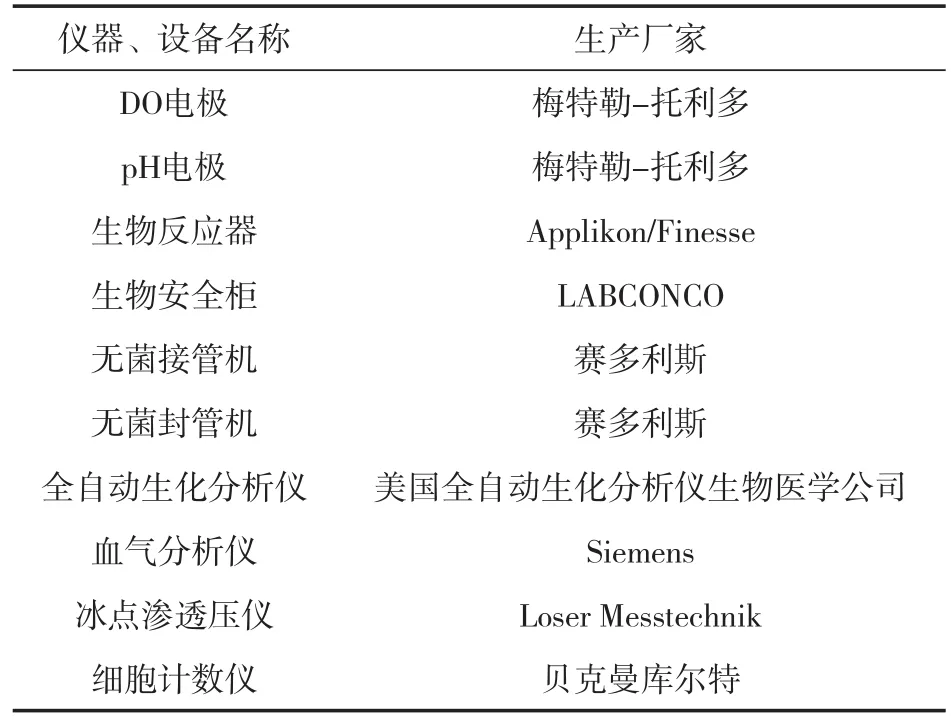
表1 主要仪器及设备
1.3卫星罐设置
主要步骤:组装反应器→pH电极准备→DO电极准备→DO零点校准→反应器灭菌→DO校准100%。
1.4Production反应器设置
使用buffer(模拟培养基:高纯水中含有1.6 g/L NaHCO3,1 g/L PF68)代替培养基,分析DO电极在常温空气中与37 ℃饱和溶氧培养基中校准100%的差异。接着将Finesse-6和Applikon-1灌注buffer后设置培养基温度为37 ℃,过夜通气(0.2 vvm)直至溶氧稳定(18~24 h)。最后设置DO电极:Mettler-1(连接Finesse-5控制器),Mettler-2(连接Finesse-6控制器),Applikon(连接Applikon-1控制器),检查完整性、灵敏性良好。三支DO电极分别连通电极线极化18~24 h。
1.5细胞培养
细胞培养包括细胞复苏,细胞传代及细胞大规模培养三个步骤,参照文献进行。
1.6样品分析
将培养获得的细胞悬液通过全自动生化分析仪、细胞计数仪对样品进行分析。
1.6.1全自动生化分析仪
提起取样器至手动进样位置,输入样品相关信息,按“ANALYZE”键进入检测状态,取样探针伸出,屏幕提示呈递样品时,将上述样品获取中已获得细胞液的EP管置于取样探针下,按“ANALYZE”键自动吸取样品,完成后取样探针自动收回,等待检测结果。
1.6.2细胞计数仪
用移液枪吸取上述样品获取中已获得细胞液的离心管内少许样品,分装到两个计数杯中(如需要则使用DPBS进行适当稀释),将计数杯置于细胞计数仪可用的样品架位置,输入样品相关信息,开始计数,等待计数结果。
2 结果与讨论
2.1Production反应器与卫星罐内细胞的生长情况
Production反应器采用传统方式,在饱和溶氧的培养基中校准DO100%,卫星罐则在空气中进行DO100%校准,对CHO和NS0分别在两种反应器内进行同步培养。通过观察production反应器内与卫星罐内细胞活率、活细胞密度的变化以及乳酸、葡萄糖、谷氨酸、谷氨酰胺浓度变化分析细胞的生长代谢情况。
通过细胞计数仪检测细胞活率和活细胞密度分析production反应器内与卫星罐内细胞生长情况,检测结果如图1、图2、图3和图4所示:
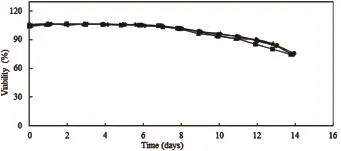
图1 CHO细胞活率变化曲线图
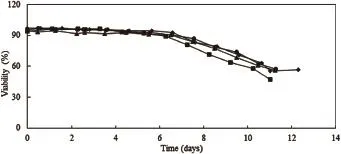
图2 NS0细胞活率变化曲线图
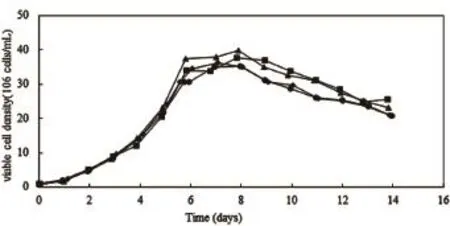
图3 CHO活细胞密度变化曲线图
图1、图2、图3和图4为CHO和NS0分别在2 000 L production反应器以及15 L和3 L卫星罐中培养数天后的细胞活率变化曲线图及活细胞密度变化曲线图。2 000 L Run1为反应器生产第一批,2 000 L Run2为反应器生产第二批;Satellite1为卫星罐培养第一批,Satellite2为卫星罐培养第二批。由图1、图2可见,对于同一种细胞类型,production反应器与卫星罐内细胞活率变化曲线基本一致,细胞活率在培养初期比较稳定,CHO细胞活率从第8天开始出现下降趋势,NS0细胞活率从第7天开始出现下降趋势。由图3、图4可见,对于同一种细胞类型,两反应器内活细胞密度变化曲线基本一致,曲线呈现先增长后下降的趋势,CHO细胞密度在第8天达到峰值,NS0细胞密度在第7天达到峰值。
2.2Production反应器与卫星罐内细胞的代谢情况
通过全自动生化分析仪检测细胞代谢中乳酸、葡萄糖、谷氨酸和谷氨酰胺浓度变化分析production反应器内与卫星罐内细胞代谢情况,检测结果如图5、图6、图7、图8、图9、图10、图11和图12所示:
2.2.1葡萄糖的代谢
葡萄糖的主要代谢途径有3个:一是进入TCA循环,二是进入磷酸戊糖途径,三是经过糖酵解途径生成多糖和乳酸。其中只有极少部分葡萄糖进入TCA循环和磷酸戊糖途径,大部分的葡萄糖都是通过糖酵解途径直接转化为乳酸[1]。由图5、图6、图7和图8可见,对于同一种细胞类型,production反应器与卫星罐内乳酸浓度和葡萄糖浓度变化曲线基本一致。培养初期,细胞消耗葡萄糖产生副产物乳酸,葡萄糖含量不断下降,乳酸相应不断积累,当葡萄糖消耗至不能满足细胞生长时,细胞开始消耗乳酸,因此乳酸含量开始下降。此时通过补充营养,使葡萄糖含量维持在稳定水平,乳酸含量也基本稳定。此外,由于CHO和NS0细胞类型的不同以及两种细胞培养工艺的不同,两种细胞在培养过程中,乳酸积累达到的最高浓度相应不同,葡萄糖及乳酸浓度稳定的水平也相应的不同。
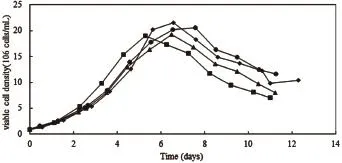
图4 NS0活细胞密度变化曲线图

图5 CHO培养过程中乳酸浓度变化曲线图

图6 NS0培养过程中乳酸浓度变化曲线图
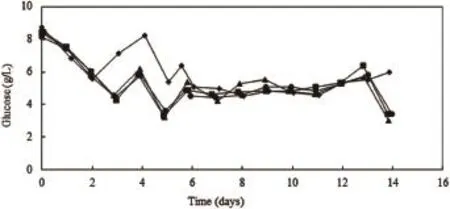
图7 CHO培养过程中葡萄糖浓度变化曲线图
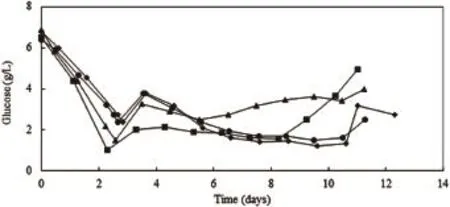
图8 NS0培养过程中葡萄糖浓度变化曲线图
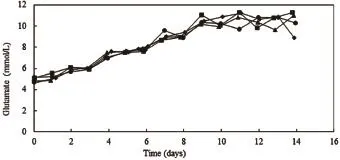
图9 CHO培养过程中谷氨酸浓度变化曲线图
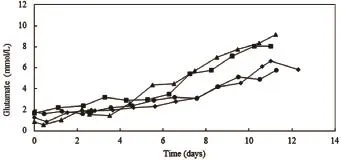
图10 NS0培养过程中谷氨酸浓度变化曲线图

图11 CHO培养过程中谷氨酰胺浓度变化曲线图

图12 NS0培养过程中谷氨酰胺浓度变化曲线图
2.2.2谷氨酰胺的代谢
谷氨酰胺的碳骨架有三条代谢途径,即进入TCA循环以及通过转氨途径生成非必需氨基酸,还有部分直接合成胞内蛋白和抗体。在细胞中,谷氨酰胺主要通过谷氨酰胺酶脱氨生成氨和谷氨酸进入代谢途径。谷氨酸可经谷氨酸脱氢酶催化脱氢生成α-酮戊二酸和氨,还可由转氨酶催化途径生成α-酮戊二酸和非必需氨基酸如丙氨酸、天冬氨酸等,生成的α-酮戊二酸进入TCA循环[1]。由图9、图10、图11和图12可见,对于同一种细胞类型,production反应器与卫星罐内谷氨酸和谷氨酰胺浓度变化曲线基本一致。培养初期,细胞消耗谷氨酰胺较多,谷氨酰胺浓度呈下降趋势,同时生成副产物谷氨酸,谷氨酸逐渐积累,后期谷氨酰胺浓度逐渐趋于平稳,谷氨酰胺含量则呈现逐渐上升的趋势。同时,由于CHO和NS0细胞类型的不同以及两种细胞培养工艺的不同,两种细胞在培养过程中,谷氨酸在逐渐积累的过程中达到的浓度相应不同,谷氨酰胺浓度稳定的水平也相应的不同。
[1]高红亮,丛威,欧阳藩.杂交瘤细胞的代谢流量分析[J].生物工程学报,2000,(6).
(编辑:张淑凤)
Q814
A
1006-799X(2016)12-0089-04
孙明月(1994-),女,江苏泰州人,本科在读,主要从事生物技术的研究工作。
