棘腹蛙“水肿病”病原的分离鉴定
2016-09-21李晓英杜孝田龙方伟徐敬明樊汶樵
李晓英,罗 洁,杜孝田,龙方伟,胡 凯,徐敬明,樊汶樵
(重庆文理学院林学与生命科学学院,重庆珍稀濒危水产资源保护与开发研究中心,重庆 402168)
棘腹蛙“水肿病”病原的分离鉴定
李晓英,罗洁,杜孝田,龙方伟,胡凯,徐敬明,樊汶樵*
(重庆文理学院林学与生命科学学院,重庆珍稀濒危水产资源保护与开发研究中心,重庆 402168)
为了解重庆地区部分棘腹蛙养殖场 “水肿病”病因,并对该病的临床防控提供参考,本研究采集了10只具有 “水肿病”典型症状的2岁龄棘腹蛙成蛙,剖检后从其主要病变组织分离细菌;对分离的优势菌进行培养特性观察和回归致病性试验,同时进行生理生化特性鉴定、16 S rDNA序列测定和药敏试验。结果显示,从病蛙腹腔中分离到1株优势菌株并命名为CQWU201501,该菌为革兰阴性无芽胞短杆菌,主要生理生化特性符合弗氏柠檬酸杆菌的指标,16 S rDNA序列与弗氏柠檬酸杆菌同源性高达99.5%;药敏试验显示该菌对绝大部分β-内酰胺类、氨基糖苷类、喹诺酮类和四环素类药物敏感。综上所述,棘腹蛙“水肿病”是由弗氏柠檬酸杆菌引起的;该菌对供试的16种药物敏感,仅对头孢唑啉和复方新诺明2种药物耐药,生产上可选择敏感药物治疗。
棘腹蛙;水肿病;分离鉴定;药敏试验
棘腹蛙(Paaboulengeri)为蛙科、棘蛙属的两栖动物,体大肉美,是我国特有的大型经济蛙类[1];主要分布在湖北、湖南、山西、江西、四川及甘肃等地。近年来,由于人为滥捕、栖息水体污染、生态环境被破坏等因素,导致棘腹蛙种群数量急剧下降,已被《中国濒危动物红皮书》列为易危物种[2]。为保护野生资源,重庆市部分地区已经开展了棘腹蛙的人工饲养繁殖工作。近段时间,部分养殖场的棘腹蛙出现腹部肿胀、气囊变大等症状的“水肿病”,患病蛙短时间内就会死亡,带来了较大经济损失。在两栖动物的“水肿病”方面,仅见到孙浩等[3]关于嗜水气单胞菌感染大鲵并致病的报道;在蛙类的疫病研究中,这一流行疾病未见任何相关报道。有鉴于此,本研究从患病棘腹蛙上分离致病菌,并进行生物学特性研究和药敏试验,以期为该病的有效防治提供参考。
1 材料与方法
1.1材料
1.1.1病料及供试材料来源患病棘腹蛙成蛙10只,均为重庆市某养殖场送检样品,2岁龄,平均体重65.0 g±3.0 g,平均体长30.0 mm±2.0 mm。病蛙明显腹部肿胀,部分气囊肿胀,食量减少,严重患蛙死亡。剖检可见腹腔积液,胃肿大,其他脏器未见异常。
健康棘腹蛙购自重庆某养殖场,共60只,规格为每只60 g左右,平均体长29 mm左右。
1.1.2主要试剂细菌微量生化管(批号:140123)和药敏试纸(批号:140227),杭州天和微生物试剂有限公司产品;胰蛋白胨、酵母提取物等试剂,OXOID公司产品;水解酪蛋白(M-H)琼脂/肉汤,广东环凯微生物科技有限公司产品;细菌基因组DNA抽提试剂盒、DNA分子量标准、2×TaqPCR Master Mix等,北京天根生化科技有限公司产品;其他常规试剂由重庆文理学院重庆珍稀濒危水产资源保护与开发研究中心自行配制。
1.2方法
1.2.1病原菌的分离无菌操作打开10只病蛙的胸、腹腔,将腹腔积液、胃黏液及肝脏、心脏等器官匀浆接种于LB液体培养基和固体培养基,28 ℃培养18 h~24 h,观察培养基上细菌生长情况;同时将接种的LB固体培养基置于厌氧罐中厌氧培养18 h~24 h,以观察候选菌株对氧气的需求。对分离菌进一步纯化,再转接SS鉴别培养基培养,以便进一步鉴别,采用革兰染色镜检观察。纯化后的菌株加入25%的灭菌甘油中,置-20 ℃保存。
1.2.2致病性试验挑取单个菌落于LB液体培养基中,28 ℃摇床振荡培养12 h。用平板菌落计数法调整菌悬液浓度至3.4×107、3.4×106、3.4×105、3.4×104、3.4×103CFU/mL。将健康棘腹蛙随机分成6组,每组10只,饲养1周后对其中5组进行腹腔注射上述不同浓度的菌液,每只0.2 mL;另一组腹腔注射0.2 mL生理盐水作为对照。每天观察记录试验蛙死亡情况,并对死亡的棘腹蛙再进行细菌的分离鉴定,以确定致病菌。
1.2.3分离菌的生理生化特性鉴定取纯化后的单个菌落,接种于细菌微量生化反应管进行生理生化特性测定,参照《伯杰氏细菌手册》进行结果判定。
1.2.416 S rDNA基因序列分析选取纯化后单个菌落,接种于LB液体培养基中以获得细菌悬液,提取细菌基因组DNA,采用细菌16 S rDNA的通用引物(fD1/rD1)PCR扩增1 500 bp左右的目的片段(上、下游引物分别为:5′-AGAGTTTGATCCTGGCTCAG-3′和5′-TACGGCTACCTTGTTAC- GACTT-3′),经琼脂糖凝胶电泳鉴定后的阳性产物送苏州金唯智生物科技有限公司进行序列测定。
将测序所得候选菌株16 S rDNA 序列通过NCBI的Blast 检索系统进行序列同源性分析。取相似较高的序列,进行多序列匹配排列(Multiple Alignments)并构建系统发育树。
1.2.5药敏试验采用纸片扩散法(K-B法)进行药敏性试。挑取纯化后的菌株于MH肉汤中,28 ℃恒温振荡培养12 h。取100 μL新鲜菌悬液(浓度约1×107CFU/mL) 均匀涂布于LB固体培养基上,用无菌镊子将18种药敏纸片均匀贴在平板上,每张纸片间距≥24 mm,纸片中心距平皿边缘≥15 mm,28 ℃恒温培养16 h~18 h后观察平板上细菌生长情况,并测量抑菌圈直径,参照药敏试验判断标准判定结果。
2 结果
2.1细菌分离结果及培养特性
在10只患病棘腹蛙腹腔积液、胃黏膜、肝脏均分离到1株相同的优势菌。该菌株好氧,在LB固体培养基上呈湿润、光滑、低凹的半透明菌落,菌落边缘不整齐;在SS鉴别培养基上呈橙黄色菌落,菌落中心呈粉红色,边缘不整齐。革兰染色为无芽胞革兰阴性杆菌,鞭毛染色可见周生鞭毛,将该纯化菌株命名为CQWU201501。
2.2分离菌回归致病试验结果
候选分离菌株CQWU201501人工感染4 d后棘腹蛙开始死亡,眼观可见3.4×104CFU/mL及以上感染组棘腹蛙出现腹部膨大症状,剖检症状与自然发病一致;对照组无任何异常。从感染病蛙的腹腔积液、肝脏等分离出与自然发病相同的优势菌。根据改良寇氏法可计算出候选菌株CQWU201501感染棘腹蛙的半数致死剂量LD50为2.14×105CFU/mL,结果见表1。

表1 候选菌株对棘腹蛙的致病性 (死亡数/试验数)
2.3分离菌的生理生化特性鉴定结果
对菌株CQWU201501进行生理生化特性检测,发现该菌能利用精氨酸双水解酶,DNA酶阴性,VP试验阴性,在蛋白胨水中不能生长,能发酵葡萄糖、棉子糖和木糖等,能利用尿素、氰化钾,不能利用赖氨酸脱羧酶、丙二酸盐,不能液化明胶。生理生化鉴定结果显示候选菌株与弗氏柠檬酸杆菌的生理生化指标趋于一致。具体结果见表2。

表2 候选菌株的生理生化特性鉴定结果
注:“+”为阳性,“-”为阴性。
Notes:“+”Positive,“-”Negative.
2.4分离菌的16 S rDNA序列分析
成功扩增到菌株CQWU201501的部分16 S rDNA基因序列,长度为1 402 bp。将该序列提交至NCBI进行Blast比对,发现与弗氏柠檬酸杆菌(Citrobacterfreundii)亲缘关系最为接近,同源性最高达99.5%。结合比对结果调出与候选菌株序列相关性较高的核酸序列,构建系统发育树,结果见图1。
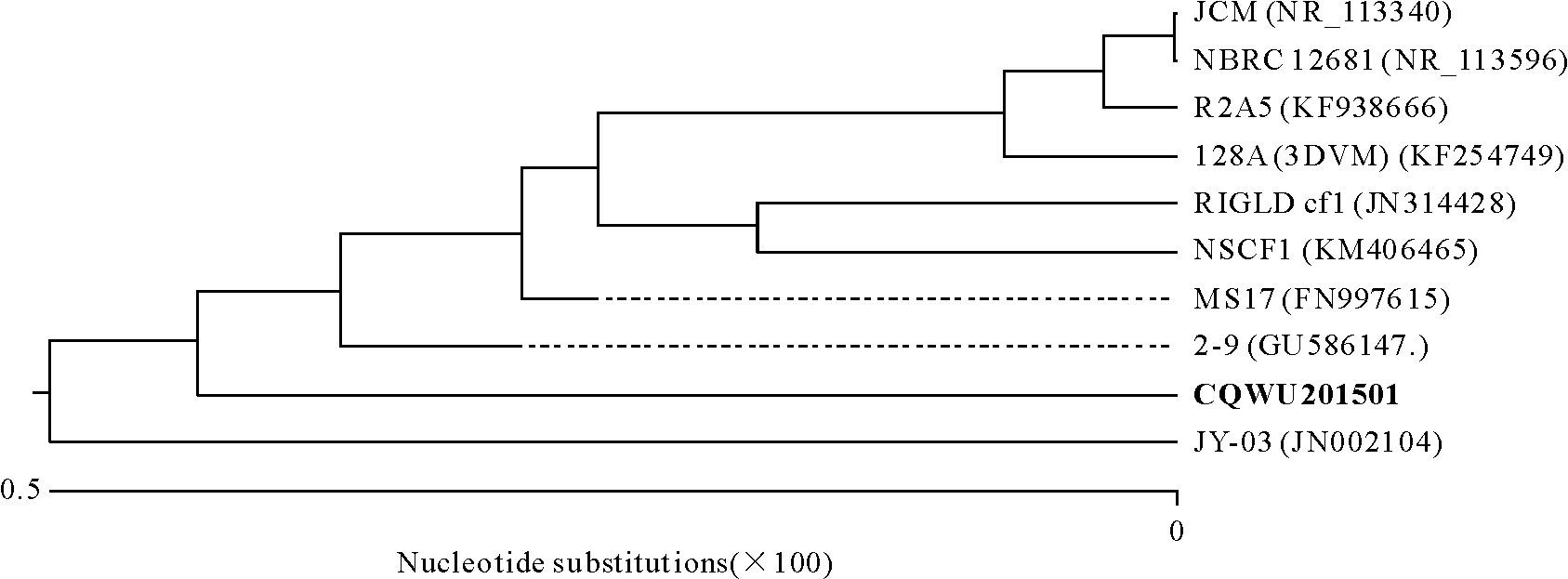
括号前为菌株名,括号内为该菌株在GenBank 中的登录号。
2.5分离菌的药物敏感性试验
药敏试验结果参照美国临床与实验室标准协会(CLSI)药物敏感性试验标准判定,分离菌株CQWU201501对氨曲南、头孢吡肟、头孢噻肟、美罗培南、亚胺培南、替卡西林、奈替米星、环丙沙星、米诺环素、四环素、氨苄西林、庆大霉素、妥布霉素、阿米卡星和他唑巴坦、头孢他啶等16种抗菌药物表现出不同程度的敏感性,而对头孢唑啉、复方新诺明表现耐药(表3)。
3 讨论
通过培养特性观察、回归致病性试验、生理生化特性鉴定和16 S rDNA序列测定,本研究确定了致棘腹蛙“水肿病”的病原为弗氏柠檬酸杆菌。弗氏柠檬酸杆菌是革兰阴性、需氧或兼性厌氧短杆菌,是柠檬酸杆菌属(Citrobacter)的一个种,该属另外还有2个种,即无丙二酸盐柠檬酸杆菌(C.amalonaticus)和差异柠檬酸杆菌(C.diversus),分为11个基因种[4];弗氏柠檬酸杆菌为该属中的模式种。该菌具有鞭毛和菌毛,所释放的黏附因子有助于细菌侵入机体后黏附于细胞表面,经过定居、繁殖释放大量内毒素引起动物发病;不但可以引起腹泻和脓肿,还可导致如坏死性脓疮、腹膜炎、胰腺炎、坏死性筋膜炎、骨髓炎、肺炎、肾炎、菌血症和脑脓肿等临床症状[5-8]。
本研究分离的柠檬酸杆菌致病株感染棘腹蛙后,4 d即可发现试验蛙腹腔肿大,菌液稀释10 000倍后仍可引起棘腹蛙发病并逐步死亡,显示出这一致病菌较强的致病力和感染性。高正勇等[9]也曾报道过一株弗氏柠檬酸杆菌感染中国大鲵的病例,该菌株对大鲵和鲫鱼都有较强致病力,与本试验分离的菌株一样导致腹腔出血、积水,肝脏肿大,进一步证实了弗氏柠檬酸杆菌对两栖动物的致病性,临床上应加大对该病的防治力度。
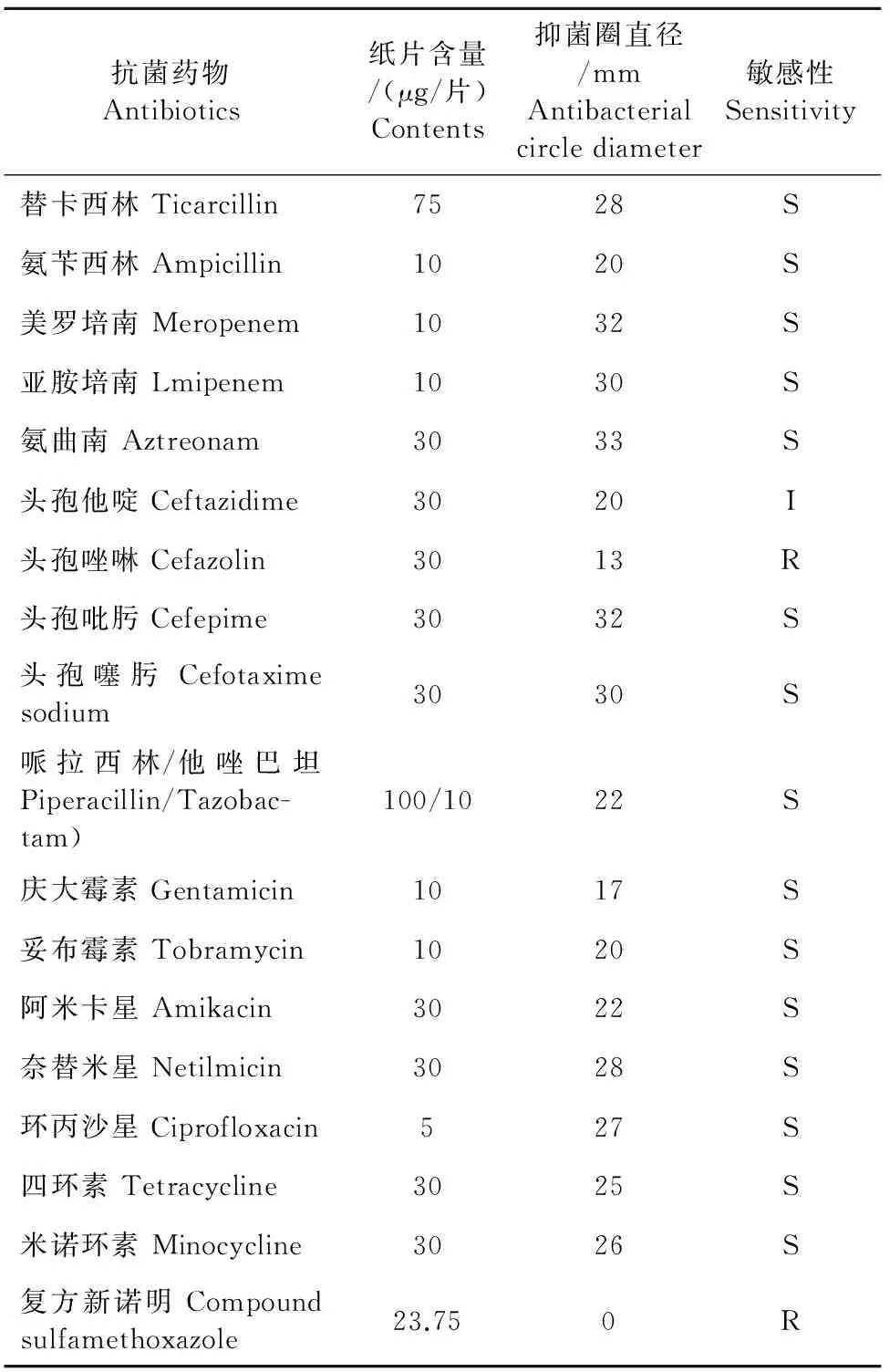
表3 分离菌株的药敏试验
注:S.敏感;I.中度敏感;R.耐药。
Note:S.Sensitive; I.Intermediary; R.Resistance.
棘腹蛙的人工养殖起步较晚,相关的资料积累还比较匮乏,导致了生产上往往盲目、超剂量使用抗生素进行治疗,既不利于疫病的有效防控,更可能造成水体环境的污染。本实验室近年致力于棘腹蛙细菌性疾病的防治,已报道了包括“白内障”、“消化系统出血症”等疾病[10-11]。通过研究发现,要做好棘腹蛙细菌性疾病的防治,既要依靠动物的机体免疫力发挥作用[12],也要注意合理利用消毒剂与抗菌药。本研究证实了致棘腹蛙水肿的弗氏柠檬酸杆菌分离株对大多数供试抗菌药敏感,针对性选取庆大霉素在养殖场使用之后,取得了良好的效果;环丙沙星、美罗培南和亚胺培南也是较佳的选择。对于有条件的养殖场,要保持养殖用水洁净无污染;在养殖区用生石灰粉喷洒,对于预防病原菌的滋生也有一定作用。
[1]李益得,廖长乐,毛寿林,等.我国珍稀两栖动物——棘腹蛙[J].经济动物学报,2012,16(2):119-122.
[2]赵尔宓.中国濒危动物红皮书:两栖类和爬行类[M].北京:科学出版社,1998:80-83.
[3]孙浩,郑礼洲,魏伟,等.大鲵水肿病病原的分离鉴定及生物学特性研究[J].江西农业大学学报,2014,36(1):193-198.
[4]薛巧,赵战勤,刘会胜,等.弗氏柠檬酸杆菌对动物和人致病性研究进展[J].动物医学进展,2015,36(7):81-85.
[5]Du X X,Wang J F,Fu Y,et al.Genetic characteristics of blaNDM-1-positive plasmid inCitrobacterfreundiiisolate separated from a clinical infectious patient [J].J Med Microbiol,2013,62(9):1332-2337.
[6]Wei Y,Wang J.Identification of ACT-1 plasmid-mediated AmpC β-lactamase producingCitrobacterfreundiifrom a chinese patient[J].Ann Lab Med,2013,33(1):86-88.
[7]Kim M J,Park J S,Lim H J,et al.Emphysematous pyelonephritis caused byCitrobacterfreundiiin a patient with type 2 diabetes and neurogenic bladder[J].Infect Chemother,2013,45(3):331-334.
[8]Plakkal N,Soraisham A S,Amin H.Citrobacterfreundiibrain abscess in a preterm infant:a case report and literature review [J].Pediatr Neonatol,2013,54(2):137-140.
[9]高正勇,曾令兵,孟彦,等.患病大鲵中弗氏柠檬酸杆菌的分离与鉴定[J].微生物学报,2012,52( 2):169-176.
[10]廖冰洁,樊汶樵,周莉,等.一例棘腹蛙“白内障”的病原分离鉴定[J].湖北畜牧兽医,2014,35(8),8-11.
[11]吴宝红,樊汶樵,姜玉松,等.金黄杆菌感染棘腹蛙的分离鉴定[J].中国兽医杂志,2015,51(12),97-99.
[12]史若男,李婉,宋丽婷,等.动物免疫抑制研究进展[J].动物医学进展,2014,35(9):93-96.
Isolation and Identification of Pathogenic Bacteria Caused “Edema Disease” inPaaboulengeri
LI Xiao-ying,LUO Jie,DU Xiao-tian,LONG Fang-wei,HU Kai,XU Jing-ming,FAN Wen-qiao
(College of Forestry and Life Science,Chongqing University of Arts and Sciences,Chongqing Research Center ofConservationandDevelopmentonRareandEndangeredAquaticResources,Chongqing,402168,China)
To understand the main biological characteristics of pathogen inPaaboulengerithat suffered from “edema disease” and the methods to treat this disease,10 adult frogs (2 years old) with the typical symptoms of edema disease were collected,and candidate bacteria were isolated from the pathological tissue after dissection.Then the cultured characteristics observation,pathogenic experiment,physiological and biochemical identification,16 S rDNA sequence,and drug sensitivity test of candidate bacteria were conducted.Results showed that a Gram negative and nonspore bacillus,named as CQWU201501,was isolated from the peritoneal cavity.Physiological and biochemical characteristics and 16 S rDNA sequence indicated asCitrobacterfreundii.Drug sensitivity test revealed that the strain was sensitive to the majority drug of β-lactam,aminoglycosides,quinolones and tetracycline.Above all,theCitrobacterfreundiistrain was bacterial pathogen leading to “edema disease” ofPaaboulengeri; this pathogeny was sensitive to 16 drugs,only resistant to cefamedin and compound sulfamethoxazole.Appropriate drugs could be chosen for symptomatic treatment.
Paaboulengeri; edema disease; isolation and identification; drug resistance
2016-01-11
重庆市基础与前沿技术研究(重点)专项(cstc2015jcyjBX0013);重庆市基础与前沿研究计划一般项目(cstc2014jcyjA80042); 重庆文理学院人才引进项目(R2013LS13,R2014LX07)
李晓英(1973- ),女,四川荣县人,副教授,主要从事食源性动植物产品质量控制研究。*通讯作者
S917.1
B
1007-5038(2016)08-0116-04
