鸭坦布苏病毒在感染蛋鸭卵巢、脾脏及泄殖腔的分布规律
2016-09-21甘振磊安欣宇周如月王贵平冯晓声
王 伟,田 浪,甘振磊,刘 琪,安欣宇,周如月,王贵平,冯晓声*
(1.广东海大畜牧兽医研究院,广东广州 511400;2.广东海大集团股份有限公司,广东广州 511400)
鸭坦布苏病毒在感染蛋鸭卵巢、脾脏及泄殖腔的分布规律
王伟1△,田浪2△,甘振磊1,刘琪1,安欣宇1,周如月1,王贵平1,冯晓声1*
(1.广东海大畜牧兽医研究院,广东广州 511400;2.广东海大集团股份有限公司,广东广州 511400)
探讨鸭坦布苏病毒在感染蛋鸭卵巢、脾脏及泄殖腔分布规律,为疫苗研究和筛选提供参考依据,选用210只200日龄~220日龄无鸭坦布苏病毒感染的蛋鸭,随机分为7组,1组~6组腿部肌肉注射鸭坦布苏病毒液,7组腿部肌肉注射生理盐水作为对照组,攻毒后每天观察临床症状,分别于感染后第2、5、8、11、16、21天分6批次处死,取脾脏、卵巢及泄殖腔进行病毒分布情况检测。结果显示,攻毒后蛋鸭采食量、产蛋率均降低,并排有绿色粪便;剖检发现脾脏充血、肿大,卵巢萎缩,卵泡破裂,个别出现卵黄性腹膜炎;通过RT-PCR检测不同时间段卵巢、脾脏、泄殖腔等带排毒情况,并结合卵巢病变情况,可知本次试验中不同感染剂量的鸭坦布苏病毒在卵巢和脾脏内分别在第11天和第5天带毒最多,为今后疫苗的研制及免疫效果判定提供了依据。
鸭坦布苏病毒;体内分布;蛋鸭
鸭坦布苏病毒(Duck Tembusu virus,DTMUV)是2010年以来在我国大部分地区发现的主要危害蛋鸭、种鸭、种鹅、蛋鸡、雏鸭等的新发病毒,它属于黄病毒科、黄病毒属[1-4]。主要侵害鸭的生殖系统[5],致使种(蛋)鸭发热,采食量和产蛋量急剧下降,可从产蛋高峰迅速下降至20%~30%,甚至停止产蛋,发病率几乎100%,死淘率为0~12%[6-7],对我国养鸭业造成了巨大经济损失,目前市场上尚未推出疫苗来预防此病。蛋鸭、蛋鸡和肉鸭感染DTMUV后,病毒主要分布在卵巢[8-10]、脾脏[11]等组织器官,且检出率最高,剖检病变主要为卵泡变性萎缩、卵泡出血和卵泡液化,个别出现卵黄性腹膜炎,脾脏充血、肿大等[8-13]。为了有效预防鸭坦布苏病毒病,为今后评价疫苗、抗病毒药等免疫保护与防治效果方面提供依据,探讨感染不同攻毒剂量鸭坦布苏病毒蛋鸭的卵巢、脾脏及泄殖腔带排毒情况具有重要意义。本试验选择尚未发生过此病的蛋鸭人工感染DTMUV,通过RT-PCR方法检测不同攻毒剂量对蛋鸭的卵巢、脾脏、泄殖腔等感染情况,并结合蛋鸭卵巢的病理变化,确定该病毒攻毒后在蛋鸭的感染规律。通过该病毒在体内的主要靶器官的发生、发展规律及排毒途径,也为该病的防控提供理论依据。
1 材料与方法
1.1材料
1.1.1毒株与试验用动物鸭坦布苏病毒由广东海大畜牧兽医研究院在广东省内分离、鉴定、保存。200日龄~220日龄产蛋麻鸭购自广东某养鸭场。
1.1.2主要试剂RNA提取试剂盒,OMEGA公司产品;反转录酶、RNase抑制剂,TOYOBO公司产品;DNA Maker DL 2 000、2×Taq-Neo PCR预混液,宝生物工程(大连)有限公司产品。
1.2方法
1.2.1病毒ELD50的测定病毒在Vero细胞增殖后,取适量病毒经10倍稀释后接种9日龄SPF鸡胚,每天观察,弃掉24 h内死亡鸡胚,接种5 d后统计各组死亡鸡胚数,测定病毒滴度。1.2.2试验动物分组与攻毒210只200~220日龄无鸭坦布苏病毒感染的蛋鸭,预饲1周,攻毒前经检测鸭坦布苏病毒及其抗体均为阴性。随机分成7组,每组各30只。1组~6组腿部肌肉注射鸭坦布苏病毒液,7组腿部肌肉注射生理盐水作为对照组,每只蛋鸭注射剂量为1 mL(表1)。每组隔离分开饲养,攻毒后每天观察临床症状,分别于感染后2、5、8、11、16、21 d分6批次处死取病料,每次每组随机挑选5只,放血处死。取脾脏、卵巢以及泄殖腔拭子等样品置-20℃冻存,采用RT-PCR方法检测病毒。
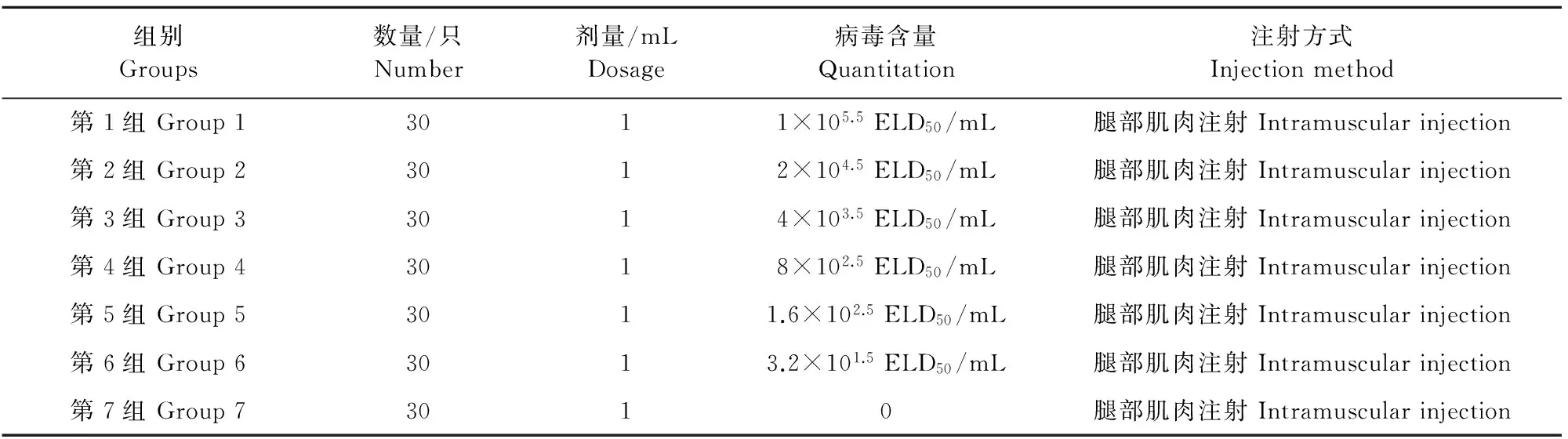
表1 分组及攻毒情况
1.2.3大体病理学观察处死蛋鸭,观察脾脏、卵巢等组织病理变化。
1.2.4RT-PCR检测
1.2.4.1引物的设计与合成按文献[14]报道的序列合成了1对扩增结构蛋白(囊膜蛋白E)保守序列的引物。引物序列为:上游引物 P1:5′-GCTACGGAATTAGCGGTTGT-3′,下游引物P2:5′-TAATCCTCCATCAGCGGTGTAG-3′,扩增目的片段大小为401 bp。
1.2.4.2病毒RT-PCR检测按照RNA提取试剂盒(OMEGA)说明书提取病毒RNA,置-20℃保存备用。根据本实验室建立的RT-PCR方法对脾脏、卵巢、泄殖腔粪便进行检测。
2 结果
2.1病毒的滴度
增殖的病毒在9日龄SPF鸡胚上测定的病毒滴度为105.5ELD50/mL。
2.2临床症状及剖检变化
2.2.1临床症状1组试验鸭攻毒后2 d,采食量、产蛋率均开始下降,并排有绿色粪便;第5天采食显著下降,产蛋率为0;第8天和第11天采食量依然低下,产蛋率为0,第16天采食量开始逐渐增加,卵巢病变逐渐减轻,但仍未产蛋。2组和3组症状与1组情况相似,4组、5组、6组症状则依次减轻,在第11天采食量开始逐渐增加,卵巢病变逐渐减轻,但仍未产蛋。对照组无任何肉眼可见症状变化。
2.2.2剖检变化1组试验鸭攻毒后2 d剖检,脾脏肿大、充血成斑驳状;卵巢萎缩(图1)。其他各组试验鸭脾脏出血,卵黄液化(图2),卵巢病变程度依次减轻。攻毒后5 d脾脏萎缩,卵泡破裂、卵黄液化(图3)。其他各组试验鸭攻毒后5 d,脾脏轻微肿大,卵巢病变多以卵黄液化为主,个别鸭卵巢萎缩(图4)。攻毒后8 d脾脏轻微肿大,卵巢萎缩似“葡萄状”(图5)。其他各组脾脏肿大,卵巢萎缩,卵泡破裂,卵黄液化。攻毒后11 d,1组试验鸭卵巢萎缩,卵泡发育受到抑制,卵泡出现坏死(图6)。2组和3组卵巢持续成萎缩状态,卵泡发育受到抑制。4组、5组和6组个别卵巢已有成型的卵泡形成。7组无肉眼可见症状。
2.3病毒RT-PCR检测
攻毒后不同时间各组样品PCR检测及卵巢病变统计结果表2。
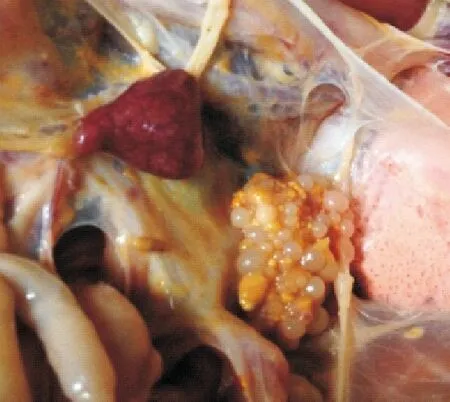
图1 卵巢萎缩,脾脏充血、肿大
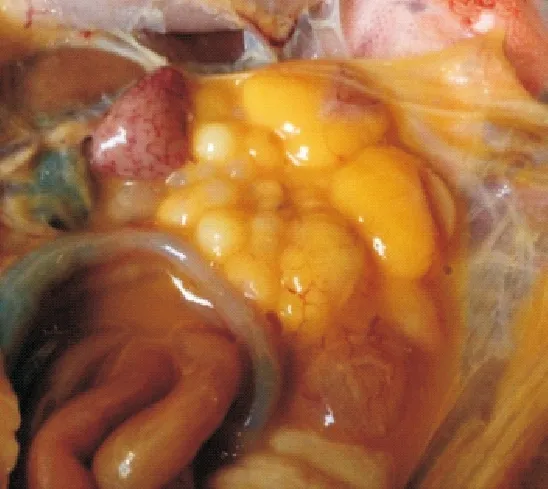
图2 脾脏出血,卵黄液化
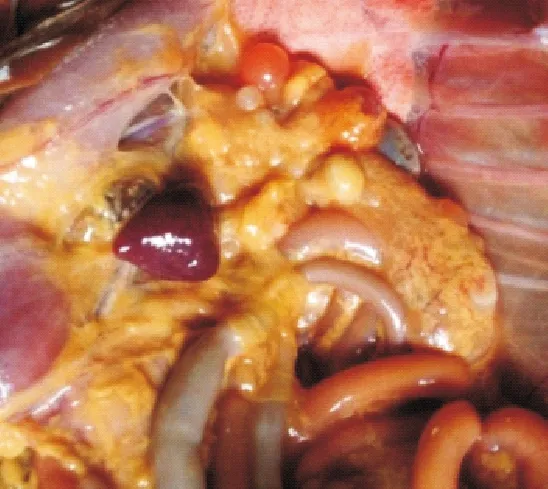
图3 脾脏萎缩,卵泡破裂、卵黄液化
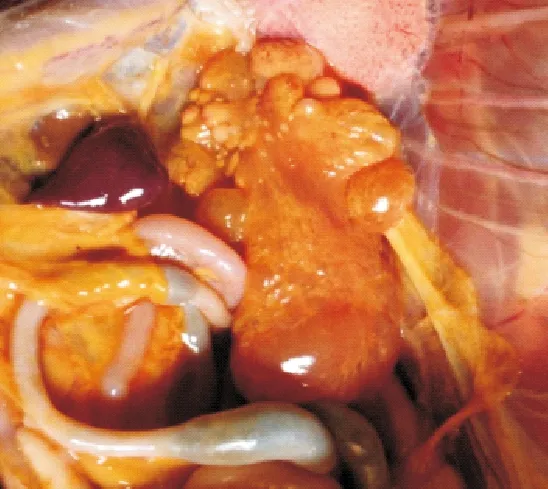
图4 卵泡破裂、卵黄液化
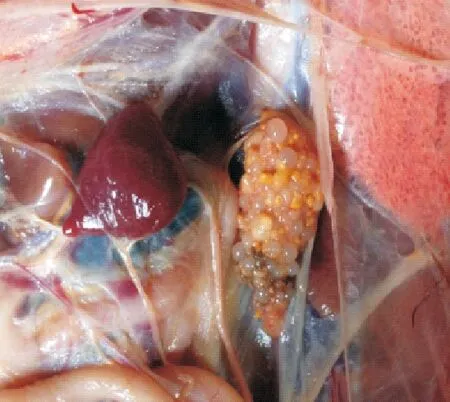
图5 脾脏轻微肿大,卵巢萎缩似“葡萄状”
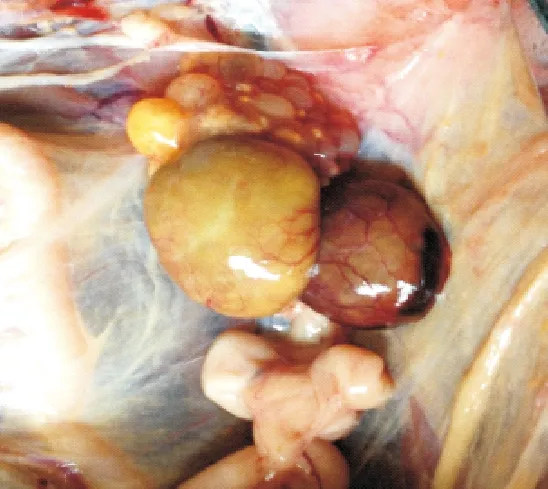
图6 卵泡出现坏死
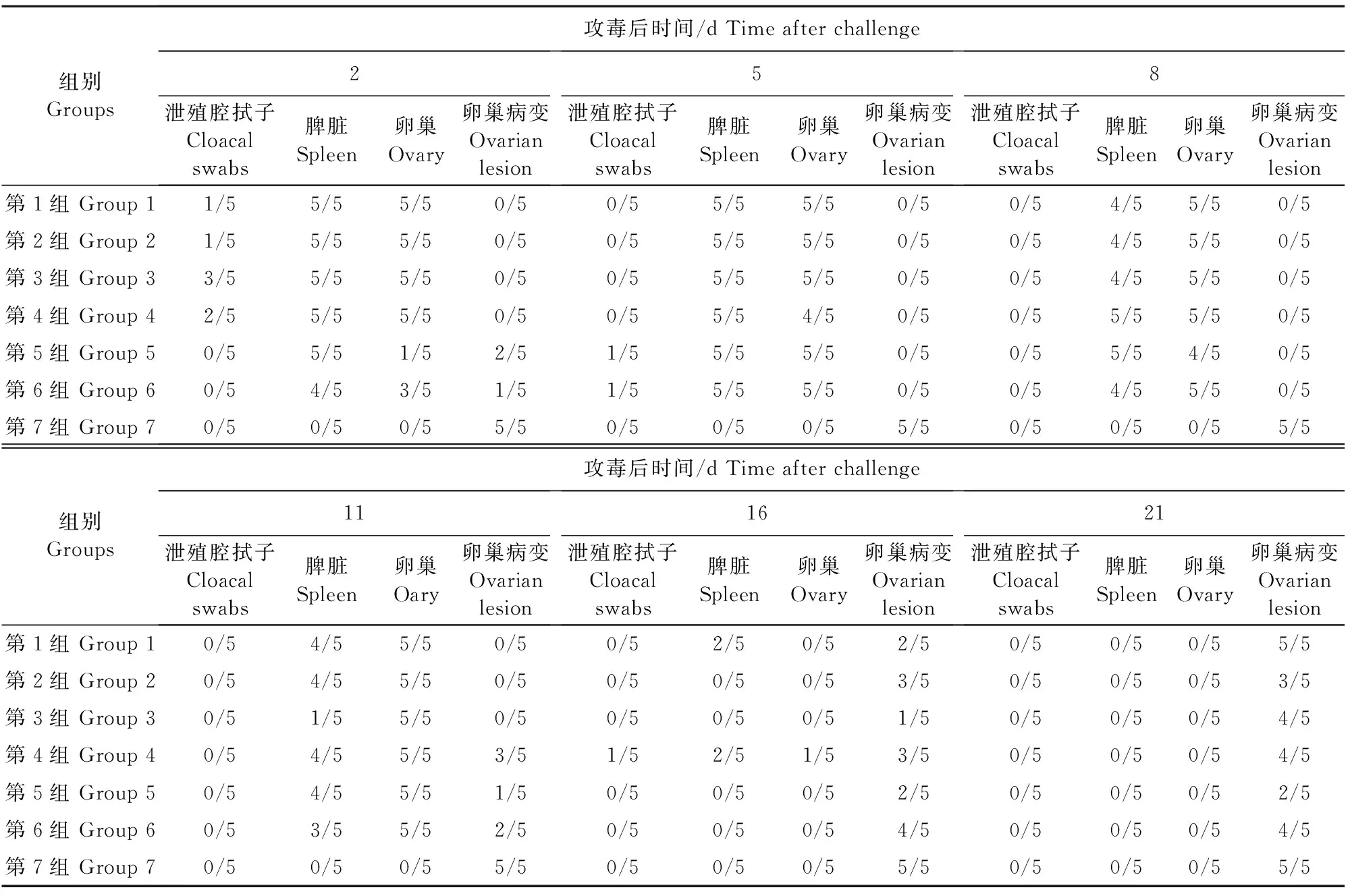
组别Groups攻毒后时间/dTimeafterchallenge2泄殖腔拭子Cloacalswabs脾脏Spleen卵巢Ovary卵巢病变Ovarianlesion5泄殖腔拭子Cloacalswabs脾脏Spleen卵巢Ovary卵巢病变Ovarianlesion8泄殖腔拭子Cloacalswabs脾脏Spleen卵巢Ovary卵巢病变Ovarianlesion第1组Group11/55/55/50/50/55/55/50/50/54/55/50/5第2组Group21/55/55/50/50/55/55/50/50/54/55/50/5第3组Group33/55/55/50/50/55/55/50/50/54/55/50/5第4组Group42/55/55/50/50/55/54/50/50/55/55/50/5第5组Group50/55/51/52/51/55/55/50/50/55/54/50/5第6组Group60/54/53/51/51/55/55/50/50/54/55/50/5第7组Group70/50/50/55/50/50/50/55/50/50/50/55/5组别Groups攻毒后时间/dTimeafterchallenge11泄殖腔拭子Cloacalswabs脾脏Spleen卵巢Oary卵巢病变Ovarianlesion16泄殖腔拭子Cloacalswabs脾脏Spleen卵巢Ovary卵巢病变Ovarianlesion21泄殖腔拭子Cloacalswabs脾脏Spleen卵巢Ovary卵巢病变Ovarianlesion第1组Group10/54/55/50/50/52/50/52/50/50/50/55/5第2组Group20/54/55/50/50/50/50/53/50/50/50/53/5第3组Group30/51/55/50/50/50/50/51/50/50/50/54/5第4组Group40/54/55/53/51/52/51/53/50/50/50/54/5第5组Group50/54/55/51/50/50/50/52/50/50/50/52/5第6组Group60/53/55/52/50/50/50/54/50/50/50/54/5第7组Group70/50/50/55/50/50/50/55/50/50/50/55/5
注:a/5(a=0,1,2,3,4,5):表示阳性百分数;卵巢有病变为“0”,包括卵巢萎缩、坏死;有成型卵形成为“1”。
Note:a/5(a=0,1,2,3,4,5) indicates a positive percentage; ovary lesion as“0”, including ovarian atrophy and necrosis; forming follicle as“1”.
从表2可以看出,攻毒后第2天,1、2、3、4组泄殖腔拭子可部分检出病毒,5、6组在第5天可检出部分病毒,3组泄殖腔拭子检出率最高,占60%。1、2、3组在攻毒后第2、5、8、11天阳性检出样本占100%,且攻毒后第11天,攻毒各组卵巢阳性检出率最高,均达100%,4、5、6组在攻毒后第2、5、8天阴性检出样本占20%~80%。4组和5组在攻毒后第2、5、8天脾脏阳性检测率最高,均达100%,1、2、3组在第8天阳性检出率均下降20%。1、2、3组在攻毒后第2、5、8、11天,卵巢均有病变发生,发生率占100%,4组在第11天卵巢病变开始减少,5、6组则在第2天和第11天有部分成型卵形成。
3 讨论
黄病毒属的成员能引起多种动物和人发病,且多数是由蚊和蜱等吸血昆虫的叮咬而传播[15-16]。我国南方流行的登革热主要通过库蚊进行传播。鸭坦布苏病毒属于黄病毒属的成员,其潜在的危害有待进一步研究。本研究关于试验动物和日龄的选择,主要针对此病对产蛋鸭的卵巢功能造成严重损害,使产蛋量急剧下降,故选择200日龄~220日龄的开产蛋鸭作为试验对象。
陈雷等[17]研究表明,人工感染13日龄的雏麻鸭,1 d后即向外界排毒,一直持续到25 d。本试验从蛋鸭泄殖腔拭子的检测结果来看,3组攻毒剂量的发病蛋鸭泄殖腔拭子在第2 天阳性检出率最高,占60%,之后均未检出阳性。其他攻毒组在第2天可检出部分阳性,第5天至21天偶有样品检出阳性。以上结果显示鸭坦布苏病毒感染初期能经粪便排毒,但不是最主要的排毒方式,相对于日龄较小的雏鸭,可能因其机体免疫功能尚未成熟,导致其排毒时间较开产蛋鸭长。
林健等[10]选择经鸭胚尿囊液培养的DHOV-HB株(F4代)病毒以每只约104个ELD50的剂量经滴鼻、点眼和口服途径感染15只产蛋鸭,接毒后7 d卵泡膜、脾脏可分离到病毒,感染后9 d从卵泡膜中可分离到病毒,经证实此病对产蛋鸭生殖系统的损害最为严重。于春梅等[18]也证实此病感染产蛋鸡后9 d,只在卵泡膜分离到病毒,主要影响蛋鸡的生殖系统。周晓波等[11]选择鹅源坦布苏JS804株病毒建立了35日龄樱桃谷肉鸭感染鸭坦布苏病毒病的发病模型,并确定了最佳攻毒剂量为1.6×106TCID50,攻毒后第8天发病最严重,且病毒含量最高的器官是脾脏。本试验结合鸭坦布苏病毒病在蛋鸭的主要分布情况,对卵巢和脾脏的带排毒情况进一步探讨。通过对卵巢和脾脏鸭坦布苏病毒的检测,从表2可以看出,1、2、3组在攻毒后第2天至第11天卵巢检出率最高,且均能达到100%,4、5、6组在攻毒后第2、5、8天阴性检出样本占20%~80%,但各组卵巢在攻毒后11 d检出率均为100%。1组和2组在第8~11天时脾脏检出率均为80%,3组脾脏在第8天时检出率为80%,在第11天为20%,第16天和第21天均未检测出阳性,4组和5组在攻毒后第2、5、8天阳性检出率均为100%,之后逐渐转为阴性,但各组脾脏在攻毒后第5天检出率均为100%。以上数据显示,不同攻毒剂量对蛋鸭卵巢、脾脏的感染,分别在第11天和第5天阳性检出率最高。
临床上,蛋鸭感染鸭坦布苏病毒后,病理变化主要表现脾脏充血、肿大;卵泡出血、变性、破裂,可造成卵黄性腹膜炎。为了进一步证实不同攻毒剂量对蛋鸭卵巢的感染情况,通过肉眼观察临床病变,为今后疫苗的免疫效果判定提供间接依据,本试验通过对不同攻毒剂量的发病蛋鸭剖检观察大体病理变化,从表2可以看出,攻毒各组在第5天和第8天卵巢仍处在萎缩或坏死等现象,发生率均为100%。1、2、3组攻毒后第11天卵巢仍存在萎缩,无正常发育卵泡形成,随着攻毒剂量的降低,4、5、6组卵巢病变从第11天开始逐渐恢复,攻毒后21 d仍尚未开始产蛋,而临床上鸭坦布苏病毒整个发病周期约为30 d左右,本次试验从时间上看,攻毒起始至卵巢机能逐渐恢复基本与临床发病过程相吻合。综上所述,本次试验不同感染剂量的DTMUV在卵巢和脾脏中分别在第11天和第5天带毒最多,为今后疫苗的研制及免疫效果判定提供了依据。
[1]刘友生.我国鸭坦布苏病毒分子流行病学研究[D].江西南昌:江西农业大学,2012.
[2]赵东敏,黄欣梅,刘宇卓,等.新型黄病毒在种鹅中垂直传播的研究[J].南方农业学报,2012,43(1):99-102.
[3]李宁,石迎,吕传位,等.鸭坦布苏病毒对雏鸭的致病性研究[J].畜牧兽医学报,2015,46(3):476-481.
[4]张丹俊,沈学怀,赵瑞宏,等.鸭坦布苏病毒对产蛋鸡的致病性研究[J].中国家禽,2015,34(13):13-17.
[5]林健,韩春华,陈华林,等.鸭出血性卵巢炎试验感染模型的建立[J].中国农业科学,2011,44(10):2161-2167.
[6]万春和,施少华,黄瑜,等.一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J].福建农业学报,2010,25(6):663-666.
[7]Yan Pixi,Zhao Youshu,Zhang Xu,et al.An infectious disease of ducks caused by a newly emerged tembusu virus strain in mainland China [J].Virology,2011,417 (1):1-8.
[8]曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[9]滕巧泱,颜丕熙,张旭,等.一种新的黄病毒导致蛋鸭产蛋下降及死亡[J].中国动物传染病学报,2010,18(6):1-4.
[10]Su Jingliang,Li Shuang,Hu Xudong,et al.Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related flavivirus [J].PLos One,2011,6(3):e18106.
[11]周晓波.鸭坦布苏病毒病发病模型的建立及免疫抗体持续期的测定[D].江苏南京:南京农业大学,2012.
[12]朱丽萍,颜世敢.鸭坦布苏病毒研究进展[J].中国预防兽医学报,2012,34(1):79-82.
[13]王善辉,李云龙,成子强.鸭坦布苏病毒江苏XZ株的分离和鉴定[J].中国畜牧兽医,2013,40(11):185-188.
[14]胡旭东,路浩,刘培培,等.我国发现的一种引起鸭产蛋下降综合征的新型黄病毒[J].中国兽医杂志,2011,47(7):43-47.
[15]de Barros V E,Saggioro F P,Neder L,et al.An experimental model of meningoencephalomyelitis by rocio flavivirus in BALB/c mice: inflammatory response,cytokine production,and histopathology [J].Am J Trop Med Hyg,2011,85(2):363-373.
[16]Vaidya N K,Wang F B,Zou X,et al.Transmission dynamics of the recently-identified BYD virus causing duck egg-drop syndrome[J].PLoS One,2012,7(4):e35161.
[17]陈雷,傅光华,黄瑜,等.鸭坦布苏病毒在雏麻鸭体内的分布及排毒[J].中国动物传染病学报,2013,21(2):20-24.
[18]于春梅.坦布苏病毒的分离鉴定及荧光定量RT-PCR检测方法的建立与应用[D].山东泰安:山东农业大学,2013.
Study on Distribution of DTMUV in Ovaries,Spleen and Cloaca of Layer Ducks
WANG Wei1,TIAN Lang2,GAN Zhen-lei1,LIU Qi1,AN Xin-yu1,ZHOU Ru-yue1,WANG Gui-ping1,FENG Xiao-sheng1
(1.Guangdong Haid Institute of Animal Husbandry and Veterinary Medicine,Guangzhou,Guangdong,511400,China;2.GuangdongHaidGroupCo.,Ltd,Guangzhou,Guangdong,511400,China)
This study mainly discussed the distribution regulation of DTMUV in ovary,spleen and cloaca of infected layer ducks for the reference basis of vaccine research and screening.This study selected 210 layer ducks with the age of 200-220 days and non-infected DTMUV were randomly divided into 7 groups,1-6 groups with intramuscular injection of DTMUV,control group with normal saline. The clinical symptoms were observed after challenge.After infection in 2,5,8,11,16,21 days, the ducks were killed and the spleen,ovary and cloaca were collected.The results of this experiment revealed that layer ducks were lower in the intakes and laying rates after challenge.The autopsy found that spleen hyperemia,swelling,shrunken oaries,ruptured follicle,and yolk peritonitis occurred.RT-PCR was used to detect the virus contents in ovaries,spleens and cloaca of infected ducks in different time, and combined with ovarian lesions.The results showed that DTMUV contents in the ovaries and spleen were the most in 11th day and 5th day. The study laid the foundation for the future development and immune effect determination of vaccines.
Duck Tembusu virus;invivodistribution;layer duck
2016-01-05
广州市番禺区珠江科技新星专项项目(2013-专15-6.07)
王伟(1988-),男,安徽亳州人,硕士,主要从事禽类传染病研究。△同等贡献作者 *通讯作者
858.32;S852.659.6
A
1007-5038(2016)08-0065-05
