鞘磷脂类信号通路在肺纤维化发病机制中的作用
2016-09-21易吉平何兴轩中南大学公共卫生学院卫生毒理系湖南长沙40078DepartmentofHumanGeneticsandGenomicSciencesMountSinaiSchoolofMedicineNewYorkNY009USA
易吉平,曾 明,何兴轩(.中南大学公共卫生学院卫生毒理系,湖南长沙 40078;.Department of Human Genetics and Genomic Sciences,Mount Sinai School of Medicine,New York,NY 009,USA)
鞘磷脂类信号通路在肺纤维化发病机制中的作用
易吉平1,曾 明1,何兴轩2
(1.中南大学公共卫生学院卫生毒理系,湖南长沙 410078;2.Department of Human Genetics and Genomic Sciences,Mount Sinai School of Medicine,New York,NY 10029,USA)
肺纤维化是一组由多种病因引起的慢性肺部疾病,其病理特征包括肺组织炎性损伤、组织结构破坏、间充质胶原增多及细胞外基质沉积。其病因复杂,大部分肺纤维化疾病目前尚无有效的治疗方法。近几年研究表明,鞘磷脂类信号通路的激活与肺纤维化关系密切。本文综述了鞘磷脂类信号通路的组成、功能及其在肺纤维化中的作用,为深入探讨肺纤维化发病机制及其防治方法提供新思路。
肺纤维化;鞘磷脂类;神经酰胺类;酸性神经酰胺酶
肺纤维化包括特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、过敏性肺炎、尘肺及药物和放射线导致的肺纤维化。其过程主要包括肺泡损伤后引起纤维细胞的增殖和聚集、细胞外基质(extracellular matrix,ECM)沉积和胶原蛋白分泌增加,同时伴有炎性病变和组织结构损伤,最终出现肺纤维化[1]。鞘磷脂主要位于细胞膜和脂蛋白中,其降解和合成需要复杂的代谢步骤,这些降解和合成代谢的中间产物被称为鞘磷脂类(sphingelipids),主要参与细胞信号转导、细胞生长、增殖、凋亡、分化和衰老等过程。越来越多的证据表明鞘磷脂类信号通路在肺纤维化的发生发展中起着重要作用。本文重点讨论鞘磷脂类代谢通路与先天性肺纤维化、环境应激引起的肺纤维化和特发性肺纤维化的关系。
1 鞘磷脂类信号通路
鞘磷脂是大多数哺乳动物细胞膜和脂蛋白的重要组分,由鞘氨醇、脂肪酸、磷酸和胆碱或乙醇胺各1个组成。鞘磷脂作为细胞膜的结构性物质,具有维持生物膜完整性的重要功能,同时也是鞘磷脂类代谢通路的重要底物。鞘磷脂的降解和合成需要通过复杂的中间步骤,其降解和合成代谢的中间产物被称为鞘磷脂类,具有调节细胞生物学功能的作用。鞘磷脂酶(sphingomyelinases,SMase)是调节鞘磷脂代谢的主要酶类,在细胞因子、化学药物、γ射线和二氧化硅(silicon dioxide,SiO2)粉尘等的刺激下,SMase可分解鞘磷脂产生神经酰胺和磷酰胆碱,神经酰胺在神经酰胺酶(ceramidase,CDase)的作用下裂解为鞘氨醇,后者在鞘氨醇激酶(sphingosine kinase,SphK)作用下生成鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)(图1)。鞘磷脂类的各种形式相互转换,将细胞外信号分子经细胞膜传入细胞内发挥效应,调节细胞的生长、增殖、凋亡和分化,这一过程称为鞘磷脂类信号通路[2-3]。
1.1鞘磷脂酶
依据酶促反应最适pH及辅助因子的依赖性,可将SMase可分为3种亚型:酸性型、中性型和碱性型。中性SMase在Mg2+及Mn2+作用下才能进行活化,根据不同基因可编码不同的亚型(1,2和3型中性SMase),其中1型和2型中性SMase与酸性SMase(acid SMase,ASMase)被认为在调节应激诱导的凋亡中起关键性作用[4]。碱性SMase在动物中主要在小肠绒毛表达;在人类中主要在肝和胆囊中表达,在胆汁盐的条件下,用于消化食物中的鞘磷脂,同时对消化道肿瘤具有一定的抑制作用[5]。ASMase的生物学活性占SMase总活性的90%,是鞘磷脂类代谢的一种关键溶酶体酶(最适pH 4.5~5.0),其最初是在遗传缺陷的尼曼-匹克病(Niemann-Pick disease,NPD)患者中发现的[6]。炎症因子、G蛋白偶联受体、生长因子和细胞应激等各种刺激均可活化ASMase,ASMase可从溶酶体转移至细胞膜表面[7],作用于鞘磷脂磷酸二脂键,生成神经酰胺和磷酰胆碱,启动初始信号的传导。ASMase的代谢产物神经酰胺作为第二信使,参与细胞的凋亡、增殖、氧化应激反应和免疫炎症反应,ASMase通过间接调节神经酰胺的生成调节机体的生化反应。ASMase是分子质量约70 ku的糖蛋白,由SMPD1基因编码而成,其生物合成主要包括蛋白水解、糖基化和磷酸化作用及形成二硫键的过程。在人体肺组织中含量最多,其次是肝[8]。
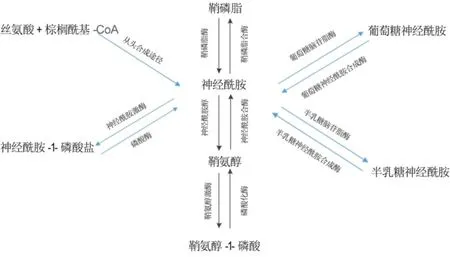
图1 鞘磷脂代谢路径.
1.2神经酰胺
人体内游离的神经酰胺含量较少,主要以鞘磷脂形式存在于细胞膜内,对细胞稳态起着重要的生理作用。SMase对鞘磷脂的代谢反应是外界刺激因子引起细胞内神经酰胺增加的主要因素,且反应时间短、生成量大。除了由鞘磷脂水解外,神经酰胺还可经从头合成途径生成,以丝氨酸和棕榈酰辅酶A为原料开始。神经酰胺是当前鞘磷脂类物质研究的热点,它是鞘磷脂信号途径的中心分子,具有第二信使效应作用。参与激活多种蛋白激酶和蛋白磷酸酶,从而启动级联的信号通路,将细胞外信号传导细胞内,调控细胞的凋亡(包括自噬)、应激、免疫、炎性等生理功能[9]。当细胞受低氧、细胞因子、电离辐射等外源因素刺激时,神经酰胺将会富集在细胞膜上形成“脂筏”,这些“脂筏”既能触发活性氧(reactive oxygen species,ROS)的生成,干扰机体内抗氧化酶的生理功能,还能激活c-Jun NH2端激酶/应激活化蛋白激酶(C-Jun NH2-terminal kinase/stress activated protein killase,JNK/SAPK)信号转导途径从而导致细胞凋亡[10-11]。神经酰胺在肺纤维化发生发展中发挥重要作用,它能引起多种炎症蛋白表达,从而扩大炎症的级联反应。肺纤维化中神经酰胺主要来源于ASMase水解鞘磷脂,应用小干扰RNA(siRNA)、药物抑制ASMase活性而减少神经酰胺表达可减少相关炎性因子和活性氧的产生[12]。
1.3神经酰胺酶及其代谢产物
CDase能分解神经酰胺,生成鞘氨醇,进一步经SphK作用下生成具有生长因子活性的S1P。根据CDase活性pH范围的不同,又可分为酸性、中性和碱性3种亚型。酸性神经酰胺酶(acid ceramidase,ACDase)位于哺乳动物细胞溶酶体内,其发挥活性的最佳pH<4.5,是鞘磷脂代谢的关键限速酶,ACDase在细胞内的神经酰胺和其下游产物-S1P间扮演着类似“开关转换器”的角色,通过调控两者间的比率进而抑制细胞凋亡和促进细胞生存[13]。ACDase活性对哺乳动物的发育显得尤为重要,其遗传缺陷将会导致神经酰胺堆积的法伯病(Farber disease,FD)。越来越多的研究结果显示,ACDase表达失调与胰岛素抵抗[14]和2型糖尿病、阿尔茨海默病、进展性关节疼痛[15]和癌症[16]等疾病相关。He等[17]研究认为在细胞中ACDase与ASMase以一种复合体形式存在,两者存在密切的相互关系。有研究表明,人类重组CDase能降低原代软骨细胞神经酰胺的含量,增加鞘氨醇水平,减少细胞凋亡,整体上改变细胞的结局[18]。
S1P是一种高度生物活性的脂类介质,是神经酰胺的次级代谢产物,主要储存在血小板中[19]。S1P信号与细胞的多种生命活动密切相关,通过与受体结合或直接进入细胞内作为第二信使参与细胞增殖、凋亡、迁移、骨架重建和细胞分化等过程,其在血管性疾病、炎症、肿瘤和自身免疫疾病等方面的作用越来越受到重视[20]。S1P主要通过改变血管通透性、白细胞浸润、迁移、扩散和成纤维化参与促纤维化的过程,还能引起Ca2+向细胞内迁移,导致细胞增殖,抑制细胞凋亡和细胞迁移,调节黏附因子的表达[21-23]。
2 鞘磷脂类信号通路与肺纤维化
肺纤维化的高发病率和死亡率一直是临床治疗的难点[21],目前尚无特效的治疗方法。根据病因的不同可将肺纤维化分为环境和职业相关性肺纤维化、IPF、先天性肺纤维化、药物或治疗相关性肺纤维化和风湿免疫性肺纤维化疾病。Tager等[24]发现,肺纤维化患者的肺泡灌洗液中鞘磷脂水平发生变化,与肺泡及表面活性物质的破坏和肺纤维化过程密切相关。目前研究表明,鞘磷脂类信号通路与肺纤维化发病密切相关,尤其是在遗传缺陷引起的肺纤维化、环境应激引起的肺纤维化与特发性肺纤维化[25]。
2.1鞘磷脂类信号通路参与遗传缺陷引起的肺纤维化
囊性纤维化(cystic fibrosis,CF)是一种由囊性纤维化跨膜传导调节基因(cystic fibrosis transmembrane conductance regulator,CFTR)突变引起的常染色体隐性遗传慢性疾病[26]。该病常见于西方国家,在欧洲及北美白人中较常见,其发病率约为1/2500。CF患者发生广泛性肺纤维化和肺气肿,肺部有持续性慢性炎症反应和细菌感染,导致其死亡率较高。关于CFTR突变导致CF的分子机制尚未清楚。近年来研究表明,神经酰胺是CF炎症反应的关键调节因子。Becker等[27-28]研究发现,在CF患者及小鼠的肺组织中神经酰胺含量与肺部感染严重程度呈正相关,用ASMase抑制剂或基因剔除后,小鼠肺部神经酰胺趋于正常,同时肺部病理情况及对铜绿假单胞菌的易感性有所改善。结果提示,ASMase的抑制剂可能是治疗CF疾病新的策略。关于CF患者体内神经酰胺含量增多的原因,有研究认为是由于CFTR突变导致细胞囊泡的碱化,改变pH后导致ASMase水解鞘磷脂生成神经酰胺与ACDase分解神经酰胺失衡,使细胞内神经酰胺含量明显升高[29-30]。关于神经酰胺在肺部炎症反应中的作用,Teichgräber等[31]认为,神经酰胺是炎症反应的重要信号分子,它能引起多种炎症蛋白的表达,从而扩大炎症的级联反应。近期研究表明,cftr基因缺陷的小鼠还能激活CD95死亡受体信号通路,而激活的CD95又能上调神经酰胺的水平,两者能形成一个恶性循环,增加肺部对细菌的易感性,促进肺纤维化的形成[11]。此外,Dhami等[22]在野生型小鼠和ASMase-/-小鼠气管内滴入博来霉素,发现正常小鼠患有肺纤维化疾病而ASMase-/-小鼠并未发现病变,说明ASMase基因缺陷的小鼠对肺纤维化具有预防作用。目前,ASMase的有效抑制剂包括三环类抗抑郁药(地昔帕明、丙米嗪和阿米替林)以及二磷酸盐类等,主要是通过屏蔽带负电荷的溶酶体膜脂质和将ASMase从溶酶体膜中分离等方式降低ASMase的活性,使其更易被蛋白水解。这些药物具有非特异性及在细胞内易被代谢的特点,因此,研发一种选择性强且活性高的ASMase抑制剂是未来治疗CF疾病的新方向。
2.2磷脂类信号通路参与环境应激引起的肺纤维化
目前生活和生产环境中存在许多有害因素,如有害气体、生产性粉尘、辐射、致病微生物和雾霾等。人长期处于这些环境中,吸入有害气体或粉尘容易引起肺部的氧化应激和炎症反应,促进肺成纤维细胞胶原蛋白的沉积,从而引起肺纤维化。研究表明,鞘磷脂类信号通路参与环境应激引起的肺纤维化疾病如石棉肺和硅肺的发病过程。
人体长期吸入的石棉和硅尘后,在肺内能诱导炎症细胞因子如转化生长因子-β1(transforming growth factor-β1,TGF-β1)、肿瘤坏死因子-ɑ(tumour necrosis factor-α,TNF-α)及血小板衍生生长因子(platelet derived growth factor,PDGF)的产生[32],它们均能催化机体产生一系列ROS和活性氮(reactive nitrogen species,RNS)[33],后者也均能活化ASMase产生神经酰胺[34],从而改变细胞内活性鞘磷脂类物质之间的稳态平衡而影响细胞效应。使用ROS清除剂及抗氧化剂对ROS进行中和反应处理时,可显著减少ASMase的活化及神经酰胺诱导的细胞凋亡[35]。在小鼠气管内加入外源性TNF-α,能提高肺泡灌洗液中ASMase活性和神经酰胺浓度,增加肺血管的通透性,减少肺表面活性物质的产生,引起更多的炎症细胞聚集,增加细胞外基质的产生,为成纤维细胞的迁移提供更合适的微环境,间接引起肺纤维化[36]。Jin等[37]研究发现,SiO2粉尘能刺激肺巨噬细胞产生炎性因子如白细胞介素8(interleukin-8,IL-8),TGF-β1和TNF-α,它们均能诱导肺成纤维细胞的ASMase活性和胶原Ⅲ表达明显增加,采用ASMase抑制剂地昔帕明干预处理后,细胞ASMase活性明显减少,胶原Ⅲ表达也明显下降。外界刺激因素作用下,细胞内氧化还原水平可影响ASMase活性,同时ASMase活力也可通过反馈机制影响细胞内氧化还原水平,胞膜中ASMase活性与鞘脂类之间可能存在一个复杂的作用网络,而细胞内过氧化水平则可能是两者相互联系的中介[38]。总之,促炎症细胞因子或ROS/RNS引发ASMase的活化可能在石棉及硅尘诱导的肺纤维化过程中发挥重要作用。
有研究发现,肺上皮细胞及巨噬细胞凋亡是诱导肺纤维化的启动及发病过程中的关键因素,而神经酰胺是诱导细胞凋亡的主要信号分子。Hubbard等[39]发现,将SiO2粉尘颗粒作用于小鼠肺泡巨噬细胞导致线粒体的去极化、ROS的释放、胱天蛋白酶(caspase)活化及细胞凋亡。采用地昔帕明或者柠檬酸铝(使表面活性位点迟钝)进行处理,发现胱天蛋白酶活性降低和细胞凋亡减少;尤其在使用ROS清除剂及抗氧化剂对ROS进行中和反应处理时,可显著减少ASMase的活化及神经酰胺诱导的细胞凋亡[39-40]。神经酰胺调控细胞凋亡参与肺纤维化的机制可能有两种,一是通过JNK途径的转录活化,另一种是改变线粒体的功能,最终使效应分子胱天蛋白酶活化,细胞内蛋白裂解和细胞器降解,从而使细胞发生凋亡[41]。
2.3鞘磷脂类信号通路参与特发性肺纤维化
IPF是临床上常见的进行性的、致死性的肺疾病,以肺成纤维细胞过度增生、细胞外基质沉积为特点,IPF是肺纤维化中较为重要的一种,因其进展快、死亡率高,尚无特效的药物治疗,被世界卫生组织称为肺系疑难病。临床上患者常出现进行性呼吸困难并伴有干咳,病情一般持续恶化,最终导致呼吸衰竭和肺心病。IPF的发病率呈上升趋势,据估计,目前我国IPF患者约50万,且病例还在持续增加[42]。
IPF的发病机制尚未完全阐明,但已有证据表明与免疫炎症损伤有关。致病因素作用于肺泡上皮细胞,损伤的上皮和炎症浸润的白细胞通过自分泌或旁分泌的形式产生TNF-α,TGF-β和IL-8等,同时人体Th1免疫细胞能诱发纤维化使Th2型细胞发生转变,这些炎症介质和免疫反应共同参与肺纤维化形成。局部损伤和炎症反应使机体氧化/抗氧化失衡,激活细胞膜表面的SMase,从而引起细胞膜上的酰胺分布异常,导致细胞损伤。Milara等[43]发现,IPF患者血清和肺泡灌洗液内SphK1活性升高,S1P水平也增高,且S1P水平与患者肺功能及生存率成负相关;可能机制是细胞外ROS激活SphK1使S1P增加,诱导肺泡上皮细胞向肺间充质表型分化以及成纤维细胞向肌成纤维细胞分化而参与IPF发病过程。Huang等[44]发现博来霉素诱导的肺纤维化小鼠吸入SphK1抑制剂8 d后,能降低小鼠死亡率,说明SphK1在IPF的病理过程中起到关键作用,因此SphK1可能成为IPF治疗的新方向。Scarpa等[45]发现IPF患者体内神经酰胺水平升高,且与凋亡和自噬相比,细胞增殖是其主要的病理特征,这可能是因为IPF患者体内高水平的S1P能逆转神经酰胺发生凋亡作用。因此,推测通过抑制S1P的生成可减少纤维细胞增生,有可能为IPF疾病的治疗提供一种新方法。
3 展望
国内外研究均证实鞘磷脂类信号通路参与肺纤维化的发病过程。环境中存在大量的有毒物如氧化剂能诱导ROS/RNS的聚集,氧化应激和ASMase活化的紧密联系在肺纤维化疾病中将是一个全新的研究思路。研究表明,鞘磷脂参与肺纤维化疾病主要是受到神经酰胺水平的调控,神经酰胺水平决定其发挥保护或损害作用[46]。低剂量的神经酰胺对细胞的生存和分化有营养作用,神经酰胺浓度异常时能在许多细胞中产生毒性并发挥促凋亡作用[47]。由于机体在氧化应激的情况下诱导ASMase活化及产生神经酰胺从而导致许多疾病的发生,ASMase抑制剂可能成为一类新的药物在防治肺纤维化中发挥重要作用[18]。CDase是神经酰胺代谢的关键酶,可有效地降低由ASMase所升高的神经酰胺水平,可能成为肺纤维化治疗中新的研究热点。然而,ASMase/神经酰胺信号通道在肺纤维化病理过程中的确切调控机制及其下游产物的变化规律仍待深入研究,另外具有生物学活性的鞘磷脂类成员在肺纤维化发生发展过程中的具体作用机制仍然不甚明确。深入研究鞘磷脂类信号通路的调控和作用机制,能进一步阐明肺纤维化的发病机制,从而对其预防和治疗提供新的策略。
[1]Sun J.Role of ROS in proliferation and collagensynthesis of fibroblasts induced by bleomycin(活性氧在博来霉素促成纤维细胞增殖和胶原合成分泌中的作用)[D].Changsha:Central South University(中南大学),2011.
[2]Boslem E,Meikle PJ,Biden TJ.Roles of ceramide and sphingolipids in pancreatic β-cell function and dysfunction[J].Islets,2012,4(3):177-187.
[3]Alewijnse AE,Peters SL.Sphingolipid signalling in the cardiovascular system:good,bad or both?[J].Eur J Pharmacol,2008,585(2-3):292-302.
[4]Clarke CJ,Wu BX,Hannun YA.The neutral sphingomyelinase family:identifying biochemical connections[J].Adv Enzyme Regul,2011,51(1):51-58.
[5]Duan RD.Alkaline sphingomyelinase:an old enzyme with novel implications[J].Biochim Biophys Acta,2006,1761(3):281-291.
[6]Ségui B,Andrieu-Abadie N,Jaffrézou JP,Benoist H,Levade T.Sphingolipids as modulators of cancer cell death:potential therapeutic targets[J].Biochim Biophys Acta,2006,1758(12):2104-2120.
[7]Perrotta C,Cervia D,De Palma C,Assi E,Pellegrino P,Bassi MT,et al.The emerging role of acid sphingomyelinase in autophagy[J].Apoptosis,2015,20(5):635-644.
[8]Fowler S.Lysosomal localization of sphingomyelinase in rat liver[J].Biochim Biophys Acta,1969,191(2):481-484.
[9]Jiang W,Ogretmen B.Autophagy paradox and ceramide[J].Biochim Biophys Acta,2014,1841 (5):783-792.
[10]Becker KA,Henry B,Ziobro R,Tümmler B,Gulbins E,Grassmé H.Role of CD95 in pulmonary inflammation and infection in cystic fibrosis [J].J Mol Med,2012,90(9):1011-1023.
[11]Becker KA,Grassmé H,Zhang Y,Gulbins E. Ceramide in Pseudomonas aeruginosa infections and cystic fibrosis[J].Cell Physiol Biochem,2010,26(1):57-66.
[12]Dechecchi MC, Nicolis E,Mazzi P,Cioffi F,Bezzerri V,Lampronti I,et al.Modulators of sphingolipid metabolism reduce lung inflammation[J]. Am J Respir Cell Mol Biol,2011,45(4):825-833.
[13]Pizzirani D,Pagliuca C,Realini N,Branduardi D,Bottegoni G,Mor M,et al.Discovery of a new class of highly potent inhibitors of acid ceramidase:synthesis and structure-activity relationship(SAR)[J].J Med Chem,2013,56(9):3518-3530.
[14]Mo ZJ,Li HB.Role of ceramide in insulin resistance and intervention:research progress[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(1):116-123.
[15]Alves MQ,Le Trionnaire E,Ribeiro I,Carpentier S,Harzer K,Levade T,et al.Molecular basis of acid ceramidase deficiency in a neonatal form of Farber disease:identification of the first large deletion in ASAH1 gene[J].Mol Genet Metab,2013,109(3):276-281.
[16]Hanker LC,Karn T,Holtrich U,Gätje R,Rody A,Heinrich T,et al.Acid ceramidase(AC)-a key enzyme of sphingolipid metabolism-correlates with better prognosis in epithelial ovarian cancer[J]. Int J Gynecol Pathol,2013,32(3):249-257.
[17]He X, Okino N,Dhami R,Dagan A,Gatt S,Schulze H,et al.Purification and characterization of recombinant,human acid ceramidase.catalytic reactions and interactions with acid sphingomyelinase[J].J Biol Chem,2003,278(35):32978-32986.
[18]Simonaro CM,Sachot S,Ge Y,He X,Deangelis VA,Eliyahu E,et al.Acid ceramidase maintains the chondrogenic phenotype of expanded primary chondrocytes and improves the chondrogenic differentiation of bone marrow-derived mesenchymal stem cells[J].PLoS One,2013,8(4):e62715.
[19]Wang LS,Wang H.Targeting sphingosine kinase pathway:an emerging treatment strategy for hematopoietic malignancy[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(1):1-6.
[20] Takeshita H, Kitano M,Iwasaki T,Kitano S,Tsunemi S,Sato C,et al.Sphingosine 1-phosphate (S1P)/S1P receptor 1 signaling regulates receptor activator of NF-κB ligand(RANKL)expression in rheumatoid arthritis[J].Biochem Biophys Res Commun,2012,419(2):154-159.
[21]Takuwa Y, Ikeda H,Okamoto Y,Takuwa N,Yoshioka K.Sphingosine-1-phosphate as a mediator involved in development of fibrotic diseases[J]. Biochim Biophys Acta,2013,1831(1):185-192.
[22]Dhami R,He X,Schuchman EH.Acid sphingomyelinase deficiency attenuates bleomycin-induced lung inflammation and fibrosis in mice[J].Cell Physiol Biochem,2010,26(4-5):749-760.
[23]Kono Y,Nishiuma T,Nishimura Y,Kotani Y,Okada T,Nakamura S,et al.Sphingosine kinase 1 regulates differentiation of human and mouse lung fibroblasts mediated by TGF-beta1[J].Am J Respir Cell Mol Biol,2007,37(4):395-404.
[24]Tager AM,Lacamera P,Shea BS,Campanella GS,Selman M,Zhao Z,et al.The lysophosphatidic acid receptor LPA1 links pulmonary fibrosis to lung injurybymediatingfibroblastrecruitmentand vascular leak[J].Nat Med,2008,14(1):45-54.
[25]He X,Schuchman E H.Potential role of acid sphingomyelinase in environmental health[J].J Cent South Univ(Med Sci)〔中南大学学报(医学版)〕,2012,37(2):109-125.
[26]Reznikov LR,Dong Q,Chen JH,Moninger TO,Park JM,Zhang Y,et al.CFTR-deficient pigs display peripheral nervous system defects at birth [J].Proc Natl Acad Sci USA,2013,110(8):3083-3088.
[27]Becker KA,Tümmler B,Gulbins E,Grassmé H. Accumulation of ceramide in the trachea and intestine of cystic fibrosis mice causes inflammation and cell death[J].Biochem Biophys Res Commun,2010,403(3-4):368-374.
[28]Becker KA.Riethmüller J,Lüth A,Döring G,Kleuser B,Gulbins E.Acid sphingomyelinase inhibitors normalize pulmonary ceramide and inflammation in cystic fibrosis[J].Am J Respir Cell Mol Biol,2010,42 (6):716-724.
[29] Becker KA,Riethmüller J,Zhang Y,Gulbins E. The role of sphingolipids and ceramide in pulmonary inflammation in cystic fibrosis[J].Open Respir Med J,2010,4(4):39-47.
[30] Seitz AP,Grassmé H,Edwards MJ,Pewzner-Jung Y,Gulbins E.Ceramide and sphingosine in pulmonary infections[J].Biol Chem,2015,396 (6-7):611-620.
[31]Teichgräber V,Ulrich M,Endlich N,Riethmüller J,WilkerB,De Oliveira-Munding CC,et al.Ceramide accumulation mediates inflammation,cell death and infection susceptibility in cystic fibrosis[J].Nat Med,2008,14(4):382-391.
[32]He C,Ryan AJ,Murthy S,Carter AB.Accelerated development of pulmonary fibrosis via Cu,Znsuperoxide dismutase-induced alternative activation of macrophages[J].J Biol Chem,2013,288 (28):20745-20757.
[33]Huang X.Iron,oxidative stress,and cell signaling in the pathogeneses of coal workers′pneumoconiosis,silicosis,and asbestosis[J].J Biomed Sci,2011,3(2):95-106.
[34]JenkinsRW,CanalsD,Idkowiak-BaldysJ,Simbari F,Roddy P,Perry DM,et al.Regulated secretion of acid sphingomyelinase:implications for selectivity of ceramide formation[J].J Biol Chem,2010,285(46):35706-35718.
[35]Li X,Han WQ,Boini KM,Xia M,Zhang Y,Li PL. TRAIL death receptor 4 signaling via lysosome fusion and membrane raft clustering in coronary arterial endothelial cells:evidence from ASM knockout mice[J].J Mol Med,2013,91(1):25-36.
[36]Uhlig S,Yang Y.Sphingolipids in acutelung injury[J].Handb Exp Pharmacol,2013,2(216):227-246.
[37]Jin F,Jiang SW,Zeng M,He X,Schuchman EH,Wang A,et al.Role of acid sphingomyelinase in silica-induced pulmonary fibrosis modelin vitro [J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2014,28(2):205-209.
[38] Fenger M,Linneberg A,Jeppesen J.Networkbased analysis of the sphingolipid metabolism in hypertension[J].Front Genet,2015,6(84):84.
[39]Thibodeau MS,Giardina C,Knecht DA,Helble J,Hubbard AK.Silica-induced apoptosis in mouse alveolar macrophages is initiated by lysosomal enzyme activity[J].Toxicol Sci,2004,80(1):34-48.
[40]Charruyer A,Grazide S,Bezombes C,Müller S,Laurent G,Jaffrézou JP.UV-C light induces raftassociated acid sphingomyelinase and JNK activation and translocation independently on a nuclear signal[J].J Biol Chem,2005,280(19):19196-19204.
[41]Bai Q.The research on effects and relationship of TGF-β1/Smad3 and JNK signaling pathway in apoptosis of pulmonary fibrosis rats(TGF-β1/ Smad3与JNK信号通路介导的细胞凋亡在小鼠肺纤维化中的作用及相互关系的研究)[D].Taiyuan:Shanxi Medical University(山西医科大学),2014.
[42]Peng Z.Mechenism of oxidative damage and antioxidant therapeutic advances in idiopathic pulmonary fibrosis(IPF氧化损伤发病机制和抗氧化治疗进展)[D].Taiyuan:Shanxi Medical University(山西医科大学),2012.
[43]Milara J,Navarro R,Juan G,Peiró T,Serrano A,Ramón M, et al.Sphingosine-1-phosphate is increased in patients with idiopathic pulmonary fibrosis and mediates epithelial to mesenchymal transition[J].Thorax,2012,67(2):147-156.
[44]Huang LS,Berdyshev E,Mathew B,Fu P,Gorshkova IA,He D,et al.Targeting sphingosine kinase 1 attenuates bleomycin-induced pulmonary fibrosis [J].FASEB J,2013,27(4):1749-1760.
[45]Scarpa MC,Baraldo S,Marian E,Turato G,Calabrese F,Saetta M,et al.Ceramide expression and cell homeostasis in chronic obstructive pulmonarydisease[J].Respiration,2013,85(4):342-349.
[46]Mullen TD,Hannun YA,Obeid LM.Ceramide syn thases at the centre of sphingolipid metabolism and biology[J].Biochem J,2012,441(3):789-802.
[47] Gulbins E,Palmada M,Reichel M,Lüth A,Böhmer C,Amato D,et al.Acid sphingomyelinase-ceramide system mediates effects of antidepressant drugs[J].Nat Med,2013,19(7):934-938.
Role of sphingolipids signaling in pathogenesis of pulmonary fibrosis
YI Ji-ping1,ZENG Ming1,HE Xing-xuan2
(1.Department of Health Toxicology,School of Public Health,Central South University,Changsha 410078,China;2.Department of Human Genetics and Genomic Sciences,Mount Sinai School of Medicine,New York 10029,USA)
Pulmonary fibrosis is a group of chronic lung diseases caused by various factors and characterized by chronic inflammations,lung tissue structure damage,increase of pulmonary interstitial collagen and massive deposition of extracellular matrix(ECM).Because of its complicated etiology,there is no effective treatment currently.Recent studies showed that the activation of sphingolipids signaling and pulmonary fibrosis were closely related.This paper describes the composition and function of sphingolipids signaling pathway and its effect on fibrosis in order to provide new ideas about further study of the pathogenesis of pulmonary fibrosis and methods of prevention.
pulmonary fibrosis;sphingolipids;ceramides;acid ceramidase
The project supported by Fundamental Research Funds for the Central Universities of Central South University(2015zzts284)
R994.6
A
1000-3002(-2016)02-0158-07
10.3867/j.issn.1000-3002.2016.02.011
Corresponding authors:ZENG Ming,Tel:(0731)84805461,E-mail:mingz19@Hotmail.com;HE Xing-xuan,Tel:001-212-659-6824,E-mail:xingxuan.he@gmail.com
2015-07-08接受日期:2015-12-17)
(本文编辑:贺云霞)
中南大学中央高校基本科研业务费专项资金资助(2015zzts284)
易吉平,女,硕士研究生,主要从事环境毒理学研究;曾 明,女,医学硕士,副教授,主要从事环境与工业毒理学研究;何兴轩,男,副教授,医学硕士,主要从事鞘磷脂类代谢与遗传性疾病的研究。
曾 明,E-mail:mingz19@hotmail.com,Tel:(0731)84805461;何兴轩,E-mail:xingxuan.he@gmail.com,Tel:001-212-659-6824
