吉非替尼在荷瘤裸小鼠体内的时辰药动学及其机制
2016-09-21刘长姣李明春青岛大学药学院药理学系山东青岛6601大连医科大学药学院辽宁大连116000中国人民解放军第401医院药剂科山东青岛66071
王 乐,刘长姣,李明春(1.青岛大学药学院药理学系,山东青岛 6601;.大连医科大学药学院,辽宁大连 116000;.中国人民解放军第401医院药剂科,山东青岛 66071)
吉非替尼在荷瘤裸小鼠体内的时辰药动学及其机制
王 乐1,3,刘长姣2,李明春3
(1.青岛大学药学院药理学系,山东青岛 266021;2.大连医科大学药学院,辽宁大连 116000;3.中国人民解放军第401医院药剂科,山东青岛 266071)
目的 探讨吉非替尼在荷瘤裸小鼠体内的时辰药动学特点及可能的机制。方法 将雌性裸鼠于12 h明暗周期中适应性饲养2周后,于右腋皮下接种HCC827细胞,制备荷瘤裸鼠模型。2周后将造模成功的裸鼠随机分为2组,分别在8:00或20:00 ig给予吉非替尼1 mg·kg-1,给药后选取10个时间点取血,检测血药浓度,应用WinNonlin 6.3计算药动学参数。将造模后未给药的裸鼠于8:00,12:00,16:00,20:00,24:00及次日4:00处死取肝组织,用实时荧光定量PCR技术检测细胞色素P-4503a11(Cyp3a11)与Cyp3a13基因的mRNA水平,以及调控其诱导表达的核受体孕烷X受体(PXR)和组成型雄甾烷受体(CAR)mRNA水平。结果 荷瘤裸鼠8:00给药组的药时曲线下面积(AUC)和平均滞留时间(MRT)均高于20:00给药组(P<0.05);8:00给药组的清除率(Clz/F)低于20:00给药组(P<0.05)。荷瘤裸鼠Cyp3a11与Cyp3a13 mRNA水平在20:00表达最高;PXR与CAR mRNA水平的变化与Cyp3a11和Cyp3a13 mRNA基本一致。结论吉非替尼在荷瘤裸鼠体内的药动学过程具有一定的昼夜节律,可能与CYP3A及调控基因的时辰性表达有关。
吉非替尼;时辰药动学;昼夜节律;核受体;细胞色素P-450酶;基因转录
昼夜节律是生命活动以24 h为周期的波动,并依赖于生物钟基因节律性的表达及对下游信号分子的活化,是时辰药理学研究中不可或缺的一部分[1]。时辰治疗是运用时辰生物学与时辰药理学的原理和方法治疗或预防疾病,以获得最佳疗效并减少不良反应,其在肿瘤与心血管等疾病治疗研究中得到证实[2]。
吉非替尼(gefitinib)是一种以表皮生长因子受体(epidermal growth factor receptor,EGFR)为靶点的小分子靶向抗肿瘤药物,适用于治疗EGFR突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)。有研究发现,荷瘤裸小鼠在不同时辰点给予厄洛替尼后,该药的抗肿瘤作用具有昼夜节律性,表现为8:00组的抗肿瘤效果优于20:00组,其差异有统计学意义[3],但是对于吉非替尼时辰药动学的研究报道甚少。细胞色素P-450酶3A4 (cytochrome P450 enzyme 3A4,CYP3A4)是人体肝和小肠中最丰富的CYP450同工酶,负责大约50%药物的代谢[4]。吉非替尼在人体内的主要代谢酶为CYP3A4。在裸小鼠体内,Cyp3a11和Cyp3a13与 Cyp3a4具有很高的同源性[5-6]。Cyp3a11和Cyp3a13基因的表达受孕烷X受体(pregnane X receptor,PXR)通路的调控。因组成型雄甾烷受体(constitutive androstane receptor,CAR)和PXR配体结合域有50%的同源性,CAR核受体通路同样影响Cyp3a11和Cyp3a13基因的表达[7-8]。因此,本研究通过建立NSCLC模型,于各时间点给予吉非替尼1 mg·kg-1,采用高效液相色谱-串联质谱联用法(high-performance liquid chromatography coupled with tandem mass spectrometry,HPLC-MS/MS)测定血药浓度,用实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)技术检测Cyp3a11和Cyp3a13基因及调控其诱导表达的核受体基因PXR和CAR mRNA表达水平,揭示吉非替尼时辰给药的药动学特点及可能的机制,以期为临床合理用药提供参考。
1 材料与方法
1.1实验动物
BALB/c裸小鼠,SPF级,雌性,4周龄(28~34 d),体质量10~13 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001;将裸小鼠置于22~26℃、湿度40%~60%和严格控制光照(12 h明期7:00~19:00,12 h暗期19:00~7:00)的环境中,自由摄食与饮水,适应性饲养2周后用于实验。
1.2药品和试剂
吉非替尼标准品(纯度98%)和索拉非尼标准品(纯度98%),加拿大TRC公司;吉非替尼片(批号:国药准字J20100014,规格:0.25 g),阿斯利康制药有限公司;甲醇和乙腈(色谱纯),天津市四友精细化学品有限公司;乙酸铵和氢氧化钠(分析纯),天津市瑞金特化学品有限公司;异丙醇、三氯甲烷、乙酸乙酯和无水乙醇(分析纯),天津市富宇精细化工有限公司;吐温80(分析纯),美国索莱宝公司;实验用蒸馏水,中国人民解放军第401医院自制。DEPC水、无RNA酶水、RNAiso Plus、cDNA提取试剂盒和SYBR®Premix Ex TaqTMⅡ均购自TaKaRa公司。
1.3仪器
Alliance 2695高效液相色谱仪和Quattro microTMAPI三重四级杆质谱仪,美国Waters公司;色谱柱,Waters XTerraR MS C18(2.1 mm×150 mm,5 μm);TGL16离心机,长沙英泰仪器有限公司;BT125D电子天平,Sartorius公司;DC-24氮吹仪,上海安谱科学仪器有限公司;MS2迷你型旋涡混合仪,德国IKA公司;DRD431A微型离心机,湖南湘仪实验仪器开发有限公司;DCD-215DK冷藏冷冻箱,青岛海尔股份有限公司;-86℃低温冷冻箱,青岛澳柯玛股份有限公司;TL988型qRT-PCR仪,西安天隆科技有限公司。
1.4血浆样品中吉非替尼HPLC-MS/MS检测方法的建立和验证
1.4.1溶液的制备
精密称取吉非替尼标准品23.51 mg,用甲醇定容至25 mL,得到浓度为0.9404 g·L-1的储备液;精密称取索拉非尼标准品0.67 mg,用甲醇定容至10 mL,得到浓度为0.0670 g·L-1的内标储备液。储备液均于-20℃保存备用。使用前将吉非替尼储备液用50%甲醇溶液稀释成系列标准溶液,将内标储备液用50%甲醇溶液稀释成0.0350 g·L-1的内标溶液。
吉非替尼片,去包衣,研磨成粉,用1%吐温80溶液定容至60 mL(含吉非替尼0.1 g·L-1),于4℃保存,用前摇匀。
1.4.2色谱条件和质谱条件
本实验条件在以往文献报道的基础上[9]加以改进。流动相组成:乙腈∶乙酸铵20 mmol·L-1=65∶35 (V∶V);流速0.2 mL·min-1;运行时间8 min;柱温30℃;进样量10 μL。
大气压化学电喷雾源(ESI),离子源温度为110℃,去溶剂气温度为150℃,去溶剂气流量为550 L·h-1,毛细管电压为3 V,二级锥孔萃取电压为2 V,射频透镜电压为0.2 V,离子能量1和2均设置为0.5 eV。碰撞气为氩气,流速为2.9 mL·min-1。采用多反应离子监测方式在正离子模式下检测,吉非替尼离子对为447 99.7,内标索拉非尼为465 270。吉非替尼的碰撞诱导裂解电压为50 V,索拉非尼为24 V。吉非替尼锥孔电压为25 V,索拉非尼为40 V。
1.4.3血浆样品处理
取正常裸小鼠血浆样品150 μL于1.5 mL EP管中,依次加入10 μL含内标(0.0350 g·L-1)的甲醇溶液和50 μL氢氧化钠溶液(0.1 mol·L-1),涡旋混合30 s,加入1 mL乙酸乙酯溶液,涡旋5 min,离心(15 000×g,4℃)10 min。取上清液1 mL,于45℃N2吹干,150 μL流动相复溶,涡旋混合3.5 min,0.22 μm微孔滤膜过滤后直接进样。
1.4.4方法学验证
从方法的专属性、线性、精密度、准确度、回收率、基质效应和稳定性等方面进行系统的方法学验证。
1.5非小细胞肺癌模型的制备、分组和给药
HCC827细胞(EGFR突变型),购于中国科学院细胞库,接种细胞密度为1.0×107L-1,于裸小鼠右腋皮下接种0.2 mL。接种5 d后,肉眼可见裸小鼠右上肢腋下有肿瘤形成(体积为20~35 mm3),即为造模成功。
在预实验中,分别于6个时辰点(4:00,8:00,12:00,16:00,20:00和24:00)ig给予NSCLC模型裸小鼠1.0 mg·kg-1吉非替尼,给药第21天处死裸小鼠,取肿瘤组织,称重,计算抑瘤率。结果显示,8:00组抑瘤率最高,20:00组抑瘤率最低[10]。因此,本研究选取了8:00和20:00组进行血药浓度的检测。接种肿瘤2周后,将造模成功的裸小鼠(体质量17~23 g)随机分为2组,每组40只,分别于8:00 或20:00 ig给予吉非替尼混悬液(0.1 g·L-1)0.2 mL,给药剂量为1 mg·kg-1,并于0 h(未给药)及给药后15和30 min,1,3,5,7,9,16和24 h摘眼球取血,置于含肝素抗凝剂的EP管中,离心(3500×g,4℃)10 min,分离上层血浆,于-86℃保存,用于吉非替尼的药动学检测。
将18只造模后未给药的BALB/c裸小鼠随机分为6组,每组3只,分别于8:00,12:00,16:00,20:00,24:00及次日4:00颈部脱臼处死取肝组织,于液氮中迅速冷冻后置于-86℃冰箱中保存,用于Cyp3a11,Cyp3a13,PXR和CAR mRNA水平的检测。另外,每个时辰点组加3只正常裸小鼠作为对照组。
1.6qRT-PCR检测裸小鼠Cyp3a11和Cyp3a13及调控其诱导表达的核受体基因PXR和CAR的mRNA水平
1.6.1总RNA提取
称取100 mg肝组织置于研钵中,不断加入液氮使其研磨均匀。加入1 mL RNAiso Plus,冰上手动匀浆5 min后,转移至无RNA酶的EP管中,并用氯仿及异丙醇提取总RNA。取RNA样品5 μL,按照PrimeScript RT-PCR试剂盒要求配置10 μL反应体系,对提取的RNA进行纯化。采用紫外分光光度法对提取纯化的RNA进行浓度和纯度分析。此操作在冰上进行。
1.6.2cDNA合成
取纯化的RNA反应液10 μL,按照逆转录试剂盒(Primscript RT-PCR)的要求配置20 μL反应体系,在37℃15 min,85℃5 s的反应条件下,将RNA逆转录成cDNA。
1.6.3PCR扩增
利用特异性引物(表1),取制备的cDNA反应液2 μL作为反应模板,按照SYBR®Premix Ex TaqTMⅡ试剂盒说明书配置25 μL反应体系,进行qRT-PCR扩增反应。用溶解度曲线表示qRT-PCR基因扩增的特异性。采用TL988 qRT-PTR仪测定Ct值,以GAPDH基因作为内参,对目的基因的表达水平作均一化处理。目的基因相对表达水平用2- Ct表示。
1.7统计学分析
采用WinNonlin 6.3药动学程序对所测数据进行c-t曲线拟合,以非房室模型(统计矩法)计算主要药动学参数:药物峰浓度(cmax)、达峰时间(tmax)、清除速率(Clz/F)、从给药开始到给药24 h的药时曲线下面积(AUC0-24 h)、从给药开始到给药t=∞的药时曲线下面积(AUC0-∞)、从给药开始到给药24 h的平均驻留时间(MRT0-24 h)及从给药开始到给药t=∞的平均驻留时间(MRT0-∞)。
2 结果
2.1专属性
将空白血浆、(空白血浆+吉非替尼+内标)以及ig给予吉非替尼3 h后的血浆样品按1.4.3进行血浆样品预处理,按1.4.2色谱与质谱条件进样分析。结果显示,吉非替尼和内标索拉非尼的出峰时间分别为2.7和4.1 min,血浆中内源性物质对检测无干扰(图1)。
2.2线性关系
取空白血浆135 μL,准确加入15 μL吉非替尼系列标准溶液,使其终浓度分别为0.1,0.5,2.0,10.0,50.0,100.0和200.0 μg·L-1,按1.4.3方法进行样品处理,按1.4.2色谱与质谱条件进样分析。将测得的吉非替尼与内标峰面积之比(Y)对吉非替尼浓度(X)进行线性回归计算(加权系数1·X-2),回归方程为Y=0.0112X+0.0147(r=0.9969)。血浆中吉非替尼浓度在0.1~200.0 μg·L-1范围内与峰面积线性关系良好,其定量限为0.09 μg·L-1(S/N=10)。

Tab.1 PCR primers used for mRNA analysis of target genes
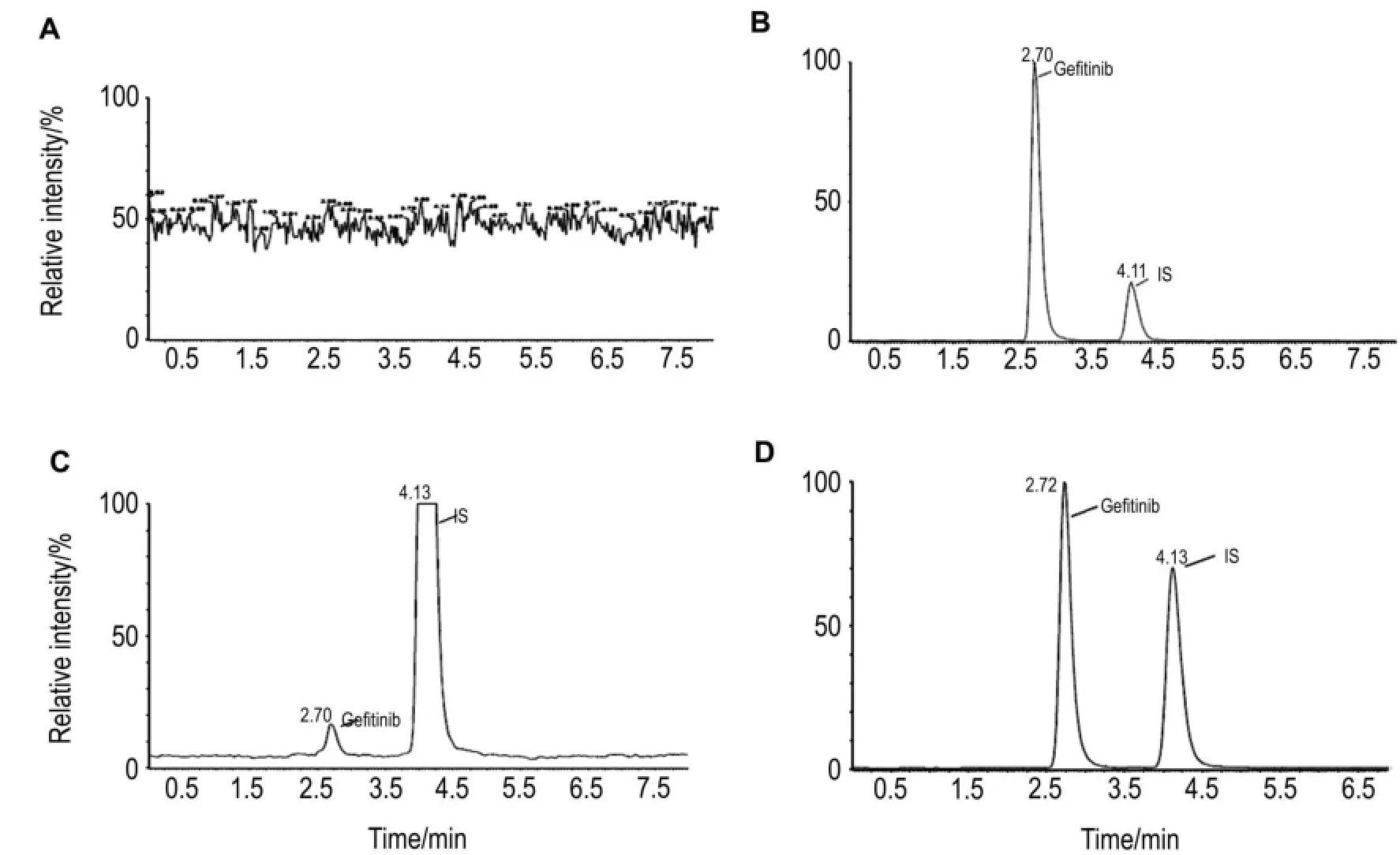
Fig.1 Multiple reaction monitoring chromatograms for gefitinib and sorafenib(internal standard,IS).A:blank nude mouse plasma;B:blank nude mouse plasma containing gefitinib 200 μg·L-1and IS 2.33 mg·L-1;C:quantification limit of gefitinib was 0.09 μg·L-1and the concentration of IS was 2.33 mg·L-1;D:plasma sample(3 h after ig administration of gefitinib at the dose of 1 mg·kg-1at 12:00,the concentration of gefitinib and IS was 75.40 μg·L-1and 2.33 mg·L-1,respectively).
2.3精密度和准确度
用空白血浆配置含吉非替尼0.2,10.0和200.0 μg·L-1的质控样品各6份,于同日内按1.4.3 及1.4.2方法进行样品处理后进样,计算日内精密度和准确度。将以上3种浓度的质控样品各测定1次,连续测定3 d,根据随行标准曲线计算日间精密度和准确度(表2)。精密度以相对标准偏差(relative standard deviation,RSD)表示,准确度以相对误差(relative error,RE)表示。

Tab.2 Accuracy and precision of gefitinib in nude mouse plasma
2.4回收率和基质效应
用空白血浆配置含吉非替尼0.2,10.0和200.0 μg·L-1的质控样品各6份,按1.4.3及1.4.2方法进行样品处理后进样,求得吉非替尼与内标峰面积之比,并计算相同浓度吉非替尼对照品溶液按相同方法处理进样的峰面积与内标峰面积比的比值,得到提取回收率;将质控样品中吉非替尼与内标峰面积比值代入随行标准曲线所得的回归方程,求得吉非替尼的测定浓度,以测定浓度/理论浓度× 100%即得相对回收率(表3)。
配置吉非替尼0.2,10.0和200.0 μg·L-1的标准溶液15 uL,45℃N2吹干,150 μL流动相复溶进样,得到吉非替尼的峰面积(As);精密吸取135 μL空白血浆,依次加入50%甲醇溶液25 μL和NaOH溶液(0.1 mol·L-1)50 μL,涡旋混合,加入1 mL乙酸乙酯,涡旋5 min,离心(15 000×g,4℃)10 min。取上清液,分别加入浓度为0.2,10.0和200.0 μg·L-1的吉非替尼标准溶液15 μL,涡旋混合后45℃N2吹干,流动相150 μL复溶进样,得到吉非替尼的峰面积(Ax);基质效应=Ax/As。内标索拉非尼溶液(0.0350 g·L-1)同样进行考察。吉非替尼0.2,10.0 和200.0 μg·L-1的基质效应分别为94.5%,99.6%和91.1%;内标的基质效应分别为93.2%,96.4%和92.0%。以上结果表明,基质效应不影响吉非替尼的准确测定。

Tab.3 Recovery of gefitinib in nude mouse plasma
2.5稳定性
本实验考察了吉非替尼质控样品在室温(20℃)放置24 h、-86℃到室温反复冻融3次、-86℃低温储存1个月以及处理后的样品在自动进样器(4℃)中放置24 h的稳定性。结果表明,吉非替尼在上述条件下均保持稳定(表4)。
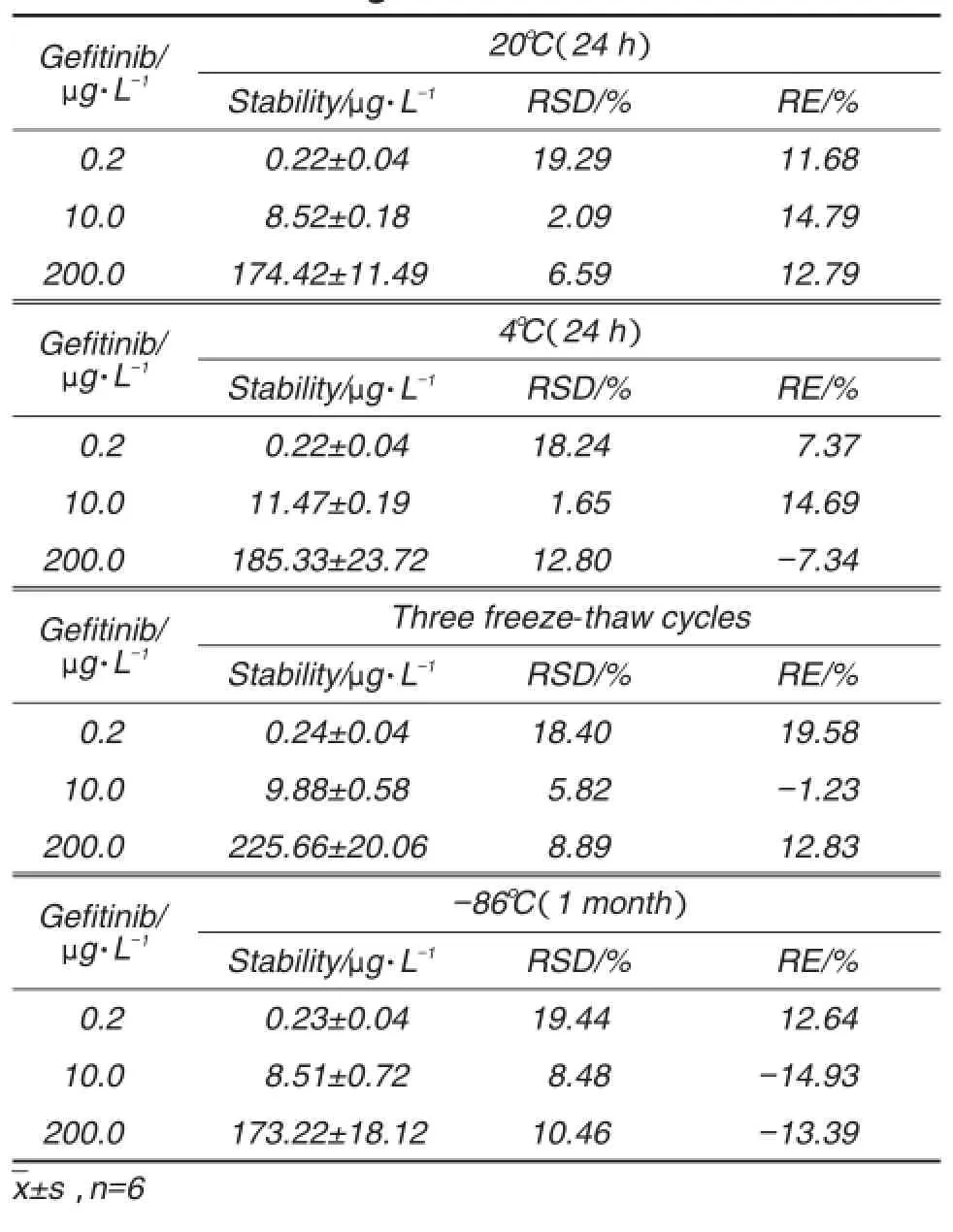
Tab.4 Stability of gefitinib in nude mouse plasma under different storage conditions
2.6吉非替尼ig给药后的药时曲线和药动学参数
8:00和20:00给药组药时曲线及药动学参数分别见图2和表5。由表5可见,8:00组的AUC和MRT0-24 h均高于20:00组(P<0.01)。8:00组的Clz/F低于20:00组(P<0.01),表明相对于20:00组,8:00组给药后吉非替尼在裸小鼠体内清除缓慢,驻留时间长。

Fig.2 Plasma concentration- time profile of gefitinib after administration at two different time points in nude mice of non- small cell lung cancer(NSCLC) model. x±s,n=40.

Tab.5 Plasma pharmacokinetic parameters of each group after gefitinib administration in NSCLC nude mouse
2.7Cyp3a11,Cyp3a13,PXR和CAR mRNA在裸小鼠肝组织中表达水平的昼夜节律性
从对Cyp3a11,Cyp3a13,PXR以及CAR的mRNA基因表达检测(图3)可以看出,Cyp3a11,Cyp3a13,PXR以及CAR均在明期的早期和暗期的晚期表达较低,在明期的晚期和暗期的早期表达较高,各基因均在20:00表达最高。
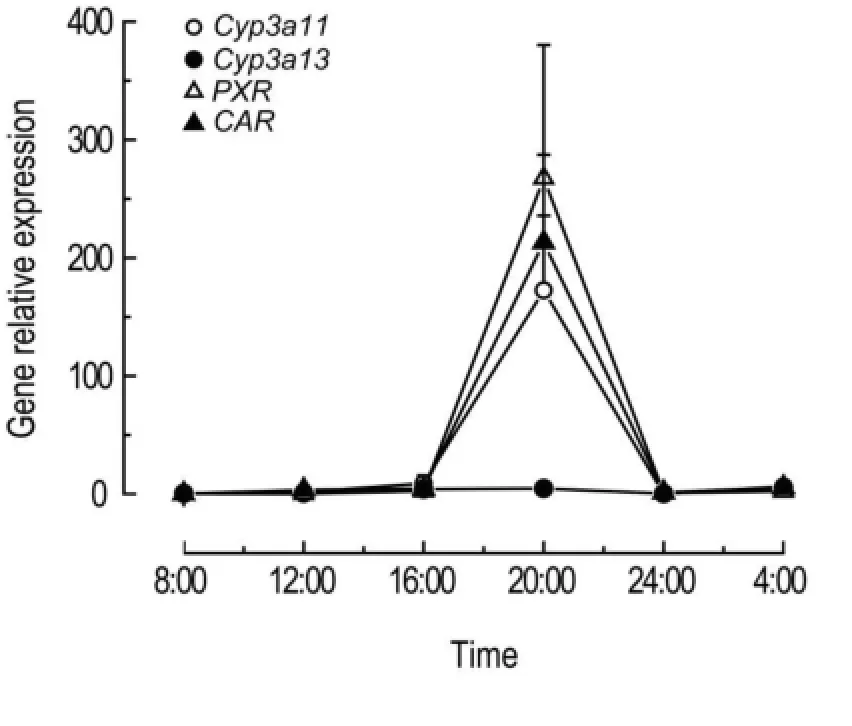
Fig.3 Variation tendency of relative expression levels of PXR,CAR,Cyp3a11 and Cyp3a13 mRNA in nude mice of NSCLC model by real- time quantitative PCR during 24 h. The livers were taken from mice at different circadian times. The mRNA expression of Cyp3a11,Cyp3a13,PXR and CAR was detected by qRT-PCR. x±s,n=3.
3 讨论
本研究中,裸小鼠体内吉非替尼的药动学特点表现为8:00组AUC和MRT高于20:00组,8:00组的Cl低于20:00组,表明8:00给药后吉非替尼在裸小鼠体内清除缓慢,驻留时间延长。裸小鼠体内的CYP3A代谢酶及其调控基因在明期的早期和暗期的晚期表达较低,明期的晚期和暗期的早期表达较高,与药动学特点相吻合。
在吉非替尼和厄洛替尼的时辰药效学研究中,8:00组的抑瘤率均明显高于20:00组[3,10]。其药效学的时辰节律性可能与磷酸化的EGFR的昼夜节律性表达有关,也可能与EGFR下游相关的信号通路有关。此药效学研究与本研究均表明,在明期的早期或暗期的晚期给予厄洛替尼或吉非替尼效果较好。
PXR和CAR调控CYP3A的节律性表达可能导致吉非替尼体内药动学变化的昼夜节律性。另外,药物在体内的吸收、分布和排泄的每一过程都可能存在昼夜节律变化。
生物昼夜节律的基本分子机制是时辰基因及其蛋白产物构成的自主调节的转录-翻译反馈回路。在此机制中,生物钟循环输出蛋白(circadian locomotor output cycles kaput,Clock)与生物钟基因Bmal1(brain and muscle Arnt-like protein-1)形成Clock/Bmal 1异二聚体,通过与隐花色素(cryptochrome,Cry)基因、周期蛋白(period,Per)基因和孤儿核受体(nuclear recaptor Re-Erbalpha, Re-Erbα)基因启动子部位的e盒结合,激活这些基因的转录,从而形成Per及Cry蛋白反馈抑制基因的继续转录[11-12]。研究发现,CAR基因与时辰基因Bmal 1的表达趋势相同,与Re-Erbα基因的表达趋势相反[13]。CYP3A代谢酶表达的昼夜节律性可能与时辰基因Bmal 1的时辰性表达有关。代谢酶与时辰基因之间的关系有待于进一步研究。
本研究表明,吉非替尼在荷瘤裸小鼠体内的药动学过程具有昼夜节律性,此节律性可能与代谢酶,PXR和CAR核受体通路及时辰基因的时辰性表达有关。该研究有助于进行吉非替尼时辰药理学的临床研究,为临床合理用药提供理论参考。
[1] Li R,Cheng S,Wang Z.Circadian clock gene plays a key role on ovarian cycle and spontaneous abortion[J].Cell Physiol Biochem,2015,37(3):911-920.
[2]Takane H,Ohdo S,Yamada T,Yukawa E,Higuchi S. Chronopharmacology of antitumor effect induced by interferon-β in tumor-bearing mice[J].J Pharmacol Exp Ther,2000,294(2):746-752.
[3]Lin P,An F,Xu X,Zhao L,Liu L,Liu N,et al. Chronopharmacodynamicsandmechanismsof antitumor effect induced by erlotinib in xenographtbearing nude mice[J].Biochem Biophys Res Commun,2015,460(2):362-367.
[4]Patoine D,Petit M,Pilote S,Picard F,Drolet B,Simard C.Modulation of CYP3a expression and activity in mice models of type 1 and type 2 diabetes [J].Pharmacol Res Persp,2014,2(6):e00082.
[5]Aueviriyavit S,Kobayashi K, Chiba K.Species differences in mechanism-based inactivationof CYP3A in humans,rats and mice[J].Drug Metab Pharmacokinet,2010,25(1):93-100.
[6]Komura H,Iwaki M.In vitro and in vivo small intestinal metabolism of CYP3A and UGT substrates in preclinical animals species and humans:species differences[J].Drug Metab Rev,2011,43(4):476-498.
[7]Jin T,Zhang D,Xu YQ,Xu SF,Liu J,Lu YF. Circadian rhythm variation of cytochrome CYP1A gene expression in liver of Kunming mice[J]. Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(3):406-410.
[8]Huang L,Kuang SY,Zhang L.Effects of evodiamine and rutecarpine on human CYP3A4 throughPXR and CAR pathway[J].China Pharmacy(中国药房),2013,24(35):3274-3279.
[9]Masters AR,Sweeney CJ,Jones DR.The quantification of erlotinib(OSI-774)and OSI-420 in human plasmaby liquid chromatography-tandem mass spectrometry[J].J Chromatogr B,2007,848(2):379-383.
[10]Liu L,Li MC,Lin PP,Liu N,Wang L.Study on the pharmacodynamics of gefitinib in tumor-bearing nude mice according to time[J].China Pharmacy(中国药房),2015,26(16):2205-2208.
[11]Shimomura K, Kumar V,Koike N,Kim TK,Chong J,Buhr ED,et al.Usf1,a suppressor of the circadian Clock mutant,reveals the nature of the DNA-binding of the CLOCK:BMAL1 complex in mice[J].Elife,2013,2:e00426.
[12]Eckel-Mahan K,Sassone-Corsi P.Metabolism and the circadian clock converge[J].Physiol Rev,2013,93(1):107-135.
[13]Kanno Y,Otsuka S,Hiromasa T,Hiromasa T,Nakahama T,Inouye,Y.Diurnal difference in CAR mRNA expression[J].Nucl recept,2004,2(1):6.
Chronopharmacokinetics of gefitinib and its mechanisms in tumor-bearing nude mice
WANG Le1,3,LIU Chang-jiao2,LI Ming-chun3
(1.Department of Pharmacology,College of Pharmacy,Qingdao University,Qingdao 266021,China;2.College of Pharmacy,Dalian Medical University,Dalian 116000,China;3.Department of Pharmacology,The 401st Hospital of PLA,Qingdao 266071,China)
OBJECTIVE To investigate the effect of the dosing time on the pharmacokinetics of gefitinib and its potential mechanism.METHODS Female BALB/c nude mice were housed under standardized 12 h light/dark circadian conditions(light on at 7:00,off at 19:00)for two weeks before a non-small cell lung cancer(NSCLC)model was established.Two weeks later,they were divided into 2 groups(8:00,20:00)randomly.Gefitinib was orally administered at the dose of 1 mg·kg-1to the mice in each group at 8:00 or 20:00,respectively.Blood was collected at 10 different time points after each administration.Livers were collected every 4 h during the 24 h period from the non-administrated nude mice of NSCLC model.The plasma concentration of gefitinib was determined through an HPLC-MS/MS and the parameters were calculated by WinNonlin 6.3.The total RNA was extracted from livers,purified,synthesized to cDNA that was subjected to qRT-PCR analysis for mRNA expression levels of cytochrome P450 enzymes(Cyp)3a11,Cyp3a13,pregnane X receptor(PXR)and constitutive androstane receptor(CAR).RESULTS The area under the plasma concentration-time curve(AUC)and mean residence time(MRT)of 8:00 administration group were higher than those of 20:00 administration group(P<0.05).The clearance(Clz/F)of 8:00 administration group was lower than that of 20:00 administration group(P<0.05).The mRNA expression levels of PXR and CAR were consistent with those of Cyp3a11 and Cyp3a13.CONCLUSIONCircadian rhythm exists in the pharmacokinetics of gefitinib and it may be closely related to CYP3A and its regulator genes.
gefitinib;chronopharmacokinetics;circadian rhythm;nuclear receptors;cytochrome P450 enzymes;gene transcription
LI Ming-chun,Tel:(0532)51870086,E-mail:lmc401y@163.com
R969.1
A
1000-3002(2016)02-0144-07
10.3867/j.issn.1000-3002.2016.02.009
2015-10-23接受日期:2015-12-29)
(本文编辑:沈海南)
王 乐,女,硕士研究生,主要从事药理学研究,E-mail:wangle1106@163.com
李明春,E-mail:lmc401y@163.com,Tel:(0532)51870086
