不同浓度EGF对兔ADSCs体外诱导分化为表皮细胞的实验研究
2016-09-21胡亚暖姚永明张泽敏杨彪炳
胡亚暖,姚永明,张泽敏,张 帆,王 君,杨彪炳
(1.潍坊医学院整形外科 山东 潍坊 261053;2.费县人民医院 山东 临沂 273400;3. 潍坊医学院整形外科研究所 山东 潍坊 261053)
不同浓度EGF对兔ADSCs体外诱导分化为表皮细胞的实验研究
胡亚暖1,姚永明1,张泽敏1,张帆2,王君1,杨彪炳3
(1.潍坊医学院整形外科山东 潍坊261053;2.费县人民医院山东 临沂273400;3. 潍坊医学院整形外科研究所山东 潍坊 261053)
目的:探究表皮生长因子(EGF)对兔脂肪来源干细胞(ADSCs)体外诱导分化为表皮细胞以及所需最佳浓度的实验研究,为组织工程在大面积皮肤缺损方面的研究提供进一步的理论依据。方法:取2个月龄健康新西兰大白兔的脂肪组织,体外分离、培养并传代ADSCs。实验分为诱导组和未诱导组,诱导组分别用5ng/ml、10ng/ml、20ng/ml的EGF进行干预,未诱导组用等量的生理盐水作空白对照。观察不同浓度的EGF对ADSCs诱导分化为表皮细胞的形态学变化,并于1周后对细胞进行免疫荧光及荧光定量PCR检测CK-19和整合素β(integrinβ)的表达情况。结果:光镜下显示诱导组细胞形态仍呈长梭形或多角形;免疫荧光结果显示诱导组(10ng/ml组)表皮细胞特异性标记物CK-19表达呈阳性,且其表达量明显高于其他组,未诱导组细胞呈阴性;荧光定量PCR结果显示诱导组(10ng/ml组)表皮细胞的特异性因子CK-19和integrinβ的mRNA表达量均明显高于其余组(P<0.01)。结论:表皮生长因子能够成功诱导兔脂肪来源干细胞定向分化为表皮细胞,且其最佳诱导浓度为10ng/ml。
脂肪来源干细胞;表皮生长因子;表皮细胞;浓度
Key worlds: adipose derived stem cells; EGF; epidermis cells; concentration
大面积皮肤缺损是外科领域中的一项重大难题。目前,自体皮肤移植是治疗皮肤组织缺损的一种有效方法。然而,自体皮肤移植供区的皮肤来源有限,对患者的创伤较大,同时刃厚皮片存在不耐摩擦、缺乏弹性及易收缩等特点,中厚皮片又有瘢痕挛缩等问题。随着组织工程技术的发展,皮肤替代物的研究取得了实质性的进展。脂肪来源干细胞(adipose-derived stem cells,ADSCs)是从脂肪组织中分离出来的多能干细胞,经诱导后,可以向骨、软骨、脂肪、肌肉、血管内皮以及表皮细胞分化[1-2],成为了继骨髓间充质干细胞[3]之后的又一研究热点。本实验旨在探讨不同浓度的表皮生长因子( epidermal growth factor,EGF)对兔ADSCs诱导分化为表皮细胞的机制,以及寻找其最佳诱导浓度,以提高细胞培养成效,为今后临床大面积皮肤组织缺损的治疗提供了一定的理论依据。
1 材料和方法
1.1实验动物及主要试剂、仪器:新西兰大白兔(2~3个月龄)(购自潍坊医学院动物中心);DMEM培养基(高糖)(美国HyClone有限公司);胎牛血清(杭州四季青生物工程材料有限公司);EGF(北京博奥森生物技术有限公司);CK-19单克隆抗体(北京博奥森生物技术有限公司);反转录试剂盒(上海生工生物工程技术服务有限公司);SYBR Green荧光定量试剂盒(TAKARA)。
SW-CJ-1F型超净工作台(中国);Heraews 二氧化碳培养箱(德国);DMIL型倒置相差显微镜(德国Leica);荧光PCR仪(澳大利亚Corbett);KA-1000型低速离心机(郑州南北仪器设备公司);多功能冷冻离心机(德国Heraeus)。
1.2ADSCs的分离、培养、传代以及鉴定:取大白兔新鲜脂肪,放置于无菌盘中,用PBS缓冲液冲洗3遍,剔除肉眼可见的小血管、包膜以及多余的组织,再次用无菌PBS冲洗3遍,剪成糊状,于室温环境中1 200r/min离心5min,用0.1%Ⅰ型胶原酶消化50min,经200目筛网过滤后,加入DMEM培养液终止消化,室温下1 200r/min离心10min,弃上清,留贴壁细胞;用低糖DMEM培养液重悬并接种至培养瓶中,在37℃、5%CO2的培养箱中孵育,24h后观察细胞贴壁情况,48h进行首次换液,以后每2d换液一次。待细胞融合到培养瓶底80%~90%时,进行细胞传代,每2d换液一次。取第3代细胞用细胞免疫荧光染色法检测ADSCs表面特异性标记物CD34、CD44、CD29及CD106。
1.3EGF诱导ADSCs后CK-19的表达:用第3代ADSCs作为实验细胞。将细胞接种于96孔板中,接种密度为1×103/孔,培养至生长阶段,分为两组:EGF诱导组和未诱导组。EGF实验组在 96 孔板加入含有不同质量浓度EGF ( 5、10、20ng/ml)的DMEM培养液,各浓度设复孔;未诱导组不加EGF,亦设复孔。每隔48h换液1次,在 37℃、5% CO2条件下培养。1周后按照免疫荧光染色试剂盒说明对表皮细胞的特异性标志物CK-19进行检测。
1.4荧光定量PCR检测诱导后CK-19和integrinβ的mRNA表达:将定向诱导分化1周后的表皮细胞在培养瓶中用TRIZOL提取总的mRNA。以总的mRNA为模板,按照试剂盒说明书进行逆转录和PCR反应。逆转录采用20µl的反应体系:总RNA 4µl、5×gDNA Eraser buffer 2µl、RNase free dH2O 3µl、gDNA Eraser1µl,混匀后42℃ 2min;继续加入5×PrimeScript Buffer2 4µl、RNase free dH2O 4µl,混匀离心加入RT Prime Mix 1µl,PrimeScript RT Enzyme MixI 1µl。反应条件:37℃15min、85℃5s。PCR采用12.5µl的反应体系:SYBR Green Mix 6.25µl、cDNA模板1µl、PCR Forward Primer 0.5µl、PCR Reverse Primer 0.5µl、RNase free dH2O 4.25µl。反应条件:94℃ 3min、94℃ 30s、60.8℃ 30s、72℃ 30s,40个循环,72℃延伸10min。检测CK-19和integrinβ mRNA的表达。采用2-ΔΔCt方法计算各组基因相对表达量。
1.5统计学方法:采用目的基因Ct值/内参Ct值进行CK-19和integrinβ mRNA的相对定量分析。相对定量值越低说明其表达量越高。采用SPSS19.0统计软件进行分析。数据以均数±标准差表示,各组间比较采用方差分析,两两比较采用 SNK检验;检验水准α=0.05。
2 结果
2.1ADSCs形态学观察及免疫荧光细胞化学染色鉴定:原代细胞最初呈圆形透亮,与脂滴共同漂浮于培养液中。6~8h开始沉降贴壁,贴壁后细胞多为短梭形、星形或小多角形。24h后贴壁细胞充分伸展,培养至第7天,细胞铺满瓶底,排列较整齐,并形成集落,彼此融合呈长梭形分布(图1)。免疫荧光细胞化学染色检测结果显示,ADSCs特异性标志物CD44、CD29呈阳性表达(图2),而造血系统相关抗原CD34、CD106则呈阴性表达,这说明分离培养的细胞为ADSCs。
2.2ADSCs经不同浓度EGF诱导为表皮细胞后的形态学观察:加入不同浓度EGF定向诱导ADSCs后细胞形态仍呈长梭形或多角形,且HE染色显示细胞形态与未诱导组形态无明显差别(图3)。

图1 倒置显微镜下观察ADSCs的细胞形态(×40)(a:原代ADSCs培养20min;b:原代ADSCs培养4d;c:原代ADSCs培养7d)

图2 第3代ADSCs免疫荧光细胞化学染色CD29(a)、CD44(b)呈阳性,CD34 (c)、CD106(d)呈阴性,×200
图3 经共培养诱导15d后,各诱导组经倒置显微镜和HE染色观察细胞形态无明显变化,细胞仍呈长梭形或多角形并且呈鱼群样聚集(3a、3b、3c:×100;3d、3e、3f:×200)
2.3ADSCs诱导培养后免疫荧光细胞化学染色:免疫荧光检测结果显示,7d后诱导组相对于未诱导组CK-19的表达量都有不同程度的增多,且10ng/ml组CK-19的表达量明显高于其他诱导组,20ng/ml组稍高于5ng/ml组。未诱导组未检测到绿色荧光(图4)。
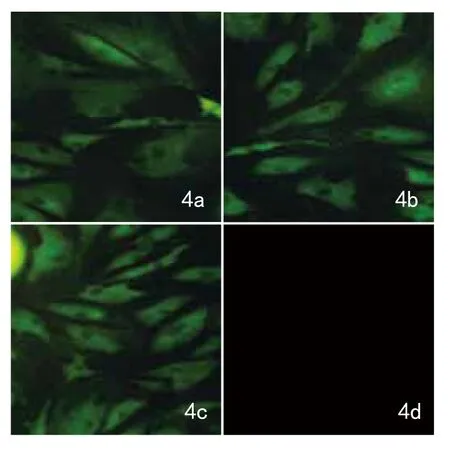
图4 ADSCs向表皮细胞分化鉴定:ADSCs成表皮诱导7d后,免疫荧光细胞化学染色,各诱导组(4a:5ng/ml,×200;4b:10ng/ml,×200;4c:20ng/ml,×200)CK-19表达呈阳性,未诱导组(4d:×200)呈阴性。而且10ng/ml组CK-19的表达明显高于其他组
2.4荧光定量PCR检测CK-19和integrinβ的mRNA表达:经荧光定量PCR扩增,定向培养诱导后10ng/ml组的CK-19和integrinβ的mRNA表达明显高于其他组(P<0.01),差异具有统计学意义。20ng/ml组略高于5ng/ml组(P>0.05),差异无统计学意义(图5)。
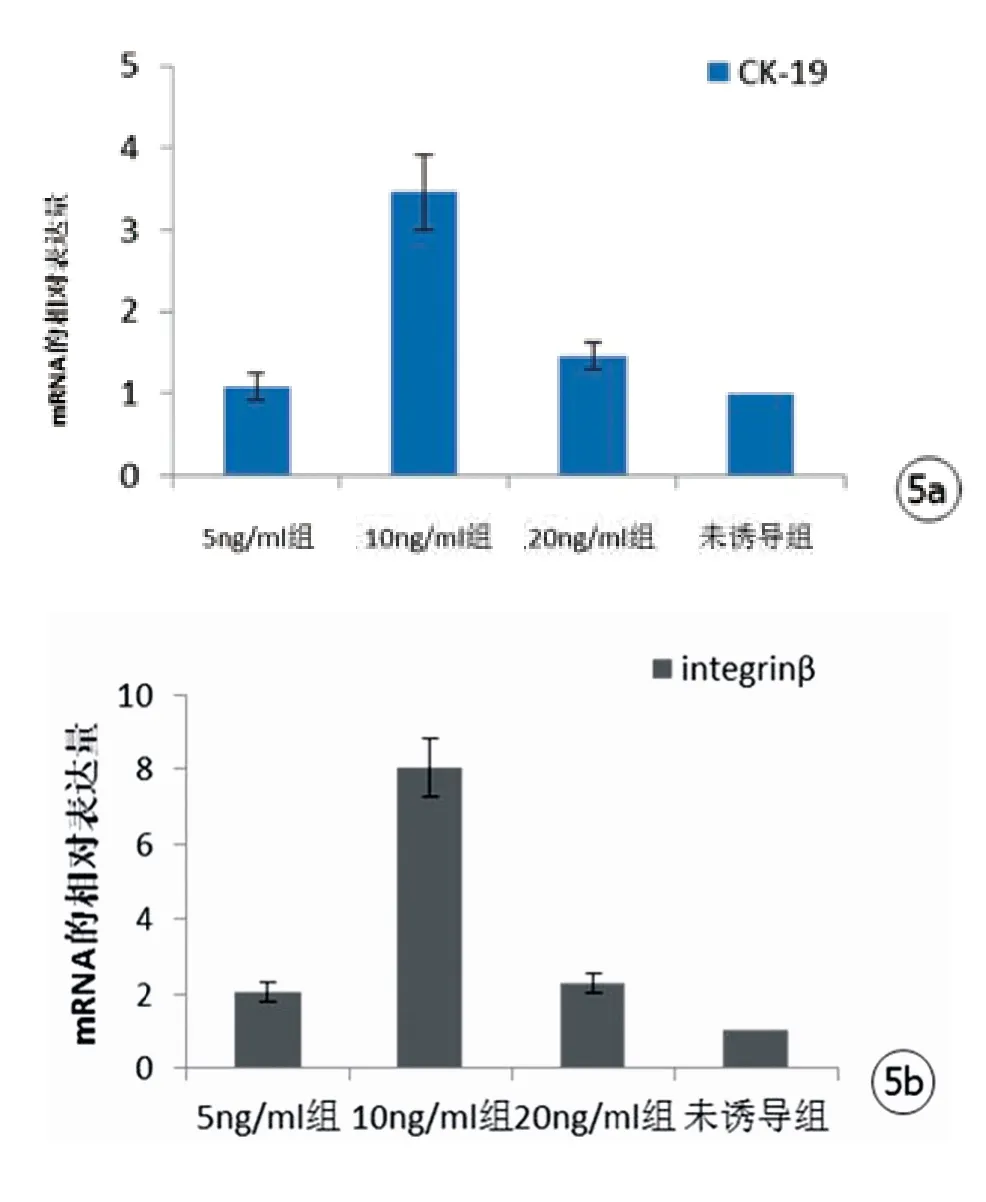
图5 ADSCs经不同浓度的EGF处理后表皮细胞的标志性因子CK-19和integrinβ的mRNA表达
3 讨论
ADSCs来源于胚胎时期中胚层,具有向中胚层组织和神经外胚层组织等分化的潜力[4]。与骨髓间充质干细胞相似,ADSCs也具有多向分化的潜能,在特定条件下可分化为脂肪细胞、成骨细胞、软骨细胞[5]、血管内皮细胞、表皮细胞[6-7],另外有大量学者报道了ADSCs亦可向星形胶质细胞[8]、神经膜细胞[9]、尿路上皮细胞[10]和膀胱平滑肌细胞[11]诱导分化。相比骨髓干细胞,
脂肪干细胞具有来源丰富、易于获得以及低免疫原性[12]等优点。因此,ADSCs逐渐成为组织工程种子细胞的更优选择。研究表明,干细胞在诱导分化为表皮细胞的过程中,EGF可能是重要的诱导因素[13],其通过参与损失后组织细胞的增殖分化而发挥作用,促进了细胞外基质的合成,也促进了真皮新生血管的生成[14-15],而且还参与诱导皮肤干细胞增殖分化,加速表皮的再生。因此,我们希望ADSCs能够成为理想的种子细胞来参与缺损创面的修复。本实验旨在研究ADSCs被诱导分化为表皮细胞的可能性以及所需EGF最佳诱导浓度,为今后在皮肤组织工程上的应用及发展提供了一种可能。
在创面修复过程中,EGF起到了关键性的作用,它不仅诱导干细胞向表皮细胞分化,与其受体相结合,还通过G蛋白偶联活化蛋白激酶系统引起细胞内钙含量的增加及蛋白磷酸化,并通过调节基因的表达,诱发DNA合成促进有丝分裂[16],能促进细胞增殖、表皮再生、血管的形成;同时能够刺激表皮细胞合成分泌胶原、透明质酸等细胞外基质从而促进结缔组织细胞的生长[17]。据报道,CK-19和integrinβ是表皮干细胞的重要标记物[18-19]。因此,我们采用不同浓度的EGF诱导兔ADSCs,来观察其向表皮细胞的转归情况。免疫荧光细胞化学染色显示10ng/ml的诱导组细胞阳性表达CK-19的量明显高于其他组,而在荧光定量PCR检测培养诱导后的CK-19和integrinβ的mRNA表达中,10ng/ml的诱导组也明显高于其他组。因此,笔者认为ADSCs诱导成为表皮细胞的过程中,EGF的最佳浓度为10ng/ml。本实验旨在研究了ADSCs体外诱导分化为表皮细胞所需EGF的最佳诱导浓度,并未将其移植到在动物体内以观察其最终转归情况,这尚待我们更进一步的研究探索。
综上所述,在治疗皮肤缺损中,ADSCs是一种很有前景的治疗方法,对临床上解决严重创伤、大面积烧伤等患者的皮源缺乏问题以及促进创面愈合修复等问题开辟了一条新途径。
[1]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279.
[2]Hlata Y.Do not forget the fundamental merits of repair using a tissue expander[J].Plast Reonstr Surg,2002,109(2):819-822.
[3]MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[4]傅士博,王雪,温从吉,等.脂肪干细胞在皮肤创伤修复中的研究进展与应用前景[J].中华损伤与修复杂志,2012,7(1):80-82.
[5]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue: implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[6]Nakano H,Tateishi A,Imamura T,et al.RT-PCR suggests human skeletal muscle origin of alveolar soft-part sarcoma[J]. Oncology,2000,58(4):319-323.
[7]Doherty MJ,Ashton BA,Walsh S,et al.Vascular pericytes express osteogential in vitro and in vitro[J].Bone Mine Res,1998,13(5):828-834.
[8]Zavan B,Michelotto L,Lancerotto L,et al.Neural potential of a stem cell population in the adipose and cutaneous tissues[J].Neuro Res,2010,32(1):47-54.
[9]Ou Y,Yuan XD,Cai YN,et al.Ultrastructure and electrophysiology of astrocytes differentiated from adult adipose-derived stromal cells[J]. Chin Med J,2011,124(17):2656-2660.
[10]Zhu WD,Xu YM,Feng C,et al.Bladder reconstruction with adiposederived stem cell-seeded bladder acellular matrix grafts improve morphology composition[J].World Jurol,2010,28(4):493-498.
[11]杨进,王坤杰,李虹.人源脂肪干细胞向膀胱平滑肌细胞诱导分化的试验研究[J].四川解剖学杂志,2011,19(2):45-61.
[12]梁爽,袁桂峰,钟毓娟,等.小鼠脂肪干细胞的免疫原性及移植安全性[J].中国组织工程研究,2012,16(1):47-50.
[13]Fu X,Sun X,Li X,Shen Z.Dedifferentiation of epidermal cells to stem cells in vivo[J].Lancet,2001,358(9287):1067-1068.
[14]Planat-Benard V,Silvestre JS,Cousin B,et al.Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives[J].Circulation,2004,109(5):656-663.
[15]阎贺,张永平,徐淑娟,等.脂肪来源干细胞对兔皮肤组织扩张后回缩率的影响[J].中国美容整形外科杂志,2014,25(6):370-373.
[16]Piazuelo E,Jimenez P,Lanas A,et al.Platelet-derived growth factor and epidermal growth factor play a major role in human colonic fbroblast repair activities[J].Eur Surg Res,2000,32(3):191-196.
[17]Gope R.The effect of epidermal growth factor & plateletderived growth factors on wound healing process[J].Indian Med Res,2002,116:201-206.
[18]Michel M,Torok N,Godbout MJ,et al.Keratin 19 as a biochemical marker of skin stem cells in vivo and invitro: keratin 19 expressing cells are differentially localized in function of anatomic sites and their number varies with donor age and culture stage[J].Cell Sci,1996,109(Pt5):1017-2889.
[19]Jones PH,Watt FM.Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression[J].Cell,1993,7(4):713-724.
编辑/张惠娟
Effect of different concentrations of EGF on the source of adipose-derived stem cells in rabbits in vitro differentiation in the research of epidermal cells
HU Ya-uan1,YAO Yong-ming1,ZHANG Ze-min1,ZHANG Fan2,WANG Jun1,YANG Biao-bing3
(1.Department of Plastic Surgery,Graduate School,Weifang Medical University,Weifang 261053,Shandong,China;
2.Department of Plastic Surgery,Graduate, The People's Hospital Feixian,Linyi 273400, Shandong,China; 3.Institution of Plastic Surgery,Weifang Medical University,Weifang 261053,Shandong,China)
ObjectiveTo explore the EGF on ADSCs in rabbits in vitro differentiation of epidermal cells and the best concentration for tissue engineering on plastic surgery research provides theoretical basis for further .Explore the EGF on ADSCs in rabbits invitro differentiate of epidermal cells as well as the best optimal concentration needed for tissue engineering to provide further theoretical basis in plastic surgery.MethodsFat isolated from 2 months healthy white rabbit was isolated,cultured,generated ADSCs. Experiment is divided into induction group and not induced group,induced group with 8ng/ml,10ng/ml,20ng/ml of EGF to intervene,not induced group were compared with the same amount of saline.The work also includes observing the different concentration of EGF on ADSCs to epidermis cells in the change of morphology;ADSCs was induced 1 week and detection the expression and of CK-19,and Fluorescence PCR for testing the expression of CK-19 and integrinβ mRNA expression.ADSCs induced by one week of cells by immunofluorescence CK-19 expression was detected,and the fuorescence quantitative PCR to detect CK-19 integrin β of mRNA expression.ResultsInduction of groups with different concentration of EGF was not obvious change in morphology.The shape were still a long fusiform or polygon;Immunofuorescence showed that some cells of EGF for 10ng/ml can be induced group positive expression of the epidermal cells specific markers CK-19 and the number of expression is significantly higher than other groups,not induced group of cells in the test were negative; Fluorescence quantitative PCR results showed that the group of EGF for 10ng/ml expressing specifcity factor CK-19 and mRNA of integrinβ were signifcantly higher than the rest of the group (P<0.01).ConclusionEGF can successfully induced ADSCs to epidermal cells.Different concentrations of EGF on the source of ADSCs in rabbit in vitro differentiation,the best concentration of EGF is 10ng/ml.
Q813.1
A
1008-6455(2016)07-0047-04
山东省医药卫生科技发展计划项目(2014WS0470)
杨彪炳,主任医师,硕士生导师;研究方向:整形外科,E-mail:ybiaobing@163.com
2016-04-08
2016-07-01
