三草酸合铁(III)酸钾合成方法的改进
2016-09-19肖圣雄王晓伦柏爱玲杨斌姣郭贤丽蒋建宏刘文奇
肖圣雄 王晓伦 柏爱玲 杨斌姣 郭贤丽 张 禹 蒋建宏 刘文奇
(湘南学院化学生物与环境工程学院,湖南郴州423043)
三草酸合铁(III)酸钾合成方法的改进
肖圣雄王晓伦柏爱玲杨斌姣郭贤丽张禹蒋建宏刘文奇*
(湘南学院化学生物与环境工程学院,湖南郴州423043)
三草酸合铁(III)酸钾具有工业生产价值,其合成作为化学专业本科生的经典实验项目,按教材实验的效果却不尽人意。本文在严谨的化学平衡理论分析基础上,首次提出提高合成产率的关键是严格控制草酸和草酸钾的用量,改进后的合成条件为:氧化步骤H2O2的浓度为6%,水浴温度为40°C;充分氧化后,微沸2分钟;酸溶步骤中草酸稍微过量,草酸钾过量10%;结晶时做到充分冷却。经此改进,可简化操作,节约原料,实验室平均产率达87%,教学中学生实验平均产率超过70%。
三草酸合铁(III)酸钾;配合物;合成;化学平衡
三草酸合铁(III)酸钾,即K[Fe(CO)]·3HO(CAS号:5936-11-8),密度为2.138 g·cm-3,为翠绿
32432色单斜晶体,溶于水(100 g水中溶解度:0°C时,4.7 g;100°C时,117.7 g),难溶于乙醇、丙酮。110°C下失去3分子结晶水而成为K3[Fe(C2O4)3],230°C时分解。该配合物对光敏感,光照下即发生分解。三草酸合铁(III)酸钾是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂,因而具有良好的工业生产价值[1,2]。3个双齿的草酸根离子与铁形成八面体型配位,因此它有∧-和Δ-两种异构体。中心离子Fe3+的杂化态为d2sp3,价层电子构型为3d5,K3[Fe(C2O4)3]是高自旋的外轨配合物,草酸根属于弱场配体[3]。298.15 K时,三氯化铁和草酸钾反应的反应焓为(-78.55±3.90)kJ·mol-1,K3[Fe(C2O4)3]·3H2O标准摩尔生成焓为(-4211.22±3.90)kJ·mol-1[4]。[Fe(C2O4)3]3-稳定常数为1.6×1020,而[Fe(C2O4)3]4-的仅为1.7×105[5]。
目前,合成三草酸合铁(III)酸钾的工艺路线有多种。例如可以铁为原料制得硫酸亚铁胺,加草酸钾制得草酸亚铁后经氧化合成三草酸合铁(III)酸钾;或以硫酸铁与草酸钾为原料直接合成三草酸合铁(III)酸钾;亦可用三氯化铁或硫酸铁与草酸钾直接合成三草酸合铁(III)酸钾。作为化学专业本科生的经典实验项目,传统实验中采用的方法虽可以得到产品,但学生做出来的实验现象千差万别,原料浪费大,产率低,产品形态差,结晶时间长等。为此科研人员已做了大量研究[6-10],然而众说纷纭,相互矛盾。我们查阅大量参考文献,在实践过程中注重化学平衡计算分析,并反复试验,得出了用硫酸亚铁铵制备三草酸合铁(III)酸钾的最优化合成方法。
1 实验部分
1.1仪器和试剂
美国PE-2400元素分析仪;岛津AUY220电子天平;恒温磁力搅拌水浴锅。
硫酸亚铁铵[(NH4)2Fe(SO4)2]·6H2O(AR,国药集团化学试剂有限公司);草酸钾K2C2O4·H2O(AR,天津市化学试剂研究所);二水合草酸H2C2O4·2H2O(AR,天津市化学试剂研究所);无水乙醇(AR,含量大于95%,湖南汇虹试剂有限公司);H2SO4(AR),配制3 mol·L-1溶液备用;30%H2O2,实验前配制成6%溶液备用;实验用水为二重蒸馏水。
1.2实验原理
本实验采用硫酸亚铁铵加草酸钾形成草酸亚铁,再经氧化结晶得三草酸合铁(III)酸钾。首先,将适量的硫酸亚铁铵在酸性条件下加热溶解,在不断搅拌下加入过量草酸,加热至沸,静置生成黄色草酸亚铁沉淀;再在双氧水氧化的条件下和草酸钾配位生成三草酸合铁(III)酸钾和红褐色氢氧化铁沉淀;最后补充适量草酸和草酸钾使氢氧化铁沉淀转化为三草酸合铁(III)酸钾。反应式如下:
1.3制备三草酸合铁(lll)酸钾晶体
I组实验按照教材[11]内容设计,II组使用文献方法[1]合成,III、IV组按如下改进的方法合成。
取5.0000 g(NH4)2Fe(SO4)2·6H2O(12.5 mmol)于250 mL烧杯中,加5滴3 mol·L-1H2SO4,再加20 mL H2O,加热溶解。在不断搅拌下加入含20 mmol H2C2O4的溶液(过量),煮沸后静置得FeC2O4·2H2O淡黄色沉淀,倾去上层清液,用适量蒸馏水洗涤沉淀3-4次。在上述沉淀中加入10 mL溶有3.685 g草酸钾(20 mmol)的水溶液,水浴恒温维持40°C,缓慢滴加20 mL 3%H2O2溶液(III组)或10 mL 6%H2O2溶液(IV组),此时有棕色的Fe(OH)3沉淀生成。加热溶液微沸2 min后,交替滴加溶有1.134 g草酸(9 mmol)的溶液与溶有1.105 g草酸钾(6 mmol)的溶液并不断搅拌,至溶液呈透明的亮绿色。加无水乙醇15 mL,将溶液置于暗处结晶,抽滤,用50%乙醇洗涤,50°C烘干1 h,得产品,称量,计算产率,避光保存。
主要改进有两处:①直接用取样质量控制草酸和草酸钾的用量,而不采用文献推荐的饱和溶液体积法;②用6%的H2O2替代教材中推荐的3%H2O2,以减少结晶母液的体积。
2 结果与讨论
2.1合成实验结果
控制条件及实验结果见表1。

表1 合成实验数据
由表1可看出,在反应温度、酸度,及其他条件相同的情况下,按计量加入足够的草酸和草酸钾可以提高近40%的产率,结晶母液pH约为3。
产品为翠绿、透明、规则的单斜晶体,外观与文献报道[2,11]的三草酸合铁(III)酸钾晶体一致。元素分析结果表明,其组成各元素含量与目标产品元素含量一致。
2016年在应用化学专业实验教学中应用改进的合成方法,全部新生分35个小组进行实验,平均产率达70%。
三价铁离子和草酸根形成三草酸铁络离子:

2.3最合适的溶液pH
为简化计算,暂不考虑草酸的分步电离,依总电离方程式[5]:

根据pH的定义,可知[H+]=10-pH,代入即得:
2.4K2C2O4和H2C2O4的用量对pH的影响
实验投入的Fe2+完全转化成配合物理论上需要19 mmol K2C2O4、6.3 mmol H2C2O4,过量的部分参与解离平衡:
图1 溶液pH与]的关系
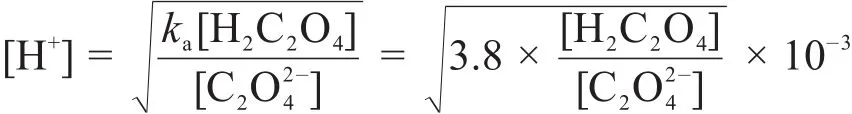
由图2可见,pH对草酸的用量极为敏感。草酸只要过量一点(<5%),即使草酸钾大大过量(>50%),溶液pH也将小于3.5。所以测定滤液pH是简便可靠的监测草酸、草酸钾用量的方法。

图2 H2C2O4、K2C2O4过量与溶液pH的关系电子版为彩图
2.5温度对定量加样的影响
不同温度下草酸和草酸钾的溶解度数据见表2。常温(25°C)下饱和草酸溶液的浓度约为1 mol·L-1,南方冬季室温约为10°C,则饱和草酸溶液浓度只有0.5 mol·L-1。常温下饱和草酸钾溶液浓度约为2 mol·L-1,冬季饱和浓度低至1.7 mol·L-1以下。可见,室温对草酸溶解的影响更大,气温低时按饱和溶液的体积计量必定导致草酸的加入量不足,大大降低产率和产品质量。本文以加入反应物的质量为计量依据,平均产率较传统方法提高约40%。
2.6产品呈黄绿色的原因
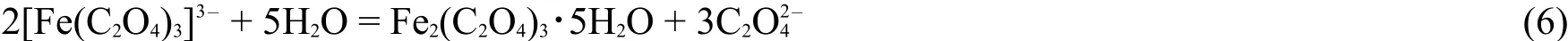
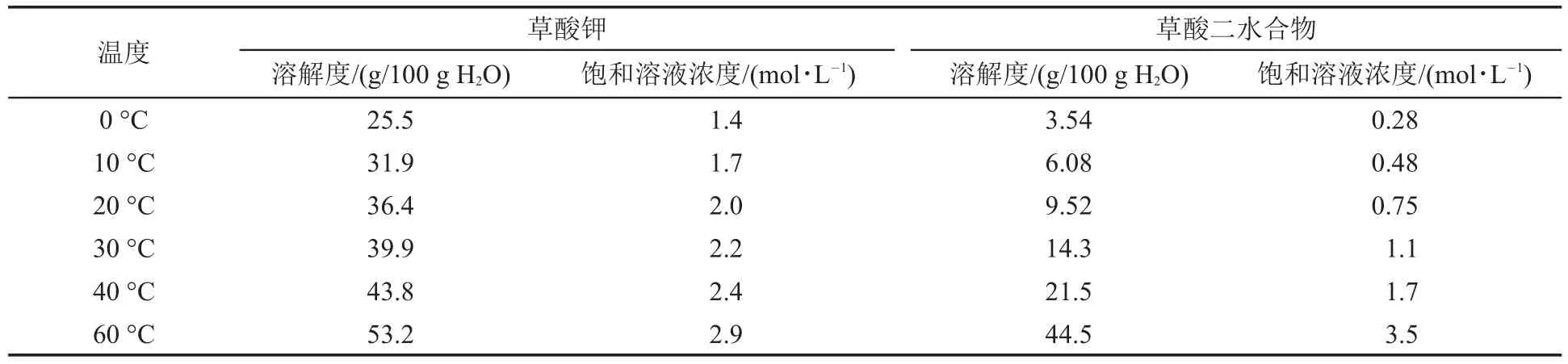
表2 草酸和草酸钾溶解度与温度的关系[12]
更好的方法是用pH试纸检验母液,pH>4说明草酸不足量,则加入草酸;pH<3说明草酸钾用量不足,则加入草酸钾;母液会转变为翠绿色。
2.7草酸亚铁的产率与硫酸用量的关系
从式(7)可知硫酸对草酸亚铁的生成有抑制作用,滴加硫酸的目的是为了防止Fe2+水解,而硫酸亚铁铵溶液在微酸条件下即可稳定,所以这一步硫酸的用量与文献值相比要减半。

3 结论
在化学平衡物料计算的基础上,通过正交实验,首次提出严格按计量控制草酸和草酸钾酸的用量是合成三草酸合铁(III)酸钾的关键,并指出了最佳合成条件为:
1)酸溶步骤,严格按计量加入草酸、草酸钾,保证草酸稍过量,草酸钾过量10%。当母液颜色偏黄,检测溶液pH。若pH大于4则补充适量草酸,若pH小于3则补充适量草酸钾。对于工业生产亦可如此。
2)氧化步骤,提高H2O2的浓度为6%,水浴温度为40°C;充分氧化后,微沸2分钟以除去过量的H2O2。
3)目标产物易溶于水,且溶解度随温度升高迅速增大,所以提高产量的关键是设法减小结晶母液体积,如酸溶过程中直接加入固体试剂,结晶时要做到充分冷却。
通过对本实验改进的探索,我们加深了对化学平衡原理的理解。本科阶段的多个无机合成实验都体现了这一原则,如三氯化六氨合钴(III)、摩尔盐的制备,但师生对此都没有给予足够的重视,往往更多地从反应温度、时间、搅拌、添加顺序等技巧方面寻求改进的方案。更由于该实验耗时长,研究者往往都是从有限的几组实验结果进行分析,样本太少,难以抓住要害。事实上,一个化学反应过程,通常只有一两个关键步骤。本实验结果表明,只要按计量加入草酸、草酸钾,即使没有严格控制其他条件,也都能得到高的产率和好的产品质量。
[1]曹小霞,蒋晓瑜.佳木斯大学学报(自然科学版),2012,30(4),634.
[2]胡锴,陶海燕,刘欲文,余幼祖.大学化学,2013,28(2),57.
[3]凌必文,刁海生.安庆师范学院学报(自然科学版),2001,7(4),13.
[4]雷克林,杨海浪,隆琪,曲征南,刘义.武汉理工大学学报,2004,26(5),38.
[5]Dean,J.A.Langeʹs Handbook of Chemistry,13th ed.;Science Press:Beijing,1991;pp 5.
[6]吕忆民,段双双,洪俊逸,周丽丽,王晓彤.教育教学论坛,2012,20(3),251.
[7]郑臣谋,林的的,杨学强,郑带娣.大学化学,1999,14(2),41.
[8]程春英.实验室科学,2009,No.6,62.
[9]林爱琴.福建师范大学福清分校学报,2011,107(5),62.
[10]曹小霞,蒋晓瑜.长春师范学院学报,2012,31(9),42.
[11]李强国.基础化学实验.南京:南京大学出版社,2012:127.
[12]刘光启.化学化工物性数据手册(有机卷).北京:化学工业出版社,2002:51.
lmprovements on Synthesis of Potassium Tris(oxalato)Ferrate(lll)Trihydrate
XIAO Sheng-XiongWANG Xiao-LunBAIAi-LingYANG Bin-JiaoGUO Xian-Li ZHANG YuJIANG Jian-HongLIU Wen-Qi*
(College of Chemical Biological and Environmental Engineering,Xiangnan University,Chenzhou 423043,Hunan Province,P.R.China)
Potassium tris(oxalato)ferrate(III)trihydrate has the industrial production value,and its synthesis is a classic experiment in the laboratory course for chemistry majors.However,results from the experimental procedure in the textbook are unsatisfactory.Based on the rigorous analysis of chemical equilibrium theory,we first proposed that the key factor for improving the yield is to strictly control the amount of oxalic acid and potassium oxalate.The improved synthesis conditions are as follows:in the oxidation step,the reaction is carried out at 40oC,and the concentration of H2O2is 6%;after full oxidation,the solution is kept boiling for two minutes;a slight excess of oxalic acid and 10%excess of potassium oxalate are used in the acid dissolution step;sufficiently cooling is followed in crystallization.With the improved procedure,operations are simplified and raw materials are saved.The yield is 87%for laboratory average and greater than 70%for students in the laboratory class.
Potassium tris(oxalato)ferrate(III)trihydrate;Complex;Synthesis;Chemical equilibrium
O6;G64
10.3866/PKU.DXHX201508009
,Email:lwq5392@sina.com
湖南省普通高校“十二五”专业综合改革试点项目(湘教通[2012]266号);湖南省普通高校实践教学建设项目(湘教通[2013]295号);湘南学院教学改革研究重点项目(湘南学院校发[2013]240号)
