乳腺导管原位癌45例超声声像图特征分析
2016-09-19陈娅娅吕一骏司徒明珠严赟
陈娅娅,吕一骏,司徒明珠,严赟
乳腺导管原位癌45例超声声像图特征分析
陈娅娅,吕一骏,司徒明珠,严赟
目的 探讨导管内原位癌(DCIS)的超声声像图特征,以提高对DCIS的声像特点的认识及超声诊断DCIS的准确率。方法 回顾性分析行手术治疗的临床资料完整的45例患者,全部经病理学证实的DCIS,分析其超声声像图表现。结果 将导管原位癌的超声特征分为以下几类:(1)沿导管分布的低回声结节伴钙化型17例(37.7%),(2)低回声结节型14例(31.1%),(3)囊实混合型7例(15.5%),(4)单纯钙化型4例(8.8%),(4)无超声表现型3例(6.6%)。在45例病灶中超声对沿导管分布的低回声结节伴钙化型诊断准确率为88.2%,对低回声结节型诊断准确率为64.2%,对囊实混合型诊断的准确率为71.4%,对单纯钙化型诊断的准确率为25.0%,总的超声诊断准确率为66.7%,超声对乳腺病灶的检出率较高,为93.3%。结论 DCIS的声像学特征变化多端,然而其有一定的规律可循,高频超声在DCIS的诊断中有一定的价值。
导管内癌;导管原位癌;微钙化;乳腺肿瘤
导管原位癌(DCIS),又称导管内癌、导管上皮内肿瘤、0期乳腺癌,是局限于乳腺终末导管小叶单位内的导管型肿瘤性增生,未突破基底膜,病变延导管系统内广泛分布,发展为浸润性癌的危险性为正常的8~11倍。DCIS在新诊断的乳腺癌中约占20%[1]。在 1983—2003的20年间,由于钼靶筛查的普及,DCIS在50岁及以上妇女中的发病率增加了5倍[2]。DCIS预后良好,较浸润性导管癌有明显差异,瑞典一项为期20年(1987-1999)的对DCIS患者的随访结果显示,在被确诊DCIS后,患者因乳腺癌因素的10年病死率为1.8%,20年病死率为3.9%[3]。多数DCIS首先由钼靶检出,其典型的声像特点:不伴肿块的簇状微钙化[4]。然而由于东方女性腺体致密,而且乳房较小往往不易夹住,仍有部分DCIS钼靶上无任何表现,需要其他影像学辅助。随着超声仪器分辨率的提高,超声作为一种无创的检查方法,越来越被临床重视。近年来随着高频超声的广泛应用,乳腺病变的检出率也越来越高,然而DCIS图像多变,一直是超声诊断的难点。本文回顾性分析超声声像图特点,旨在归纳出特征性的声像特点,提高DCIS的检出率,对DCIS达到早期发现,早期治疗,改善患者预后。现报道如下。
1 资料与方法
1.1 一般资料 收集2012年3月至2015年6月在宁波市医疗中心李惠利医院行乳腺手术治疗,并由病理证实为DCIS的患者45例,45例患者均具有完整的资料,本组患者均为女性,年龄26 ~72岁,平均(47.4±8.1)岁。
1.2 检查方法 采用飞利浦公司IU-22,HDI-5000,探头频率为5~12 MHz,患者取仰卧位以乳头为中心做放射性扫查,发现病灶后对病灶进行多角度多切面扫查,并记录病灶的大小、边缘、边界、内部回声、有无钙化及后方回声等。同时采用Alder:半定量法记录血流情况[5],分4级:0级:无血流;I级:点状、短棒状血流信号;II级:一个断面上1~2条血管,其长度小于病灶的半径;III级:3条以上血管或弥漫性网状血流。根据DCIS的超声表现结合文献报告[6-9],对超声图像进行归纳。
2 结果
45例患者中以乳头溢液为首发症状的有7例,因触及肿块而就诊的有32例,因钼靶发现钙化灶而就诊的有6例。本组病例中血流0级26例,I级7例,II 级3例,III级3个。图像归纳以下5类:(1)沿导管分布的低回声结节伴微钙化型17例(占37.7%),二维声像图特点为乳腺内探及低回声结节,形态多不规则,边缘欠清晰,内可见散在的微小钙化(图1)。此类超声图像最容易被检出,不易被误诊为良性肿瘤。(2)低回声结节型14例(占31.1%),二维超声图像特点为低回声结节,形态可规则或不规则(图2),此型中5例,术前仅提示片状低回声区,此类病变易被误诊为良性乳乳腺病变。(3)囊实混合型7例(占15.5%),二维超声特点为囊实混合型,部分以囊性为主,部位囊壁较厚或者囊内透声较差,边缘往往较规则(图3),此类声像图还包含了局部导管扩张伴结节形成(图4),此类病变较易误诊为囊肿、炎性、导管内乳头状瘤等良性病变。(4)单纯钙化型4例(8%),此型二维声像特点仅出现散在的钙化,无明显占位效应(图5),术前3例误诊为腺体内钙化灶,误诊率较高。(5)无任何超声表现3例(6.6%),此型无任何超声表现。
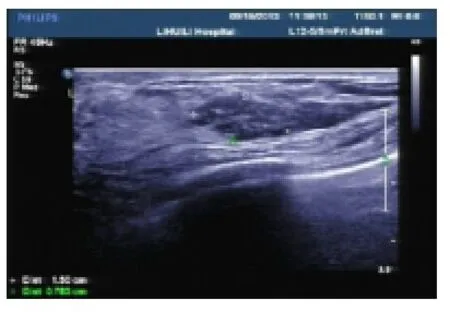
图1 乳腺内探及低回声结节,形态多不规则,边缘欠清晰,内可见散在的微小钙化

图2 低回声结节,形态可规则或不规则

图3 囊实混合型,部分以囊性为主,部位囊壁较厚或者囊内透声较差,边缘往往较规则

图4 局部导管扩张伴结节形成
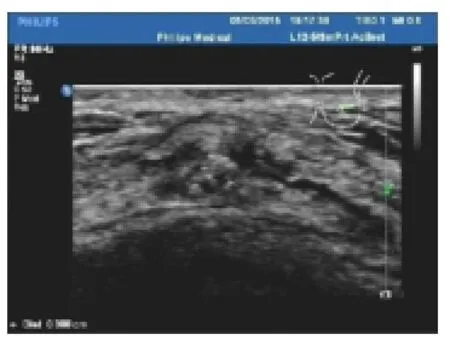
图5 散在的钙化,无明显占位效应
45例病灶中,I型:低回声结节伴钙化型17例中低级别导管原位癌2例,中级别导管原位癌6例,高级别导管原位癌9例;II型:低回声结节型14例中低级别导管原位癌3例,中级别导管原位癌5例,高级别导管原位癌5例,导管内乳头状癌1例;III型:囊实混合回声型7例中低级别导管原位癌5例,中级别导管原位癌2例,高级别导管原位癌1例;IV型:单纯钙化型4例中低级别导管原位癌1例,中级别导管原位癌3例,无任何超声表现型3例中低、中高级别导管原位癌各1例。
3 讨论
DCIS是一种癌前病变,若不及时治疗有部分将发展为浸润性乳腺癌[10],然而DCIS可通过手术治疗达到治愈的效果,所以早期诊断将直接改善患者预后。病理学上根据结构特征分为粉刺型和非粉刺型,然而这种分型无助于预测DCIS的预后[11]。2003年世界卫生组织提倡根据细胞核形态、分裂象、有无坏死,将肿瘤分为高级别、中级别及低级别3类,这种分类与临床预后具有更好的相关性[12]。DCIS的组织分级是影响预后的一个重要元素,其中高级别的DCIS具有较高的浸润趋势及术后复发可能。
本组45例导管原位癌中,I型占的比例最高(37.7%),此类型也是所有类型中诊断准确率最高的一类,仅2例误诊,其中一例术前超声诊断结果为低回声结节伴钙化,这可能一方面与该患者年龄较小仅26岁有关,另一方面和超声医生的经验也有很大的相关性;另一例则被误诊为硬化性腺病,超声对此型声像图表现诊断的准确率为88.2%。II型所占比例为31.1%,次之,其中5例术前仅提示了乳腺内低回声区,误诊的5例病灶中1例边缘规则,1例边缘局部欠规则,余下3例边缘均不规则,此类型的超声声像学特征易误诊为增生腺体,超声对此型声像图表现诊断的准确率为64.2%。III型所占的比例为15.5%,此类声像图包含了局部导管扩张伴结节形成及囊性结节内囊壁增厚等一系列结节,本型共7例,其中误诊的有2例,诊断准确率为71.4%,其中1例考虑导管内病变,提示导管内乳头状瘤可能,另一例则由于超声显示多发囊肿,局部囊肿内囊壁增厚提示囊性增生症可能。IV型占8.8%,共4例,3例误诊,仅一例提示恶性可能,诊断准确率仅25%。V型所占比例为6.6%,共3例,其中3例均由钼靶提示乳腺内小簇状钙化,BI-RADS分级4C级。
45例病灶中超声诊断准确的30例,3例漏诊,诊断准确率仅为66.7%,误诊原因一方面和部分声像图本身缺乏特异性声像特征有关,当然另一方面和医生经验缺乏不无关系。注意以下几点可以有效减少误诊率:(1)当乳腺内出现沿导管分布的低回声结节并伴有散在微小钙化时,可以提示临床导管内原位癌可能。(2)对于导管内病变,伴可触及结节,或者乳头溢液,需要提示临床医生其有一定的恶性可能,必要时行导管造影或其他有效的影像学检查。(3)对于复杂囊肿要想到其有一定的恶性率。(4)对于单纯的低回声结节,结合触诊,若触及的结节明显大于超声检出的结节,需要提示临床其有恶性可能。(5)当乳腺内仅出现散在钙化时,需要观测钙化的大小,若伴有微钙化则建议患者进一步钼靶检查。45例病灶中超声检出42例,超声对乳腺病灶具有较高的检出率,其检出率为93.3%。随着超声仪器的不断进步,高频超声对乳腺病变的检出率将不断提高,伴随超声医生经验的不断积累,对乳腺病变诊断的准确性也将不断的提高。
另外,45例病例中I型病理结果以中、高级别导管原位癌为主,占88%;II型病理结果以中、高级别导管原位癌为主,占71.4%;III型病理结果以低级别导原位癌为主,占71.4%;IV型病理结果以中级别导原位癌为主,占75%。各型超声图像和病理级别的高低是否具有相关性,本文由于病例数较小缺乏统计学意义,仍需进行大样本研究。
本组病例中血流0级26例,I级7例,II级3例,III级3个,与文献报道不符[9],这可能与血流受主观因素影响较大,操作者若按压过重会影响血流检出,当然和超声仪器对血流的敏感性也有很大的相关性。
总之,虽然DCIS声像变化多端,但是其有一个基于病理基础的声像特征,仔细观察病灶会发现病灶具有沿导管分布的特点或者病灶位于扩张导管内形成囊实性结节。超声检查在DCIS的检出中具有一定的临床价值,熟悉DCIS的超声声像特点,有助于提高对DCIS诊断的准确性,降低漏诊及误诊率。
[1] Ernster VL,Ballard-Barbash R,Barlow WE,et al.Detection of ductal carcinoma in situ in women undergoing screening mammography[J].JNatl Cancer Inst,2002, 94(20):1546-1554.
[2] Kerlikowske K.Epidemiology of ductal carcinoma in situ[J].J Natl Cancer Inst Monogr,2010,2010(41):139-141.
[3] Correa C,Mc Gale P,Taylor C,et al.Early Breast Cancer Trialists’ Collaborative Group(EBCTCG).Overview of the randomized trials of radiotherapy in ductal carcinoma in situ of the breast[J].J Natl Cancer Inst Monogr,2010,2010(41):162-177.
[4] Marcotte-Bloeh C,Balu-Maestro C,Chamo-rey E,et a1.MRI for the size assessment of pure ductal carcinoma in situ(DCIS):a prospective study of 33 patients[J].Eur J Radiol,2011,77(3):462-467.
[5] Adler DD,Carson PL,Rubin JM,et al. Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J].Ultrasound Med Bid,1990,16 (6):553-559.
[6] 袁蓉,李泉水,粟晖,等.乳腺导管内癌的超声图像特征分析[J/CD].中华医学超声杂志:电子版,2011,8(6):1250-1254.
[7] 周辉红,徐秋华,燕山.乳腺导管内癌的超声研究[J].中国超声医学杂志,2008,24 (4):367-369.
[8]王建伟,林僖,郑伟,等.乳腺导管内癌超声图像特征分析[J/CD].中华医学超声杂志:电子版,2010,7(11):1808-1814.
[9] 李泉水,邓水平,张家庭,等.超声对乳腺导管原位癌的诊断价值[J].中国超声医学杂志,2010,26(10):896-898.
[10]Wiechmann L,Kuerer HM.The molecular journey from ductal carcinoma in situ to invasive beast[J].Cancer,2008,112 (10):2130-2142.
[11]唐平,魏兵,步宏.乳腺导管原位癌研究新进展[J].临床与实验病理学杂志,2008,24 (1):12-16.
[12]Silverstein MJ,Poller DN,waisman JR,et al.Prognostic classification of breast ductal carcinoma-in-situ[J].Lancet,1995, 345:1154-1157.
10.3969/j.issn.1671-0800.2016.01.058
R445.1
A
1671-0800(2016)01-0109-03
2015-07-01(本文编辑:陈志翔)
315040宁波,宁波市医疗中心李惠利医院
陈娅娅,Email:cyyhz02@ 163.com
