大青叶对酒曲发酵影响的研究
2016-09-19谷雪峰何松贵刘幼强吴振强
谷雪峰,何松贵,刘幼强,吴振强*
(1.华南理工大学生物科学与工程学院,广东广州510062;2.广东省九江酒厂有限公司,广东佛山528203)
大青叶对酒曲发酵影响的研究
谷雪峰1,何松贵2,刘幼强2,吴振强1*
(1.华南理工大学生物科学与工程学院,广东广州510062;2.广东省九江酒厂有限公司,广东佛山528203)
该研究以大青叶作为辅料,探讨添加大青叶对酒曲发酵的影响。结果表明,添加大青叶使培养基质密度降低、基质疏松,有利于发酵过程的通气和传热,发酵后酸度下降。添加大青叶促进酒曲中霉菌的生长,但抑制细菌和酵母生长,并导致生物活性发生变化,影响效果与大青叶的添加量成正比,当添加量为9%时,糖化酶酶活提高4.24倍,液化酶活、发酵力、酯化力等分别下降30%、90%和80%。同时,添加大青叶使酒曲成品的挥发性成分明显增多,酯类物质从4种增加至8种,还增加了苯甲醇和多种高级脂肪酸、烷烃、烯烃、酰胺、醇等物质,这些新增物质将会对酒曲风味产生较大影响。
酒曲发酵;大青叶;微生物;发酵力;酯化力
酒曲作为酒酿造过程中的糖化剂、发酵剂和生香剂,其质量的好坏对酒的风味、产率和品质具有极大的影响。传统酒曲制作多添加中草药作为辅料(如桑叶、野蓼等[1]),少的添加1种,多的甚至上百种[2-3]。添加方法有破碎后直接添加或热水浸煮后取浸提液添加。添加的中草药为酒曲提供植物中的微生物、蛋白质、芳香成分及有毒(抑菌)成分,但对于添加中草药在酒曲制作过程中的作用机理少见报道。
大青叶是我国是传统的清热解毒中草药,具有抗病毒、抗内毒素和抑菌活性[4],临床主要用于流行性感冒、急性传染性肝炎、痢疾、急性肠胃炎、发斑发疹等疾病[5]。以往对大青叶的研究主要在医药和化学成分上,还没有应用于酒曲的研究发表。大青叶主要含有生物碱、有机酸、苷类、甾醇等几大类化合物[6-7],其挥发油成分主要有棕榈酸、植酮、苯甲醇以及正二十九烷等烷烃类物质[8-9]。
本研究以某酒厂酒曲中的一种添加植物——大青叶作为研究对象,探讨添加中草药对酒曲发酵过程酒曲理化参数及微生物活性的影响,为酒曲添加中草药辅料的生产工艺提供理论依据。
1 材料与方法
1.1材料与试剂
大青叶、饼丸(含酿酒酵母、产酯酵母、米根霉、毛霉、华根霉、乳酸菌、醋酸菌等微生物,常温保藏):广东省九江酒厂有限公司;大米、黄豆等:市售;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、肉汤培养基、麦芽汁琼脂培养基、可溶性淀粉、葡萄糖、磷酸二氢铵、磷酸二氢钾、硫酸钙、硫酸镁等(化学纯):国药集团化学试剂有限公司;石油醚(色谱纯)、乙醇(分析纯)、己酸乙酯(分析纯)、乙酸正戊酯(分析纯):上海泰坦科技股份有限公司。
1.2仪器与设备
7890A-5975C气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用分析仪:美国安捷伦公司;GC-2014C气相色谱分析仪:日本岛津公司ZDJ-4A自动电位滴定仪:上海仪电科学仪器股份有限公司;LRH-150B生化培养箱:韶关泰宏医疗器械有限公司;UV-2802SH紫外分光光度计:上海尤尼柯仪器有限公司;5804R冷冻离心机:德国Eppendorf公司。
1.3方法
1.3.1酒曲培养基制备
参考酒厂酒曲制作工艺,以大米和黄豆为主料,两者质量比为8∶2,分别按照1∶1加水、蒸煮30 m in、冷却至35℃左右后混合,同时加入大青叶(粉碎度为1 cm左右)0、4.5%、9%和饼丸(1.5%),于恒温恒湿培养箱中(35℃、相对湿度85%)培养6 d。发酵过程中需定时喷洒雾状水以保持酒曲含水量。每隔2 d取样分析。
1.3.2酒曲挥发性成分提取
将酒曲置于索氏提取管中。量取150 m L石油醚溶剂于250 m L圆底烧瓶内,置于85℃的恒温水浴锅中6 h,取样,20 000 r/min离心15s,上清液(挥发油)置于样瓶中,待测。
1.3.3测定方法
酒曲发酵样品的糖化酶酶活、液化酶酶活、酯化力、含水量、酸度、密度的测定依照参考文献[10]。
发酵力测定采用排饱和碳酸钠溶液收集CO2的方法。酒曲微生物测定:采用稀释平板计数法[11]。
挥发性成分(挥发油)分析方法:挥发油溶解于适量的石油醚,采用GC-MS进行分析。色谱条件:HP-5MS弹性石英毛细柱管(30 m×0.25 mm,0.25 μm);升温程序:50℃保留3 m in,4℃/m in升温至230℃后,保持30 m in;进样量为1 μL;进样口温度为250℃;载气为氦气,流速2 m L/min。质谱条件:电子电离(electron ionization,EI)源;电子能量70 eV;传输线温度280℃;离子源温度230℃;电子倍增器电压1 858.8 V;扫描质量范围35~350 m/z。在HP-5MS柱上使用一系列同源性C8-C25正烷烃对所有挥发成分进行标定分析,并通过美国国家标准与技术研究院(national institute of standards and technology,NIST)数据库进一步确认。各组分相关浓度通过峰面积归一化法计算求出各化合物的峰面积相对含量。
2 结果与分析
2.1添加大青叶对酒曲发酵过程理化指标的影响
不同添加量的大青叶对酒曲理化指标的影响如图1所示。
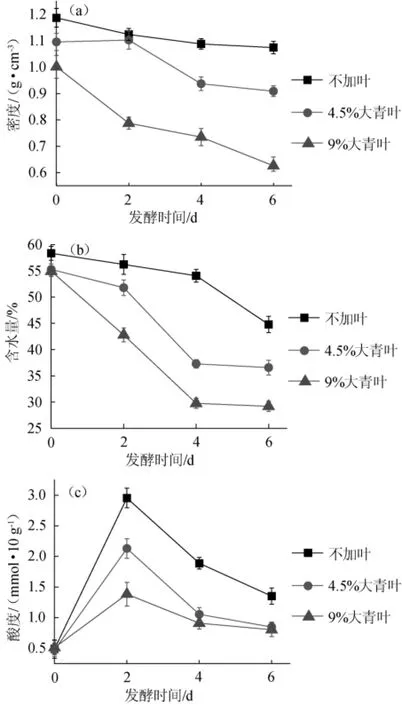
图1 大青叶添加量对发酵过程中密度(a)、含水量(b)、酸度(c)变化的影响Fig.1 Effect of Folium isatidis addition on density(a),moisture content(b)and total titratable acidity(c)change during ferm entation
由图1a可以看出,酒曲密度随着大青叶添加量提高而下降,原因可能是添加大青叶使酒曲基质疏松,添加量越大越疏松,导致密度越小,并随着发酵推进不断下降,密度下降速率也随添加量增加而增大,发酵6 d后添加9%大青叶的样品密度从1.0 g/cm3降至0.63 g/cm3,降幅为37%;而不添加大青叶的样品密度从1.18 g/cm3降至1.10 g/cm3,降幅为10%。这主要是与水分蒸发速率相关。由图1b可以看出,开始时3个样品含水量均>55%,但添加大青叶的样品略低于没有添加的样品,是因为灭菌过程前者水分损失大于后者所致;随着发酵的进行,3个样品的含水量均有所下降,下降速率随大青叶添加量增加而增大,添加9%大青叶的样品含水量降低了25%(4 d),而不加大青叶的样品含水量下降了14%,说明大青叶添加量越大,酒曲基质越疏松,越容易造成水分的损失。含水量和密度的差异将对培养基质的培养环境造成影响,一般含水量低、密度小的基质结构相对疏松,有利于酒曲气流扩散,提高传质传热效率[12],对不同微生物种类的生长和代谢造成不同的影响。由图1c可以看出,酸度随大青叶添加量增加而降低,发酵第2天时3个样品酸度达到最大值,分别为1.38 mmol/10 g(9%大青叶),2.13 mmol/10 g(4.5%大青叶)和2.95 mm ol/10 g(不加大青叶),添加9%大青叶样品的酸度只有不加大青叶样品的47%,因为酸度主要由产酸细菌主导,含水量越高(大青叶添加量越小),细菌生长越好,产酸量越大,酸度就越高,反之大青叶添加量越大,含水量越低,产酸量就越小,酸度就越低。同时,酸度的变化对酒曲微生物生长会产生反馈影响,并在酯化反应生成风味物质过程中产生一定的作用[13]。由此可知,添加大青叶培养后酒曲密度、含水量和酸度均有所下降。
2.2添加大青叶对酒曲微生物生长的影响
酒曲发酵是混菌发酵,其微生物有霉菌、酵母和细菌等三大类[14-16]。三类微生物的比例及数量是酒曲质量的重要参数。不同添加量的大青叶对酒曲微生物指标的影响如图2所示。
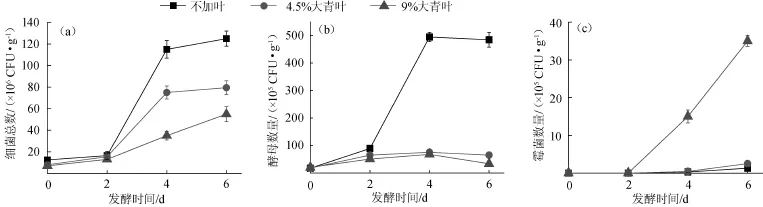
图2 大青叶添加量对发酵过程中细菌(a)、酵母(b)、霉菌(c)数量变化的影响Fig.2 Effect of Folium isatidis addition on bacterium(a),yeast(b)and mold(c)count change during fermentation
由图2可知,不加叶、添加4.5%和9%大青叶样品的细菌总数最大值出现在第6天,分别为1.25×108CFU/g、0.79×108CFU/g和0.55×108CFU/g;酵母细胞数最大值出现在第4天,分别为4.95×107CFU/g、0.76×107CFU/g和0.67×107CFU/g,之后少有下降;霉菌细胞数最大值也出现在第6天,分别为0.13×106CFU/g、0.25×106CFU/g和3.54×106CFU/g,可见,添加大青叶对细菌、酵母、霉菌的生长产生不同的影响,其中对细菌和酵母产生抑制(尤其是对酵母菌的抑制率较大),而对霉菌生长起到促进作用。添加9%大青叶条件下细菌抑制率分别达到56%,酵母抑制率达到86.5%,而霉菌生长率达到对照组和3.62倍。原因之一可能是大青叶的消炎杀菌成分对细菌和酵母有较大作用,而对霉菌的作用不大;另一个原因则是细菌和酵母对水活度的要求较高,而霉菌对水活度的要求较低,当添加大青叶后使发酵基质水分下降,使细菌和酵母的生长受到抑制,同时降低了霉菌生长的营养竞争,使霉菌的生长率大幅增加。根据大青叶添加量不同对3种微生物的抑制或促进影响程度存在较大差异的特点,可以通过改变大青叶添加量实现对霉菌、酵母及细菌比例的调控,从而实现调节酒曲发酵特性的目的,以生产具有特定特性的酒曲。
2.3添加大青叶对酒曲生物活性的影
添加大青叶对酒曲各种酶活力及发酵特性影响如图3所示。
由图3可知,酒曲糖化酶酶活随着大青叶添加比例的增加而提高,添加9%大青叶时糖化酶最大值达到367 U/g,是不加叶样品最大糖化酶酶活(70 U/g)的5.24倍。主要原因是大青叶促进霉菌的生长,而糖化酶活力与霉菌的生长繁殖密切相关,因此糖化酶活力随霉菌快速增长而大幅提升。但液化酶则表现出相反的结果,其酶活随大青叶添加量的增加而降低,添加量为9%时降低30%,原因可能是由于基质水含量过低降低霉菌代谢液化酶的能力,同时细菌、酵母生长受到大青叶抑制也不利液化酶的代谢,具体确证数据还需要后续作深入研究。另一方面,发酵力随大青叶添加量增加而降低,当添加9%大青叶时发酵力为31.71 m L/(g·72 h),只达到不加叶样品发酵力的10.3%,发酵力下降了接近90%。因为发酵力主要来源于活性酵母,添加大青叶抑制酵母的生长,使酵母生长量的降低,从而使发酵力随之下降。添加大青叶后酯化力下降,从424 mg/(g·100 h)(不加叶)下降至85 mg/(g·100 h)(9%大青叶),下降达80%,原因主要是添加大青叶后导致酒曲水分下降,从而抑制酯化酶产率。可见,添加大青叶对酒曲发酵特性产生较大影响,体现为提升糖化酶活力,但降低发酵力、酯化力和液化酶活力,传统酒曲生产中需要添加多种酒饼叶作为辅料,包括桂叶、大青叶、假鹰爪叶等,如果添加大青叶的比例过大将明显降低酒曲发酵力、酯化力等指标,因此适当控制大青叶添加比例。
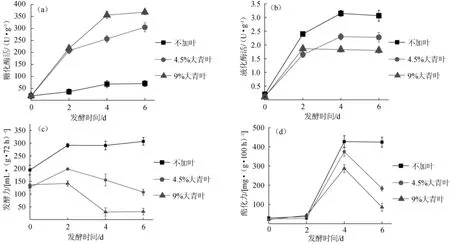
图3 大青叶添加量对发酵过程中糖化酶活(a)、液化酶活(b)、发酵力(c)、酯化力(d)的影响Fig.3 Effect of Folium isatidis addition on saccharifying power(a),liquefying power(b),fermenting power(c)and esterifying powe r(d)during fermentation
2.4酒曲发酵过程中残留挥发性成分分析
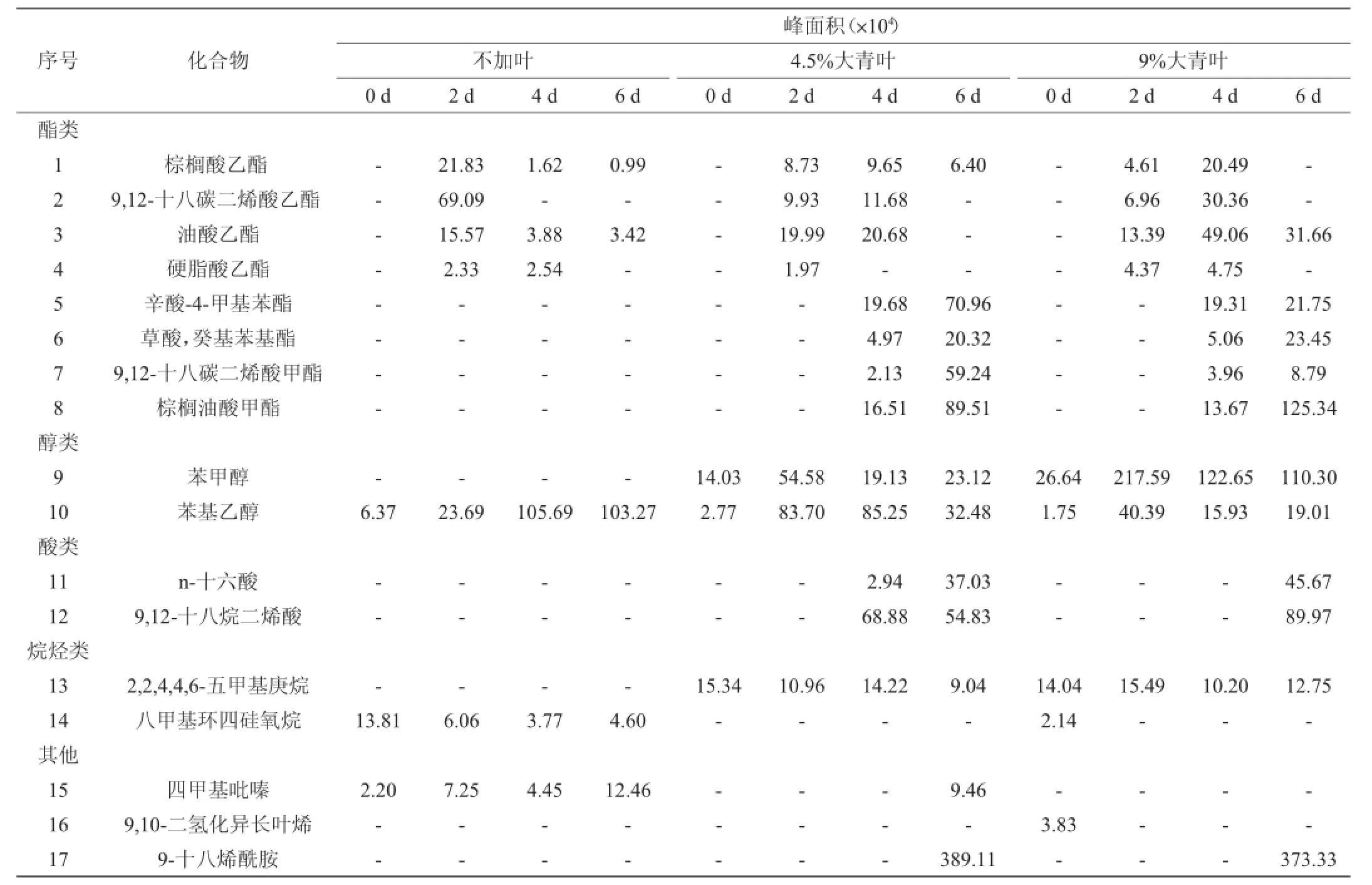
表2 添加不同比例大青叶的酒曲在发酵过程中的挥发性成分Table 2 Volatile com pounds of Jiuqu with different Folium isatidis addition during fermentation
由表2可知,添加大青叶使酒曲的挥发性成分明显增多,由对照组的7种物质增加到11~17种物质,其中酯类物质从4种(1种甲酯和3种乙酯)增加至8种,新增的4种包括:辛酸-4-甲基苯酯、草酸-癸基苯基酯、9,12-十八碳二烯酸甲酯、棕榈油酸甲酯等。这些酯并不是大青叶原有物质,表示是生物合成或转化的结果。有研究表明,酒曲发酵的通气状况及基质成分会影响酯类物质的生成[16-17],本实验加入大青叶后对酒曲培养基的通气条件及理化性质具有调节作用,有利于促进酒曲中酯类物质的生成。
对照组测出的4种酯在发酵中期都存在,发酵后期消减或消失,到第6天发酵结束时只剩2种,包括棕榈酸乙酯和油酸乙酯。添加大青叶对该4种酯类代谢或合成有促进作用,第4天达到最大,这与酒曲的酯化力在第4天达到最大值(图3)的结果吻合,可以解释在第4天有大量酯类物质生成的原因,但后期出现分解现象,只残留1种,棕榈酸乙酯或油酸乙酯。新增的四种酯类成分均在发酵至第4天检测出来,且在第6天达到最大值,与对照组的4种酯后期被消减的合成机制不同,这有利于保障酒曲产品最终的酯类成分。
在检出的2种醇类物质中,新增了具有防腐功能的苯甲醇物质,其含量随大青叶添加量增加而增加,当大青叶从4.5%增加至9%,苯甲醇值增加达3.76倍;相反,苯基乙醇(芳香类物质)含量则随大青叶的添加量增大有较大幅度的降低,与不添加大青叶酒曲比较,添加9%大青叶时苯基乙醇下降幅度达到81.6%。在整个发酵过程中,两种醇类物质均在第2~4天达到最大值,发酵后期有所减少,可推测这与物质挥发以及成分转化反应有关。
另外,添加大青叶后还新增了其他几种物质,包括n-十六酸、(Z,Z)-9,12-十八烷二烯酸、9,10-二氢化异长叶烯、2,2,4,4,6-五甲基庚烷、9-十八烯酰胺,其中9-十八烯酰胺的含量最大,这些成分将对形成酒曲特有风味起到重要作用。
3 结论
添加大青叶可调节酒曲基质结构较疏松、气流扩散和水分挥发,对培养过程酒曲密度、含水量和酸度产生影响。随着大青叶添加比例的增加,发酵过程酒曲密度、含水量和酸度下降趋势加剧,影响酵母、细菌和霉菌的生长与代谢,表现为促进霉菌的生长,但抑制酵母和细菌的生长,提高糖化酶酶活,降低液化酶酶活、发酵力和酯化力等。传统酒曲生产中需要添加多种酒饼叶作为辅料,包括桂叶、大青叶、假鹰爪叶等,如果添加大青叶的比例过大将明显降低酒曲发酵力、酯化力等指标,建议酒厂在酒曲实际生产过程中适当控制大青叶添加比例。
添加大青叶后酒曲检测出的挥发性物质比不添加的对照组明显增多,包括新增4种酯类物质,还有苯甲醇和多种高级脂肪酸、烷、烯、酰胺等物质,但在新增的挥发性成分中没有发现大青叶的原始成分,表明大青叶的挥发性成分不是直接残留,而是在酒曲发酵中通过微生物代谢或转化形成新的风味物质或功能成分,对酒曲的性能产生影响。本研究结果将为酒曲中添加大青叶辅料工艺提供科学依据,并为添加其他中草药辅料工艺提供借鉴。
[1]傅金泉.中国酒曲的起源与发展史探讨[J].中国酿造,2010,39(6):180-186.
[2]王政军.中国古代酒曲制造发展简述[J].酿酒科技,2016(1):107-109,115.
[3]王都留,何九军,叶文斌,等.麦淋酒酒曲中“百草尖”配方的研究[J].酿酒科技,2015(6):38-40.
[4]LIU Z,YANG Z Q,XIAO H.Antiviral activity of the effective monomers from Folium isatidis against influenza virus in vivo[J].Virologica Sinica,2010,25(6):445-451.
[5]ZHANG Q,BO H,ZHENG L H,et al.Matrix solid-phase dispersion extraction followed by HPLC-diode array detection method for the determination of major constituents in a traditional Chinese medicine Folium isatidis(Da-qing-ye)[J].J Separat Sci,2012,35(18):2453-2459.
[6]LI T,QU X Y,ZHANG Q A,et al.Ultrasound-assisted extraction and profile characteristics of seed oil from Isatis indigotica Fort[J].Ind Crop Prod,2012,35(1):98-104.
[7]陈智华,梁剑平,魏恒.大青叶中4(3H)喹唑酮提取工艺的研究[J].中国兽医科学,2009(2):185-188.
[8]米盈盈,薛娟,张宏伟,等.大青叶挥发油成分GC-MS分析[J].化学工程师,2015,29(3):21-22,30.
[9]姬志强,张建民,李永丽,等.大青叶脂溶性成分的GC-MS分析[J].中国药师,2014(6):950-952.
[10]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
[11]LI P,LI S,CHENG L,et al.Analyzing the relation between the m icrobial diversity of DaQu and the turbidity spoilage of traditional Chinese vinegar[J].App l M icrob iol Biot,2014,98(13):6073-6084.
[12]XU E,LI H,WU Z,et al.Influence of enzymatic extrusion liquefaction pretreatment for Chinese rice w ine on the volatiles generated from extruded rice[J].J Food Sci,2015,80(1):C29-C39.
[13]MO X L,YAN X,FAN W L.Characterization of aroma compounds in Chinese rice w ine qu by solvent-assisted flavor evaporation and headspace solid-phase microextraction[J].J Agr Food Chem,2010,58(4):2462-2469.
[14]董士伟,吴兴泉,王德良,等.豉香型白酒中产酯酵母的筛选与应用[J].中国酿造,2012,31(2):130-133.
[15]蔡丽,易响,陈福生,等.传统米酒酒曲的评价及根霉的分类鉴定[J].中国酿造,2010,29(12):30-33.
[16]HU Y,PAN L,DUN Y,et al.Conversion of yellow wine lees into high-protein yeast culture by solid-state fermentation[J].Biotechnology &Biotechnological Equipment,2014,28(5):843-849.
[17]SAERENS SM,DELVAUX F,VERSTREPEN KJ,et al.Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation[J].Appl Environ M icrobiol,2008,74(2):454-461.
Effect of Folium isatidis on Jiuqu fermentation
GU Xuefeng1,HE Songgui2,LIU Youqiang2,WU Zhenqiang1*
(1.School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China;2.Guangdong Jiujiang Distillery Co.,Ltd.,Foshan 528203,China)
The effect of Folium Isatidis(FI)addition on Jiuqu fermentation was discussed.The results showed that FI addition was beneficial for aeration and heat-transfer in the fermentation as well as regulating the high acidity through reducing the substrate density and loosening the substrate structure.As a result,FI addition can promote mold grow th in Jiuqu,whereas inhibit yeasts and bacteria growth at the mean time,which resulted in biological activity change.The impact effect was promotional to the FI addition.When FI addition was 9%,the saccharifying enzymes activity im proved 4.24 times,the liquefying power,fermenting power and esterifying power decreased 30%,90%and 80%,respectively.Accordingly,FI addition significantly increased volatile compounds in Jiuqu,esters compounds species increased from 4 to 8,besides,benzyl alcohols,higher aliphatic acids,alkanes,alkenes,am ides and some other alcohols were increased,which could contribute significant influence on Jiuqu flavor.
Jiuqu fermentation;Folium isatidis;microorganism;fermenting power;esterifying power
TS261.4
0254-5071(2016)05-0065-05
10.11882/j.issn.0254-5071.2016.05.014
2016-03-10
广东省江门市农业科技攻关计划项目(20150160008347)
谷雪峰(1990-),男,硕士研究生,研究方向为发酵工程、酒类发酵。
吴振强(1963-),男,教授,博士,研究方向为发酵工程、天然产物发酵生物转化。
