一株褐藻酸裂解酶高产菌的筛选及其酶学性质研究
2016-09-19陈洪基姜国良闫广思
陈洪基,姜国良*,闫广思
(中国海洋大学海洋生命学院,山东青岛266003)
一株褐藻酸裂解酶高产菌的筛选及其酶学性质研究
陈洪基,姜国良*,闫广思
(中国海洋大学海洋生命学院,山东青岛266003)
从腐烂的海带中筛选出一株褐藻酸裂解酶(A ly)高产菌,经形态学分析、生理生化特征和分子水平鉴定,该菌为交替假单胞菌属,命名为Pseudoalteromonas sp.EE258。利用硫酸铵沉淀、快流速DEAE-琼脂糖凝胶(DEAE-sepharose Fast Flow)和丙烯葡聚糖凝胶(Sephacryl S-100)柱层析等方法,对Pseudoalteromonas sp.EE258产生的褐藻酸裂解酶A ly-EE258进行分离纯化,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定该酶的分子质量为23 ku。酶学性质研究显示:该酶的最适反应温度为40℃,最适反应pH值为7.0,在20℃以下时稳定性较好,Ca2+和Ba2+能明显提高酶的活性,Fe2+、A l3+、Mg2+和乙二胺四乙酸(EDTA)抑制酶的活性。Aly-EE258能不同程度地裂解褐藻酸、聚古洛糖醛酸和聚甘露糖醛酸,其中聚甘露糖醛酸裂解后主要产生单一的低聚寡糖,在实际应用方面具有重要意义。
交替假单胞菌属;褐藻酸裂解酶;酶学性质
褐藻酸(alginate)是一种大分子线性多糖,β-D-甘露糖醛酸(β-D-mannose hyaluronic acid,M)和其C5差向异构体α-L-古罗糖醛酸(α-L-guluronic acid,G)通过α-1,4-糖苷键结合形成3种褐藻酸分子:聚β-D-甘露糖醛酸(ploymannuronic acid,PolyM),聚α-L-古罗糖醛酸(poly gulonic hyaluronic acid,PolyG)和杂聚物(ploy mannuronic acid and gulonic hyaluronic acid,PolyMG)[1]。研究发现,褐藻酸降解产物褐藻酸寡糖具有多种生物活性,包括促生长作用、增强免疫力抗肿瘤活性、诱导子活性、神经保护作用等[2-3],因此其功能性寡糖的开发在国际上己成为一个研究热点。
褐藻酸裂解酶是一类多糖裂解酶,通过β-消去反应能够降解大分子褐藻酸生成低分子量的褐藻酸寡糖或单糖[4],主要来源于海洋动物、海洋细菌及真菌等[5]。在碳水化合物活性酶数据库中,目前研究的褐藻酸裂解酶分布在24个多糖裂解酶(polysaccharide lyase,PL)家族中的PL5、PL6、PL7、PL14、PL15、PL17和PL18家族中[6],其中,蛋白质晶体结构得到解析的褐藻酸裂解酶已有10个。交替假单胞菌属(Pseudoalteromonas sp.)是由GAUTHIER G等[7]发现并建立的一个海洋菌属,广泛存在于海洋污泥和海洋动植物表面,该菌属只能从海洋环境中分离得到。目前,交替假单胞菌产内切葡聚糖酶、κ-卡拉胶酶、甲壳素酶、右旋糖酐酶和几丁质酶等[8-10]的报道较多,但是产褐藻酸裂解酶方面的研究还较少。交替假单胞菌产生的褐藻酸裂解酶可以制备诸多生物活性的海藻寡糖,并且与其他菌属产生的褐藻酸裂解酶性质差异明显,因此开展交替假单胞菌产褐藻酸裂解酶的研究具有很大的开发和应用价值。
本研究从腐烂的海带中分离出了一株褐藻酸裂解酶高产菌,通过形态学、生理生化特征及16S rDNA序列分析进行了鉴定,并对纯化得到的褐藻酸裂解酶酶学性质进行了研究,以期为褐藻酸裂解酶的研究和应用提供参考。
1 材料与方法
1.1材料与试剂
1.1.1样品
腐烂的海带:采自山东荣成海带养殖厂。
1.1.2培养基
初筛培养基:褐藻酸钠5.0 g/L,(NH4)2SO45.0 g/L,K2HPO42.0 g/L,FeSO4·7H2O 0.01 g/L,MgSO4·7H2O 1.0 g/L,NaCl 25.0 g/L,琼脂粉15.0 g/L,pH 7.5。
斜面培养基:褐藻酸钠5.0 g/L,蛋白胨5.0 g/L,酵母提取物1.0 g/L,K2HPO42.0 g/L,FeSO4·7H2O 0.01 g/L,MgSO4·7H2O 1.0g/L,NaCl25.0g/L,琼脂粉15.0g/L,pH 7.5。
复筛与发酵培养基:褐藻酸钠5.0 g/L,蛋白胨5.0 g/L,酵母提取物1.0 g/L,K2HPO42.0 g/L,FeSO4·7H2O 0.01 g/L,MgSO4·7H2O 1.0 g/L,NaCl 25.0 g/L,pH 7.5。
1.1.3化学试剂
酵母粉:英国Oxoid公司;牛血清白蛋白、甲叉双丙烯酰胺、考马斯亮蓝G-250、十二烷基磺酸钠:美国Sigma-Aldrich公司;三羟甲基氨基甲烷(Tris base):美国Promega公司;其他试剂均为国产分析纯。
1.2仪器与设备
Unic2000可见分光光度计:尤尼柯仪器有限公司;CF16RXⅡ日立多用途离心机:日立工机有限公司;BS110S精密电子天平:德国Sartorius公司;DK-824电热恒温水浴锅:上海精宏实验仪器有限公司;DYY-6B稳压稳流电泳仪:北京六一仪器厂;YC-1层析实验冷柜:北京博医康实验仪器有限公司;BS-100A自动部分收集器:上海青浦泸西仪器厂。层析柱(1.6 cm×30 cm,1.6 cm×80 cm):江阴市创通层析设备有限公司。
1.3实验方法
1.3.1酶活力和总蛋白含量的测定方法
取1 m L酶样品和2 m L 1%褐藻酸钠溶液于试管中,40℃水浴反应30 m in,立即置于沸水浴10 m in终止反应。取1 m L反应液和3 m L 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)于25m L比色管中,置于沸水浴反应5 min,取出后置于冰水浴中迅速冷却,用蒸馏水定容至25 m L,在波长550 nm处测定吸光度值[11]。褐藻酸裂解酶活定义:在上述实验条件下,每分钟产生1 μg还原性糖所需的酶量为一个酶活力单位(U)。总蛋白含量采用Braford法测定[12]。相关计算公式如下:

1.3.2菌株的筛选
1.3.3菌种鉴定
利用显微镜观察优选菌种形态,参照《常见细菌系统鉴定手册》[13]中生理生化试验方法,对优选菌株进行初步鉴定。
优选菌株分子生物学鉴定:利用细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒提取目的菌株的基因组DNA,设计细菌通用引物1:5′-AGTTTGATCCTGGCTCAG-3′,引物2:5′-GGTTA CCTTGTTACGACTT-3′,以细菌基因组DNA为模板进行PCR扩增。PCR产物经胶回收后连接到PMD 18-T载体上,测序。将获得的16S rDNA序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)利用局部序列排比检索基本工具(basic local alignment search tool,BLAST)工具进行同源性比对,将比对结果导入MEGA6.0,选用邻接(neighbor-joining,NJ)法构建系统发育树[14]。
1.3.4酶的分离纯化
菌株EE258接种到发酵培养基中,25℃、160 r/min培养48 h,使酶活力达到最高。发酵液4℃、10 000×g离心10 m in,上清即为粗酶液。粗酶液进行硫酸铵分级盐析,使硫酸铵饱和度依次达到20%、35%、50%、65%、80%和95%,溶液在冰水浴中缓慢搅拌过夜,离心(4℃、10 000×g离心10 min)后的沉淀用0.05 mol/L Tris-HCl缓冲液(pH 7.5)溶解,测定不同饱和度下的酶活力,收集活性较高的部分。采用截留分子质量为10 ku的超滤浓缩管多次离心(4℃、4 000×g离心10 min)脱盐,在渗出液中加入BaCl2溶液,若无沉淀生成证明(NH4)2SO4已被除去。
脱盐后的粗酶液上样于DEAE-Sepharose FastFlow凝胶柱,用3~4倍柱床体积的初始缓冲液平衡后,用0~0.5 mol/L NaCl洗脱,调节恒流泵流速为30 m L/min,每管收集5 m L。测定每管蛋白浓度及褐藻酸裂解酶活力,建立阴离子交换层析洗脱曲线图。
收集阴离子交换层析后的酶活峰较高的部分,浓缩至2 m L,上Sephacryl S-100过滤层析柱,用初始缓冲液洗脱,流速30 m L/min,每管收集5 m L。收集酶活峰,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳测定蛋白的纯度和分子质量。
1.3.5酶学性质研究
(1)酶的最适温度:在pH值为7.5的条件下,以最大酶活力为100%,测定褐藻酸裂解酶在5~65℃(温度梯度为5℃)范围内的相对酶活,确定酶反应的最适温度。
全固态离子选择性电极因为不含内充液,极易微型化、阵列化和制备成一次性的纸质电极和塑料柔性电极,受到越来越多研究人员的关注。
(2)酶的最适pH:在最适温度的条件下,以酶活力最高者为100%,分别于pH值为5.0、6.0、7.0、8.0、9.0、10.0的缓冲液体系中测定酶的活力,确定酶反应的最适pH。
(3)酶温度稳定性:取适量的酶在5℃、20℃、30℃、40℃、50℃条件下保温不同时间(0.5 h、1.0 h、1.5 h、2.0 h)后,以未处理酶的酶活力为100%,在最适温度和pH条件下测定剩余酶活力,考察酶的稳定性。
(4)金属离子对酶活性的影响:在酶反应体系中分别加入等体积的金属离子K+、Ca2+、Na+、Fe2+、Al3+、Mg2+、Ba2+、M n2+和乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),使金属离子的终浓度为10 mmol/L,以不加金属离子的对照组酶活力为100%,在上述最适温度和pH条件下测定酶活。
(5)NaCl浓度对酶活性的影响:在酶反应体系中加入NaCl,使终浓度为0.2 mol/L、0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L、1.5 mol/L、2.0 mol/L,以不加NaCl的对照组酶活力为100%,在上述最适温度和pH条件下测定酶活。
(6)底物特异性及酶解产物:分别配制1%的褐藻酸钠、PolyM和PolyG底物,加入褐藻酸裂解酶进行反应,用薄层层析(thin layer chromatography,TLC)法分析酶解产物。
2 结果与分析
2.1菌种筛选
从取自腐烂海带的材料中,经稀释涂布,分离能在以褐藻酸钠为唯一碳源的培养基中生长的菌株,初筛得到18株具有褐藻酸降解能力的菌株,结果见图1a。由图1a可知,大多数菌株可以产生透明圈,透明圈的大小可以初步反应菌株的产酶能力。挑取有明显透明圈的菌株接种于复筛培养基中,测定酶活活性,结果见图1b。由图1b可知,编号为EE258、EE2510和EE2519菌株的酶活较高,相对酶活分别为100%、87.63%和83.87%。通过初筛及复筛,选取能在平板上形成显著透明圈和酶活最高的菌株EE258,进行后续研究。

图1 初筛和复筛结果Fig.1 Results of primary and secondary screening
2.2菌株EE258菌落及个体形态特征
对复筛菌株EE258进行革兰氏染色,在显微镜下观察其个体形态,结果见图2。菌株EE258在固体培养基上的菌落呈圆形,乳白色,无光泽,表面扁平,边缘粗糙。由图2可知,菌株EE258呈杆状,为革兰氏阴性菌。

图2 菌株EE258个体形态Fig.2 Morphology of strain EE258
2.3菌株EE258生理生化特征
EE258不能在厌氧条件下生长,为好氧菌,能在4~35℃生长。菌株EE258能在pH7.0~10.0的条件下生长,最适pH值为7.5。NaCl不是菌株EE258生长必需的物质,耐受NaCl的盐度为0~12%,最适NaCl的浓度为7%。过氧化氢酶和氧化酶反应为阳性,可以利用棉子糖、D-葡萄糖、乳糖、蔗糖、阿拉伯糖和鼠李糖等作为碳源,而不能利用其它碳源。根据形态特征和生理生化特征,初步将菌株EE258鉴定为交替假单胞菌属的细菌。
2.4菌株EE258的分子生物学鉴定
通过提取细菌基因组、设计16S rDNA通用引物、PCR扩增,PCR产物利用琼脂糖凝胶电泳检测(见图3)。由图3可知,在1 000~2 000 bp之间形成一条亮带,说明PCR产物纯度很高。

图3 PCR扩增产物电泳图Fig.3 Elec trophoresis of strain EE258 PCR amp lification products
菌株EE258的16S rDNA序列长度为1 410 bp,将序列(GenBank登录号:KT807786)与GenBank数据库中已知的基因序列进行同源性比较,发现菌株与多株交替假单胞菌属细菌的16S rDNA基因序列同源性高达99%。由分类地位的系统发育树(见图4)可知,菌株EE258与Pseudoal-teromonas arctica NSP519的亲缘关系最相近,由此可鉴定该菌为交替假单胞菌属(Pseudoalteromonas sp.),命名为Pseudoalteromonas sp.EE258。

图4 菌株EE258基于16S rDNA序列同源性构建的系统发育树Fig.4 Phylogenetic tree of strain EE258 based on 16S rDNA sequence homology
2.5褐藻酸裂解酶的分离纯化
褐藻酸裂解酶粗酶液经过硫酸铵分级盐析、DEAE-sepharose Fast Flow离子交换层析及Sephacryl S-100凝胶过滤,一系列的纯化操作,分离纯化结果见表1。由表1可知,经过纯化后,褐藻酸裂解酶的比活力由48.26 U/mg提升至384.12 U/mg,纯化倍数约7.96,回收率为20.22%。SDS-PAGE凝胶电泳(见图5)显示纯化后的褐藻酸裂解酶为一条带,分子质量大小约为23 ku,命名为A ly-EE258。

表1 Pseudoalterom onas sp.EE258产褐藻酸裂解酶的纯化结果Table 1 Purification results of alginate lyase from Pseudoa lterom onas sp.EE258
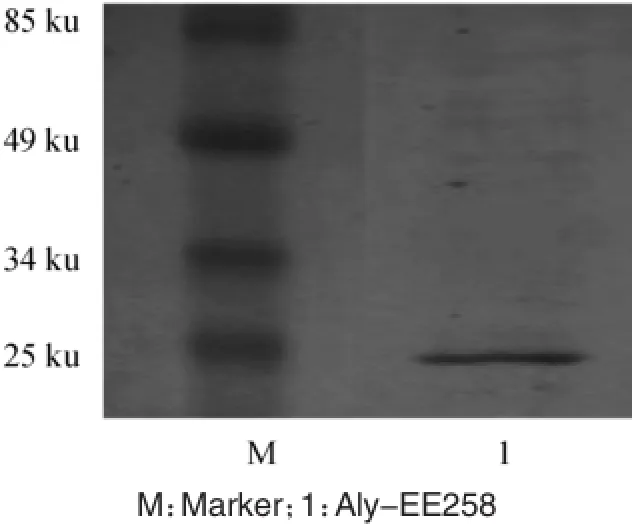
图5 褐藻酸裂解酶的SDS-PAGE凝胶电泳图Fig.5 Gel electrophoresis o f alginate lyase analysis by SDS-PAGE
2.6A ly-EE258的酶学性质分析
2.6.1Aly-EE258酶反应最适温度和热稳定性
纯化后的酶与褐藻酸溶液混合,在不同温度下(5~65℃)反应,以最高酶活为100%测定相对酶活,结果见图6。结果表明,该酶的最适作用温度为40℃,当温度>60℃时,几乎没有酶活。

图6 温度对Aly-EE258酶活的影响Fig.6 Effect of tem perature on the enzyme activity of Aly-EE258
将A ly-EE258酶液于5℃、20℃、30℃、40℃、50℃保温一定时间,并分别于0.5 h、1.0 h、1.5 h和2.0 h后取样测量剩余酶活力,计算相对酶活力,结果见图7。由图7可知,酶液在5~20℃下保温,酶活损失较少,2.0 h后剩余酶活在70%以上;即使在较高温度下,仍可保持较高的酶活(50℃条件下酶保温2.0 h,酶活力约为42%)。在低于20℃范围内,酶稳定性较好。

图7 Aly-EE258酶的热稳定性Fig.7 Thermostability of Aly-EE258
2.6.2Aly-EE258酶反应最适pH

图8 pH值对Aly-EE258酶活的影响Fig.8 Effect of pH on the enzyme activity of Aly-EE258
将酶液与不同pH的缓冲溶液混合,溶液的pH范围为5.0~10.0,以最高酶活为100%,测定酶活力,结果如图8所示。由图8可知,酶反应的最适pH值为7.0,在pH 6.5~7.5酶活力都较高,与文献报道的褐藻酸裂解酶的最适pH值6.0~8.0一致[15]。
2.6.3金属离子对Aly-EE258酶活性的影响
在酶与底物的反应体系中,加入不同的金属离子,使其终浓度为10 mmol/L,以不加金属离子酶液的酶活为100%,得到相对酶活结果见图9。由图9可知,多种金属离子对Aly-EE258酶的活性都有较大的影响,其中,Ca2+、Ba2+对酶有明显的激活作用,以Ca2+的激活能力最好;金属离子Fe2+、A l3+、M g2+会抑制Aly-EE258酶的活性;金属离子螯合剂EDTA可以强烈抑制纯化的A ly-EE258酶活性,表明该纯化酶是一种金属蛋白酶。

图9 金属离子对Aly-EE258酶活的影响Fig.9 Effect of me tal ions on the enzym e activity of Aly-EE258
2.6.4NaCl浓度对A ly-EE258酶活性的影响
将纯酶液置于不同浓度的NaCl溶液中,以在无NaCl条件下的酶活为对照,测定酶活力,结果见图10。由图10可知,该纯化酶在NaCl加入后酶活力有较大程度的提高,其最适的NaCl浓度为0.4 mol/L,在此条件下Aly-EE258酶活性提高了39.5%。且该酶在NaCl浓度<1.2 mol/L的高盐条件下的酶活力均高于无NaCl条件的酶活。以上结果表明Aly-EE258酶具有较强的耐盐性,在盐浓度变化较大的环境下仍然保持较高的酶活。

图10 NaC l浓度对Aly-EE258酶活的影响Fig.10 Effect of NaCl concentration on the enzyme activity of Aly-EE258
2.6.5底物特异性和产物分析
薄层层析结果(见图11)表明,褐藻酸钠、PolyM和PolyG酶解后产生不同聚合度的褐藻酸寡糖,然而都没有单糖生成,说明Aly-EE258为内切型褐藻酸裂解酶。其中PolyM的酶解产物主要为单一寡糖,在寡糖分离纯化技术上可以节约大量的成本。
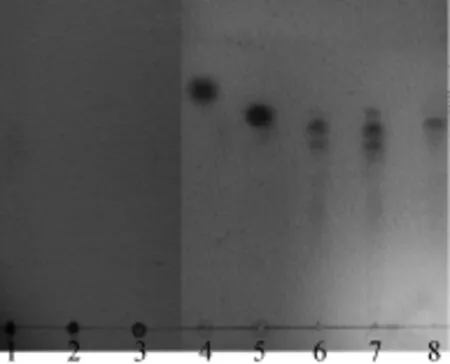
图11 褐藻酸钠、PolyM和PolyG酶解产物的薄层层析Fig.11 TLC analysis of enzymatic hydrolysate of alginate,PolyM and PolyG
3 结论
本研究从腐烂的海带中分离出一株高产褐藻酸裂解酶菌株,经形态学、生理生化特征和分子水平鉴定,该菌为交替假单胞菌属,命名为Pseudoalteromonas sp.EE258。褐藻酸裂解酶Aly-EE258的最适反应温度为40℃,最适反应pH为7.0,在20℃以下时酶的稳定性较高,Ca2+、Ba2+对酶有明显的激活作用,Fe2+、Al3+、Mg2+会抑制酶的活性。褐藻酸钠、PolyM和PolyG均能被A ly-EE258裂解成低聚寡糖,PolyM经裂解主要产生单一寡糖。综上所述,褐藻酸裂解酶Aly-EE258有良好的开发和应用前景。
[1]HAUGA,LARSEN B R,SM IDSRODO.Studieson the sequence of uronic acid residues in alginic acid[J].Acta Chem Scand,1967,21:691-704.
[2]肖影.褐藻胶寡糖生物活性的研究进展[J].科技创新与应用,2014(18):17-17.
[3]FALKEBORG M,CHEONG L Z,GIANFICO C,et al.A lginate oligosaccharides:Enzymatic preparation and antioxidant property evaluation[J]. Food Chem,2014,164:185-194.
[4]GACESA P.Alginate-modifying enzymes[J].Febs Lett,1987,212(2):199-202.
[5]李丽妍,管华诗,江晓路,等.海藻工具酶——褐藻胶裂解酶研究进展[J].生物工程学报,2011,27(6):838-845.
[6]ZHU B,YIN H.Alginate lyase:Review of major sources and classification,properties,structure-function analysis and applications[J].Bioengineered,2015:125-131.
[7]GAUTHIER G,GAUTHIER M R.Phylogenetic analysis of the genera Alteromonas,Shewanella,and Moritella using genes coding for smallsubunit rRNA sequences and division of the genus Alteromonas into twogenera,Alteromonas(emended)and Pseudoalteromonas gen.nov.,and proposal of twelve new species combinations[J].In t J Syst Bacteriol,1995,45(4):755-761.
[8]游银伟,汪天虹.适冷海洋细菌交替假单胞菌(Pseudoalteromonas sp.)MB-1内切葡聚糖酶基因的克隆和表达[J].微生物学报,2005,45(1):142-144.
[9]朱妍妍,牟光庆,靳艳,等.交替假单胞菌H7产甲壳素酶发酵条件的研究[J].食品工业科技,2007,28(1):124-126.
[10]吕明生,王淑军,房耀维,等.交替假单胞菌LP621菌株产右旋糖苷酶的培养条件优化[J].微生物学杂志,2010,30(6):11-17.
[11]PREISS J,ASHWELL G.Alginic acid metabolism in bacteria.I.Enzymatic formation of unsaturated oligosac-charides and 4-deoxy-L-erythro-5-hexoseulose uronic acid[J].J Biological Chem,1962,237(2):309-316.
[12]范明.蛋白质技术手册[M].北京:中国科学出版社,1999.
[13]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14]TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].M ol Biol Evol,2011,28(10):2731-2739.
[15]蔡俊鹏,程璐.褐藻胶裂解酶及其裂解产物的研究进展[J].食品研究与开发,2006,37(11):219-222.
Screening of a high-yield alginate lyase producing strain and its enzymatic properties
CHEN Hongji,JIANG Guoliang*,YAN Guangsi
(College of Marine Life Sciences,Ocean University of China,Qingdao 266003,China)
A high-yield alginate lyase(A ly)producing strain was screened from rotten kelp.According to morphological analysis,physiological and biochemical characteristics and molecular identification,the strain was identified as Pseudoalteromonas sp.EE258.The A ly-EE258 from Pseudoalterom onas sp.EE258 was separated and purified by ammonium sulfate precipitation,DEAE-sepharose Fast Flow and Sephacryl S-100 column chromatography.The molecular mass of the purified enzyme was about 23 ku by sodium dodecyl sulfate polyacrylam ide gel electrophoresis(SDS-PAGE). The enzymology properties study showed that the optimum reaction temperature and pH of the enzyme was 40℃and 7.0,respectively.The enzyme had good stability at below 20℃.The enzyme activity was significantly promoted by Ca2+and Ba2+,but inhibited by Fe2+,A l3+,Mg2+and EDTA.The A ly-EE258 could degrade alginate,poly gulonic hyaluronic acid(PolyG)and ploymannuronic acid(PolyM)inordinately.PolyM could be mainly degraded into single oligosaccharide,which had great significance in practical application.
Pseudoalterom onas sp.;alginate lyase;enzymatic properties
S968.42
0254-5071(2016)05-0025-06
10.11882/j.issn.0254-5071.2016.05.006
2016-01-31
国家自然科学基金(No.31101876);山东省自然科学基金(No.20102RE29047)
陈洪基(1989-),男,硕士研究生,研究方向为资源生态学。
姜国良(1963-),男,教授,本科,研究方向为海洋生物材料与活性物质方面的研究。
