茎点霉真菌Phoma adianticola引起的一种茶树新病害
2016-09-18杨文陈瑶陈小均姚雍静周玉锋
杨文,陈瑶,陈小均,姚雍静,周玉锋
茎点霉真菌引起的一种茶树新病害
杨文1,陈瑶1,陈小均2,姚雍静1,周玉锋1*
1. 贵州省农业科学院茶叶研究所,贵州 贵阳 550006;2. 贵州省农业科学院植物保护研究所,贵州 贵阳 550006
对一种引起茶树芽头褐变的病原进行了分离鉴定研究。通过柯赫氏法则,成功分离得到了致病菌株。菌株PDA培养条件下的形态学和rDNA-ITS分子鉴定结果表明,此病原菌为茎点霉属真菌。按照茎点霉属真菌鉴定程序开展了鉴定研究。此菌在OA和MA培养基上培养7 d后,菌落平均直径6.0~6.4 cm;分生孢子器圆球形,具孔口,器外壁光滑或有菌丝附着;分生孢子橄榄球形,无隔,多数具2个游球,大小为4.9~6.3 μm×2.1~2.8 μm;NaOH颜色反应呈黄绿色。根据上述特征,初步鉴定此病原菌为。由引起的茶树芽头褐变可能是茶树的一种新病害。根据此菌侵染后的症状,暂将其表述为茶树褐芽病。
茎点霉;;茶树
近年来,在贵州省湄潭及其周边茶区大面积发生一种主要为害茶树夏秋季幼嫩芽叶的病害。此病最初在未展开芽头基部出现褐色病斑,叶片展开后,叶茎交界处病斑扩大,病斑颜色加深,叶片易脱落,同时又于新的芽头基部出现褐色病斑;发生严重的茶树枝条后期会钝缩,以致新芽出芽率低或为畸形芽,明显降低夏秋茶鲜叶下树率;感病芽叶采摘后2 h内整芽变黑,严重影响茶鲜叶品质,导致茶农减产减收。此病害的田间发病症状明显区别于现有文献资料所记载的茶树幼嫩芽叶病害,因而不能对症制定科学的防治方法。基于上述背景,本研究开展了该病害病原菌的分离与鉴定研究,为制定其预防和控制措施提供理论依据和指导。
1 材料与方法
1.1 田间调查与病叶采集
2013年6月至10月和2014年6月至10月,连续两年对湄潭茶区发病茶树进行田间调查(每40 d调查1次),观察病症、记载和拍照;并采集典型发病芽头用于病原分离。
1.2 病原菌分离培养与单孢纯化
采用常规组织分离法[1],取发病茶树芽头病健交界处5 mm的组织,用75%的酒精表面消毒1 min,然后用无菌水冲洗3遍,用灭菌滤纸吸干表面的水分,贴于PDA培养基,25℃恒温光照培养。菌落形成后及时从菌落边缘挑取菌丝转接到新的PDA培养基上培养,至菌落中有大量黑色小点即分生孢子器产生。用接种针挑取新鲜的单个分生孢子器置于无菌水滴中,轻轻将分生孢子器辗压,使分生孢子从中溢出,分布于无菌水中。然后逐步稀释并镜检,直至100倍显微镜观察的1个视野中仅镜检到1~2个分生孢子。最后蘸取最终稀释倍数的分生孢子悬浮液,均匀涂抹在PDA培养基上,培养至单菌落产生,然后用接种针挑取菌丝,移至试管中PDA斜面培养3 d后,置于4℃冰箱内存放备用。
1.3 病原菌回接与再分离
1.3.1 菌丝块接种
水培茶树枝条接种,接种20个枝条,在每个枝条芽头基部接种1块菌丝块。取601茶树品种的健康枝条,长10 cm,经75%酒精表面消毒并用无菌水冲洗干净,插入含pH值为6.5的霍兰氏营养液的三角瓶中。取直径5 mm菌饼接种于茶枝芽头基部,接种后将三角瓶移入经75%酒精消毒的15 cm高的塑料桶中,塑料桶中加入50 mL无菌水,用保鲜膜覆盖桶口,置于25℃条件下培养,接种1 d后移去菌丝块,以无菌PDA块接种的叶片作对照,移去菌丝块后观察叶片发病情况,统计发病率。
1.3.2 分生孢子悬浮液接种
为进一步证实病原菌的致病性,采用1.3.1中水培茶树枝条接种程序,进行分生孢子悬浮液接种。釆用微型喷雾器,将1.2制好的分生孢子悬浮液均匀喷洒于整个茶树枝条表面,共接种20个枝条,以喷洒无菌水的茶树枝条作对照,在1.3.1相同条件下培养。接种后观察发病情况。
1.3.3 病原菌的再分离
分别对菌丝块、孢子悬浮液接种后的发病芽头按1.2的组织分离法进行病原菌再分离,确认前后两次组织分离法分离所得病原菌在菌丝和孢子形态上是否一致,从而完成柯赫氏法则验证。
1.4 病原菌的鉴定
1.4.1 病原菌的形态学鉴定
根据Gruyter等[2]和《Identification Manual》[3]一书中的方法,将分离到的菌株接至OA和MA培养基上,置于25℃条件下培养7 d后观察培养基上的菌落形态特征,光学显微镜下观察菌丝、分生孢子器和孢子形态。
1.4.2 NaOH颜色反应
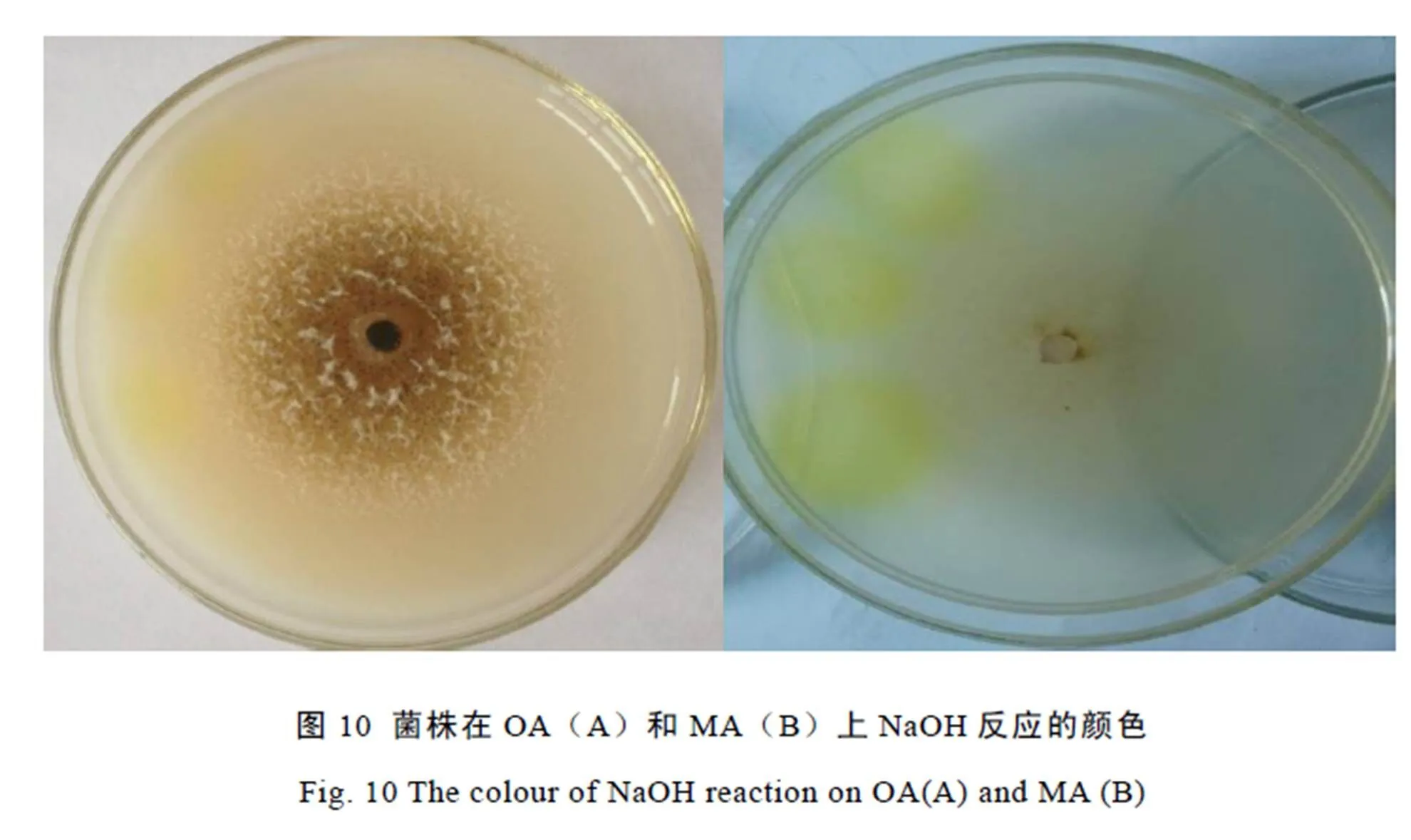
根据Gruyter等[2]和《Identification Manual》[3]一书中的方法,将供试菌株接种至新鲜的OA和MA平板中央,25℃条件下培养7 d后,在菌落边缘滴加10 mol·L-1的NaOH溶液,处理后10 min观察颜色变化情况,直至培养基颜色不变化为止。
1.4.3 病原菌rDNA-ITS分子鉴定
(1)基因组DNA提取
提取病原菌基因组DNA,釆用Ezup柱式真菌基因组DNA抽提试剂盒(购自上海生工)操作。取50 mg新鲜菌丝用于DNA提取,其实验过程参照Ezup柱式真菌基因组DNA抽提试剂盒操作说明书的程序。
(2)rDNA-ITS扩增
采用真菌ITS通用引物ITS1和ITS4进行扩增。PCR反应体系为25 μL,各组分如下:模板DNA(20~50 ng·μL-1)0.5 μL,10PCR Buffer 2.5 μL,dNTP(10 mmol·L-1)1 μL,引物ITS1和ITS4(10 μmol·L-1)各0.5 μL,DNA聚合酶(5U·μL-1)0.2 μL,ddH2O 19.8 L,所用材料均购自生物工程(股份)有限公司。PCR扩增在PTC-200型扩增仪上完成,程序为94℃预变性4 min,然后94℃ 45 s,55℃退火45 s,72℃延伸1 min,30次循环,72℃延伸10 min,4℃保存。反应结束后取5 μL扩增产物,进行1%琼脂糖凝胶电泳检测,于凝胶成像系统(Bio-Rad公司)观察、照相、保存。在紫外灯下从凝胶中切取目的条带,经SanPrep柱式DNA胶回收试剂盒纯化,送上海生工生物工程技术服务有限公司进行基因测序。
获得基因序列后,将菌株的rDNA-ITS序列与GenBank数据库中已知序列进行序列比对并进行同源性分析,结合病原菌的形态学观察,最终确定病原菌的种类。
2 结果与分析
2.1 田间观察病害症状表现
通过在贵州湄潭对此病进行两年的田间调查,结果表明,此病于每年6月初开始发生,8月中下旬大面积发生,主要危害茶树芽头。此病最初在未展开芽头基部出现褐色病斑,叶片展开后,叶茎交界处病斑扩大,颜色加深,叶片易脱落,同时又于新的芽头基部出现褐色病斑(图1);发生严重的茶树枝条后期钝缩,新芽出芽率不高或为畸形芽,以致茶鲜叶绝收,明显降低夏秋茶鲜叶的下树率;感病芽叶采摘后2 h内整芽褐变,使其无法出售加工。

2.2 病原菌分离培养与纯化
选择症状典型的发病芽头,釆用组织分离法分离得到病原菌后,通过显微观察进行形态鉴定。2013和2014年2年共6次分离结果表明(表1),茎点霉属真菌分离比例最高,分离率均超过46%,且每次分离的茎点霉属真菌在菌落、显微观察的菌丝和孢子形态均相同;也分离到了部分炭疽病菌,其分离率均不超过19%;其他不产孢且未鉴定的真菌分离率均不超过45%。
2.3 病原菌回接与再分离
通过对上述2年6次分离到的菌株分别进行菌丝块接种,测定致病性。结果表明,所分离菌均可致病,但只有茎点霉菌株回接后的发病症状与田间调查时发病症状相似(图2)。茎点霉菌株菌丝块接种3 d后均可发病,发病率为100%。孢子悬浮液接种结果表明,接种茎点霉菌株5 d后开始发病,且只有幼嫩芽头感病,先从芽头基部出现症状,展开的叶片易脱落,其发病情况和田间症状一致(图3)。对以菌丝块和孢子悬浮液接种发病叶片进行病原再分离,所得菌株培养性状和形态特征均与接种的菌株相同。基于2年6次的菌丝块和孢子悬浮液接种结果,确定分离到的茎点霉菌株为病原菌。


2.4 病原菌的鉴定
2.4.1 形态学观察
(1)菌落特征
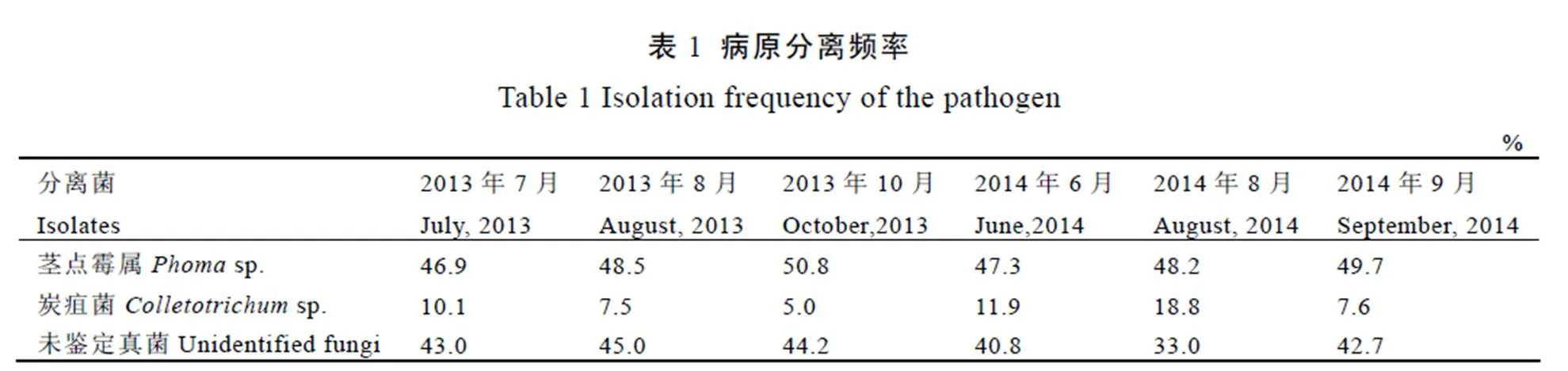
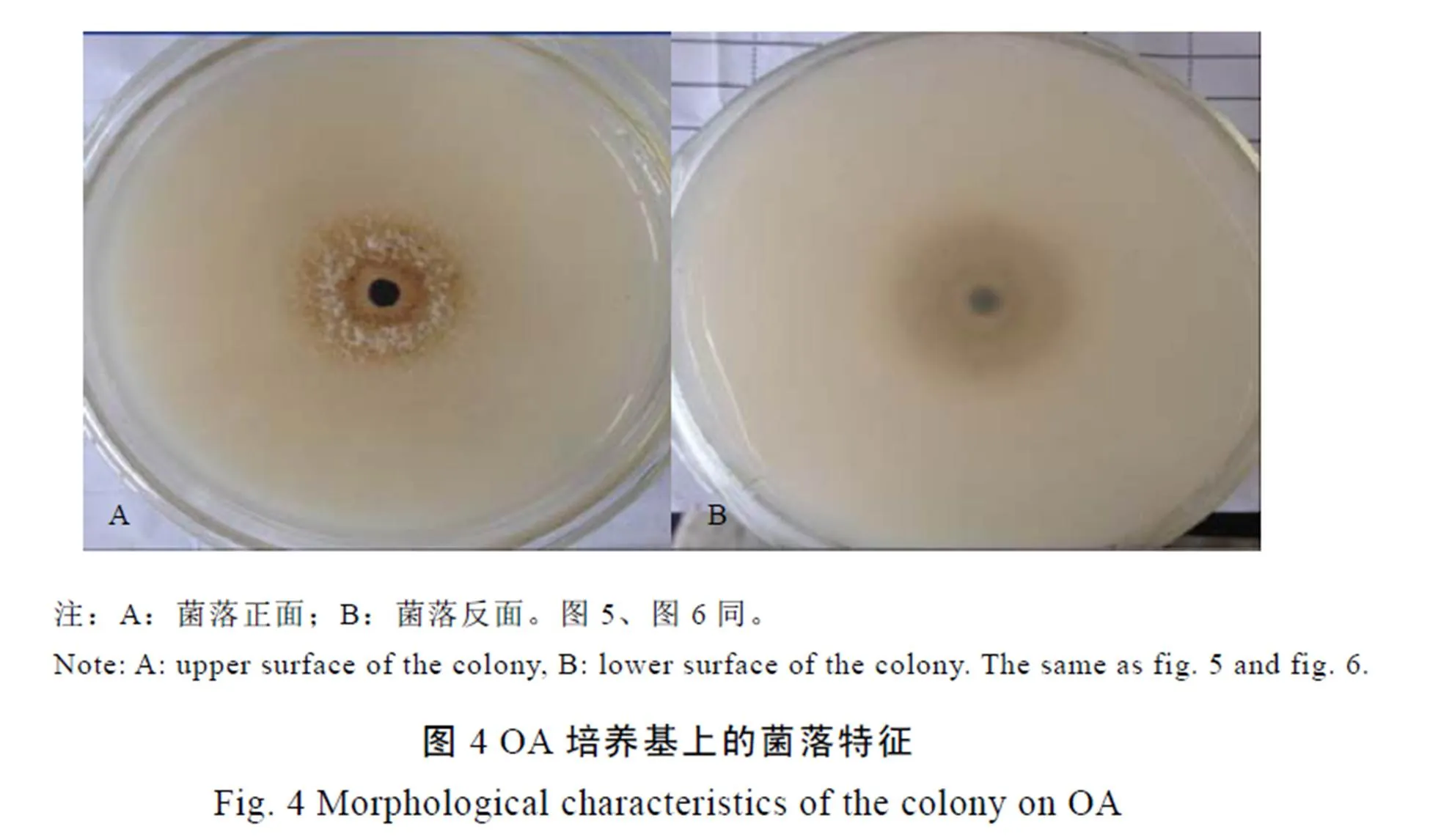
在OA培养基上,3 d以前菌丝为白色;第4天可见菌落中央变褐色且菌落表面可见黑色小点,即分生孢子器;培养7 d后,菌丝稀薄,菌落边缘白色,中央褐色,中央白色气生菌丝绒毡状,菌落直径6.2~6.4 cm(图4)。在MA培养基上培养7 d后,菌丝稀薄,菌落白色,中央浅褐色,菌落直径为6.0~6.4 cm(图5)。在PDA培养基上,3 d以前菌丝为白色,第4天可见菌落中央变褐色,培养7 d后,菌丝稀薄,菌落边缘白色,中央褐色,可见少量黑色小点,即分生孢子器,菌落直径6.2~6.5 cm(图6)。
(2)显微观察结果
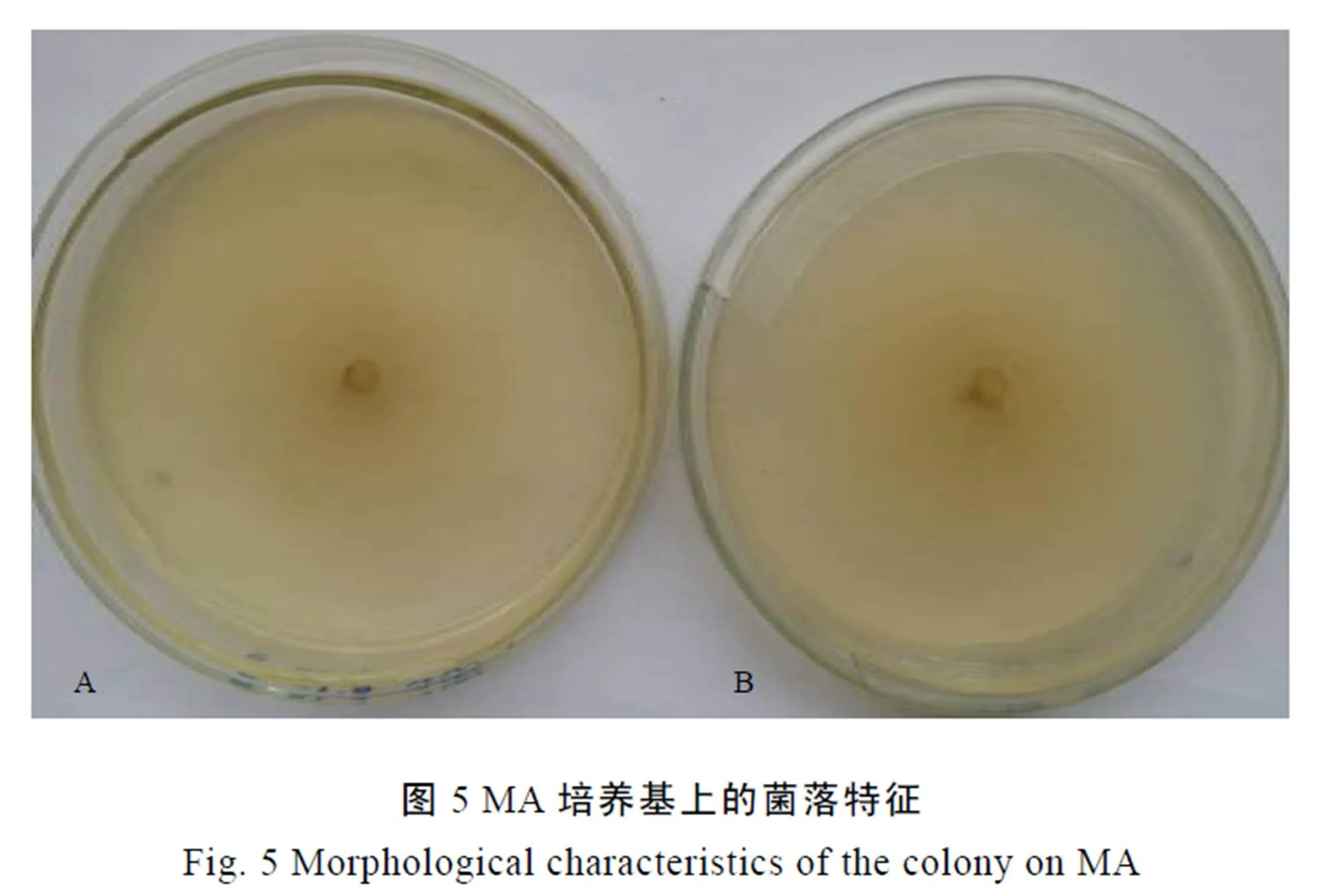
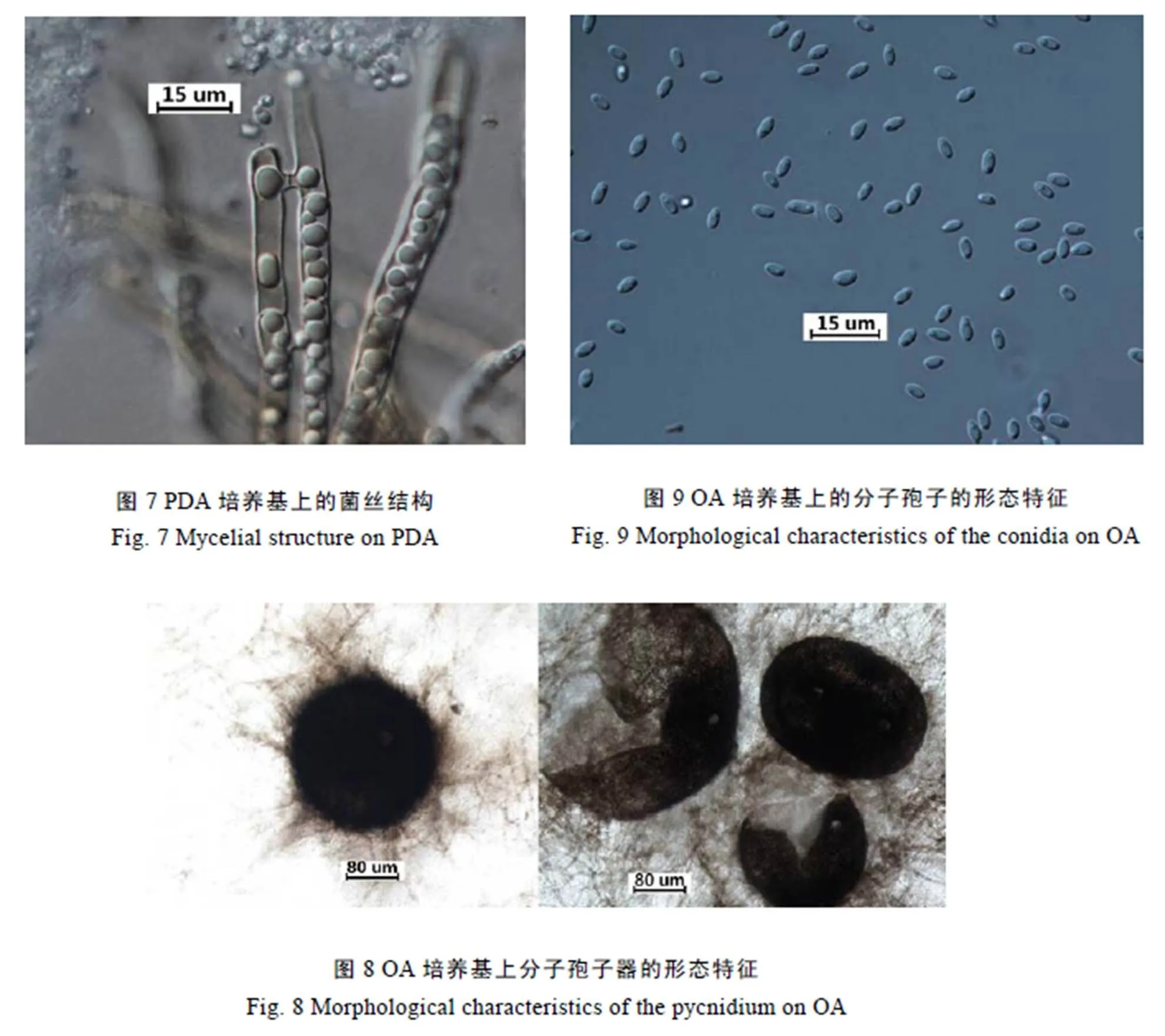
显微观察发现,菌丝分隔,具桥接现象,内具多个圆球形内含物(图7)。分生孢子器圆球形,具1~2个孔口,器外壁光滑或有菌丝附着,内生分生孢子(图8)。分生孢子为橄榄球形,无隔,多数具2个游球,分生孢子大小为 (4.9~6.3) μm×(2.1~2.8) μm(图9)。

2.4.2 NaOH反应
菌株在OA和MA培养基上生长7 d后,10 mol·L-1的NaOH溶液处理10 min后,培养基颜色均变为黄绿色,1 h后观察,仍为黄绿色(图10)。
2.4.3 rDNA-ITS分子鉴定
用通用引物ITS1和ITS4对菌株的rDNA-ITS区域进行PCR扩增,扩增出517 bp的特异性片断,产物测序获得了如图11所示的序列。
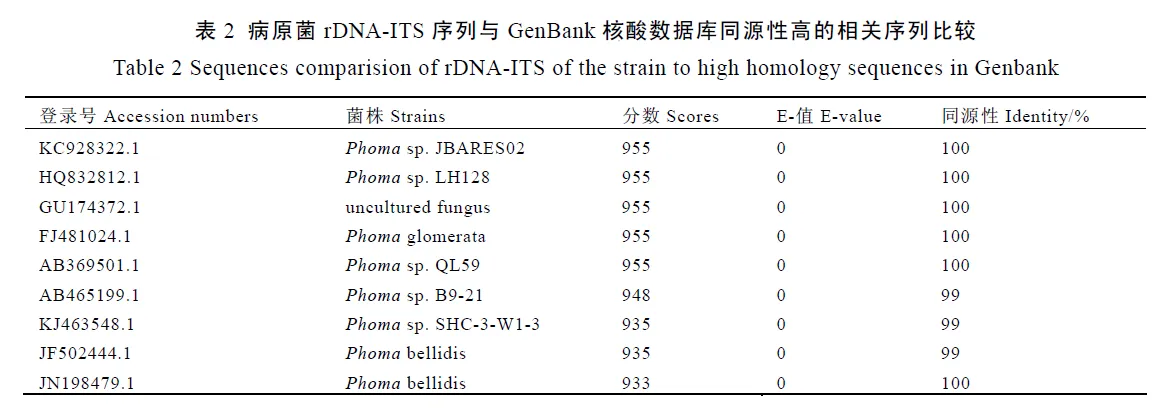
将菌株的rDNA-ITS序列输入GenBank中进行blast同源性比对,结果(表2)表明,在同源性较高的9个菌株中,鉴定到种的仅有2个(3个登录号),分别为glomerata和,根据《Identification Manual》[3]一书中对这两个种相关形态特征的描述,均与供试菌不符合。因而,分子水平的鉴定结果,只能将供试菌株鉴定到茎点霉属这一级,在种级水平上的鉴定还需参照形态学鉴定结果。

3 讨论与结论
本研究对引起贵州湄潭茶叶芽头褐变的一种真菌进行了分离和鉴定,采用柯赫氏法则分离得到了致病菌株,经形态观察和rDNA-ITS分子鉴定,确定其为茎点霉属()。
茎点霉属真菌的种类很多,目前全世界报道的超过2 000种;其中多数为植物病原菌。茎点霉属自Fries创建以来,在其分类和命名方面,Boerema、Gruyter和Noordeloos等人做了大量工作,他们于1992~2003年间,先后在Persoonia和MYCOTAXON两个期刊发表了20篇主题为《Contributions towards a monograph of(coelomycetes)》的论文,系统地将菌落大小与颜色、厚垣孢子形成、晶体、分生孢子器和分生孢子的特点,产孢细胞形态及类型,NaOH颜色反应,以及该菌的寄主植物等作为该属真菌不同种间的分类依据。2004年Boerema等[3]又编写出版了《Identification Manual》一书,该书中详细记录了223个种,并编制了其检索表,该书是目前最为完整和权威的茎点霉属真菌鉴定手册。
按照《Identification Manual》一书中的方法,需先将茎点霉属真菌划分至九大部分中的一个部分,再鉴定到种。根据分离到的菌株在培养基中产生分生孢子器、未发现厚垣孢子、光滑且有明显孔口、分生孢子相对较小且无隔的特征,将病原菌划分至Asect.。
分离到的菌株在OA培养基上培养7 d后,菌落直径6.2~6.4 cm,在OA和MA培养基上NaOH颜色反应呈阳性,均变为黄绿色,且处理1 h后,仍为黄绿色,根据这些特征,在Gruyter 等[2]发表论文的检索表中,其检索结果为。根据分生孢子无隔、其大小为 (4.9~6.3) μm×(2.1~2.8) μm,通常含2个油球,同时结合菌落直径和颜色反应特征,在《Identification Manual》一书的Asect.中检索结果仍为。分子鉴定过程中,在GenBank核酸数据库中,与所测菌株同源性高且鉴定到种的为和,但是可以产生丰富的厚垣孢子链,且具大量气生菌丝,在MA培养基上的NaOH颜色反应是由绿色变为红色,这两个菌的特征均与供试菌不符。在真菌鉴定研究中,形态学鉴定是基础,分子鉴定是重要补充[4],因此,本研究将引起贵州湄潭茶叶芽头褐变的病原菌初步定为。
现有文献记录中,能以茶属植物为寄主的茎点霉属真菌主要有Cooke[5-6]、Pass[7-8]、Hara[5,9]、[10]和[11]。根据陆家云[6]的描述,Cooke主要侵染茶的茎部,它明显区别于本研究病原菌的侵染部位。Pass是芽叶枯病病菌,此病于1970年在我国广东相关茶园首次发现,可危害茶树成叶、弱枝、芽叶和嫩梢,芽叶发病时,多数从叶尖或叶缘开始;此菌PDA上的菌丝为淡红色,明显区别于本研究病原菌[7-8]。Hara是茶心枯病病原菌,此病多发生在茶树嫩叶和成叶上,有时芽梢也受害,在嫩叶上先从叶尖开始出现症状,在成叶上多从叶片的边缘开始出现病斑,嫩芽梢受害时,从芽尖开始,逐渐蔓延至半个芽梢枯死,此病原菌较大的分子孢子[大小为 (7~11) μm×(4~4.5) μm]区别于本研究中的病原菌[9]。Kinsey[10-11]于2002年描述了和两个原病菌的寄主包括茶属植物,但是在OA上的NaOH颜色反应呈阴性[3],而在OA上培养7 d后的直径仅为2.0~2.5 cm[3],两个菌的相关特征也明显区别于本研究中的病原菌。
根据《Identification Manual》一书的描述,是一些蕨类植物病害的病原[3],作为茶属植物病害病原,未见关于的报道。此外,此病原菌的症状表现和相关特征也明显区别于已有报道和记录的以茶属植物为寄主的茎点霉属真菌。基于此,初步认为,由引起茶树芽头褐变的病害可能是茶树的一种新病害。根据此菌侵染后的症状表现,特将此菌引起的茶树芽头病害暂表述为茶树褐芽病。
[1] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 122-142.
[2] Gruyter J DE, Noordeloos M E, Boerema G H. Contributions towards a monograph of(coelomycetes)[J]. Persoonia, 1993, 15: 369-400.
[3] Boerema G H, Gruyter J DE, Noordeloos M E, et al.identification manual: differentiation of specific and infra-specific taxa in culture [M]. Wallingford: CABI Publishing, 2004: 15-170.
[4] 孙广宇, 彭友良, 李振岐, 等. 核苷酸序列分析在真菌系统学研究中的应用[J]. 西北农林科技大学学报: 自然科学版, 2003, 31(6): 187-191.
[5] 陈宗懋, 陈雪芬. 世界茶树病原名录[J]. 茶叶科学, 1989, 9(1): 73-88.
[6] 陆家云. 植物病原真菌学[M]. 北京: 中国农业出版社, 2000: 513.
[7] 刘淑绮, 李同庆. 茶芽叶枯病研究[J]. 植物病理学报, 1986(4): 238.
[8] 刘淑绮. 茶芽叶枯病调查研究[J]. 广东农业科学, 1987(3): 39-40.
[9] 叶正凡. 茶心枯病的发生与防治[J]. 中国茶叶, 1981, 3(1): 30-31.
[10] Kinsey G C.(Descriptions of Fungi and Bacteria) [J]. IMI descriptions of fungi and bacteria, 2002(151): 1502.
[11] Kinsey G C.(Descriptions of Fungi and Bacteria) [J]. IMI descriptions of fungi and bacteria, 2002(151): 1504.
A New Disease of Tea Plant Caused by
YANG Wen1, CHEN Yao1, CHEN Xiaojun2, YAO Yongjing1, ZHOU Yufeng1*
1. Guizhou Tea Research Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550006, China; 2. Guizhou Plant Protection Research Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550006, China
This paper aims to study the pathogen isolation and identification of a kind of disease causing browning on tea buds. The pathogenic strain was obtained according to Koch's Rule. The results of morphological observation of strains and the rDNA ITS molecular identification under the condition of PDA culture showed that the pathogen was a fungus of. The pathogenic strain was further identified in according to the identification procedures of. After 7 days on the OA and MA culture medium, the average diameter of colonies was 6.0-6.4 cm. Pycnidia were globose with 1-2 ostioles, glabrous or with some hyphal outgrowths. Conidia were ellipsoidal, aseptate, usually with two polar guttules, mostly (4.9-6.3) μm× (2.1-2.8) μm in size. The NaOH reaction was positive on OA and MA, the colour became yellow-green. The characteristics described above showed that the pathogen was preliminarily identified as. This disease of tea buds caused bymay be a new disease of tea plant. According to the symptoms of infection, this disease was temporarily described as the buds-browning disease of tea.
phoma,, tea plant
S571.1;Q949.32
A
1000-369X(2016)01-059-09
2015-07-02
2015-08-18
贵州省科学技术基金项目(黔科合J字[2014]2101号)、贵州省农业攻关项目(黔科合NZ字[2012]3022号)。
杨文,男,副研究员,博士,主要从事茶树病虫害及其防控研究。*通讯作者:gzzhouyf@sohu.com
