坎地沙坦酯氨氯地平片有关物质研究
2016-09-18张鹏威苏文琴曾冲张丽海南医学院药学院海南海口5799海口南陆医药科技有限公司海南海口5700
张鹏威苏文琴曾冲张丽(.海南医学院药学院,海南 海口 5799;.海口南陆医药科技有限公司,海南 海口 5700)
坎地沙坦酯氨氯地平片有关物质研究
张鹏威1苏文琴1曾冲2张丽1
(1.海南医学院药学院,海南海口 571199;2.海口南陆医药科技有限公司,海南海口571100)
目的建立测定坎地沙坦酯氨氯地平片有关物质的测定方法。方法:采用Agilent C18(250 mm×4.6 mm,5 μm)色谱柱,以磷酸-三乙胺缓冲液(pH值5.0)为流动相A,乙腈为流动相B,梯度洗脱,检测波长254 nm,流速1.0 mL·min-1。结果:已知杂质和降解的未知杂质与主药分离良好,4批样品检测结果表明,总杂质均<1.0%,单杂均符合质量标准。结论:所订方法专属性强,灵敏度高,重现性好,可以用于检测本产品有关物质。
高效液相色谱法;坎地沙坦酯氨氯地平片;有关物质;降解产物
坎地沙坦酯是由日本武田公司开发,1998年首先在瑞典上市。它是二苯四咪唑类血管紧张素Ⅱ型受体(AT1)拮抗剂。苯磺酸氨氯地平是由美国辉瑞公司研制开发,1992年首次上市,为长效二氢吡啶类钙离子拮抗剂。坎地沙坦酯和苯磺酸氨氯地平两者均呈良好的抗高血压效果,而两者联合用药因不同作用机制,作用于不同位点,合用具有良好的协同效应,显示比两药单用可产生更好的降血压作用,并不增加不良反应发生率。对单药不易控制的高血压病患者,选择联合用药能提高患者的血压控制达标率,并有良好的安全性、依从性[1]。因此,日本武田公司开发了坎地沙坦酯氨氯地平片,并于2010年在日本首次上市。
对于坎地沙坦酯氨氯地平片有关物质目前已经有少量报道[2-3],但依据最新的注册标准,其研究均无法达到药品注册要求。因此本文参照坎地沙坦酯和苯磺酸氨氯地平在JP16、BP2013、USP35、EP7.8中相关标准,对本复方制剂的有关物质进行了研究并建立了测定方法[4-6]。
1 仪器与材料
安捷伦高效液相色谱仪(LC-2010)。
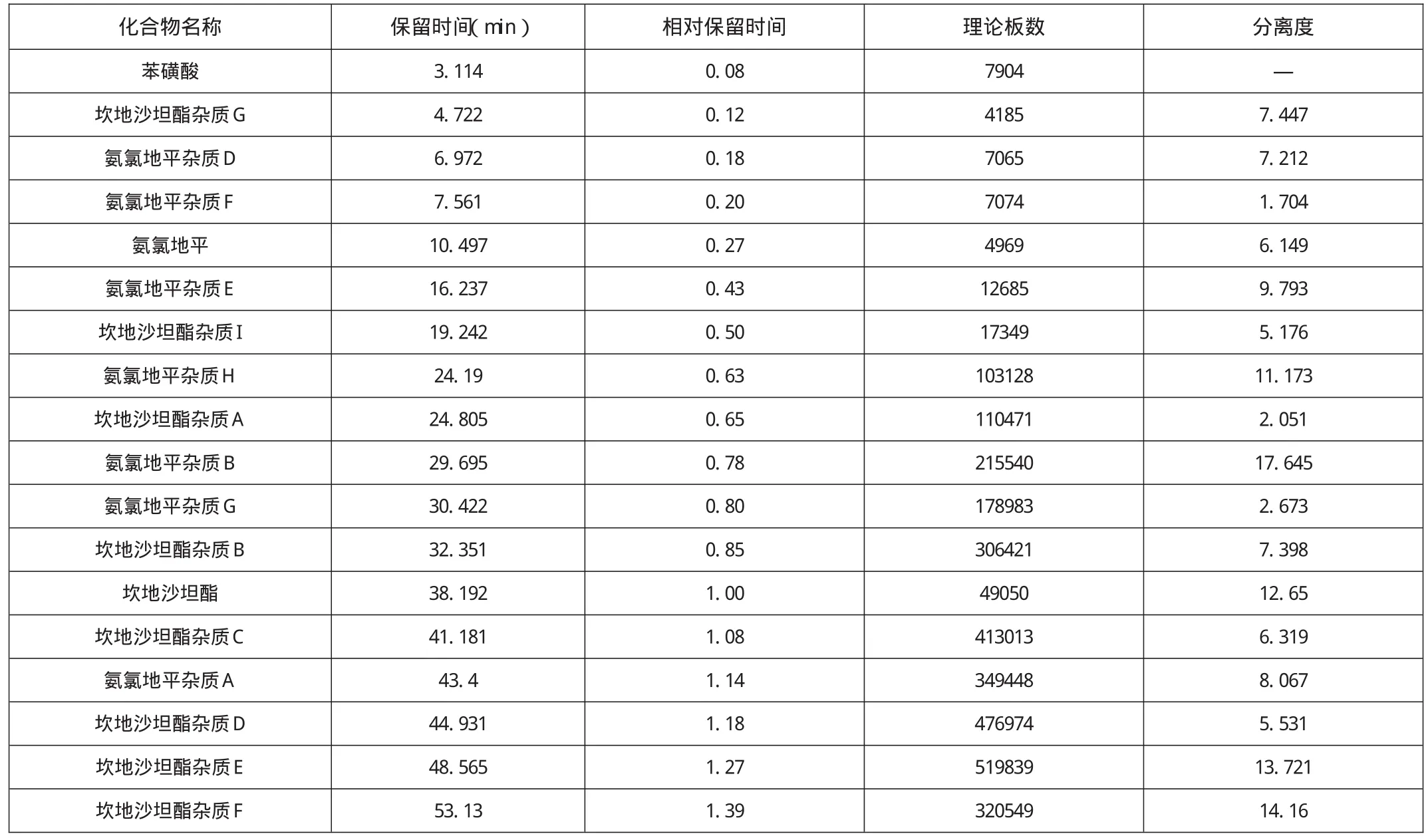
表1 分离度试验结果
坎地沙坦酯(中国食品药品检定研究院,批号:100685-200401,含量:100.0%);苯磺酸氨氯地平(中国药品生物制品检定所,批号:100374-200903,含量:99.9%);坎地沙坦酯氨氯地平片(由海口南陆医药科技有限公司提供);坎地沙坦酯杂质A,B,C,D,E,F均来自加拿大TorontoResearch Chemicals Inc;氨氯地平杂质来自加拿大Molcan Corporation;甲醇、乙腈(TEDIA,色谱纯);超纯水(实验室自制)。
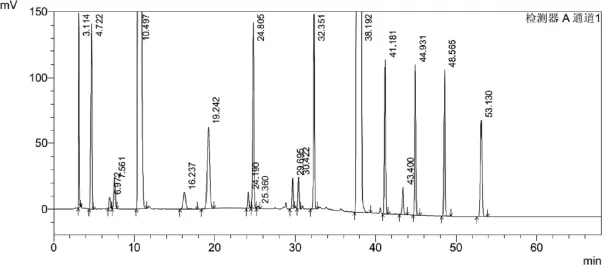
图1 已知杂质分离图谱
2 试验方法与结果
2.1溶液的制备
取本品细粉适量,精密称定,加入乙腈-水(3:2)适量,超声溶解5分钟,并定量稀释制成每1ml中含坎地沙坦酯1.5mg的溶液,滤过,取续滤液作为供试品溶液;精密量取1 ml至100 ml量瓶中,加乙腈-水(3:2)稀释至刻度,摇匀,作为对照溶液。分别取坎地沙坦酯、坎地沙坦酯杂质A、坎地沙坦酯杂质B、坎地沙坦酯杂质C、坎地沙坦酯杂质D、坎地沙坦酯杂质E、坎地沙坦酯杂质F、坎地沙坦酯杂质G、坎地沙坦酯杂质I、苯磺酸氨氯地平、氨氯地平杂质A、氨氯地平杂质B、氨氯地平杂质D、氨氯地平杂质E、氨氯地平杂质F、氨氯地平杂质G、氨氯地平杂质H加乙腈-水(3:2)溶解并定量稀释制成坎地沙坦酯和坎地沙坦酯杂质约含450ug/mL及氨氯地平和氨氯地平杂质约含140 ug/ml溶液,摇匀,作为各杂质对照品储备液。再分别取以上各对照品储备液适量,分别配置成约含坎地沙坦酯和坎地沙坦酯杂质18ug/ml及氨氯地平和氨氯地平杂质约含5.6ug/ml的溶液,作为各组分定性溶液及其混合溶液。
2.2色谱条件
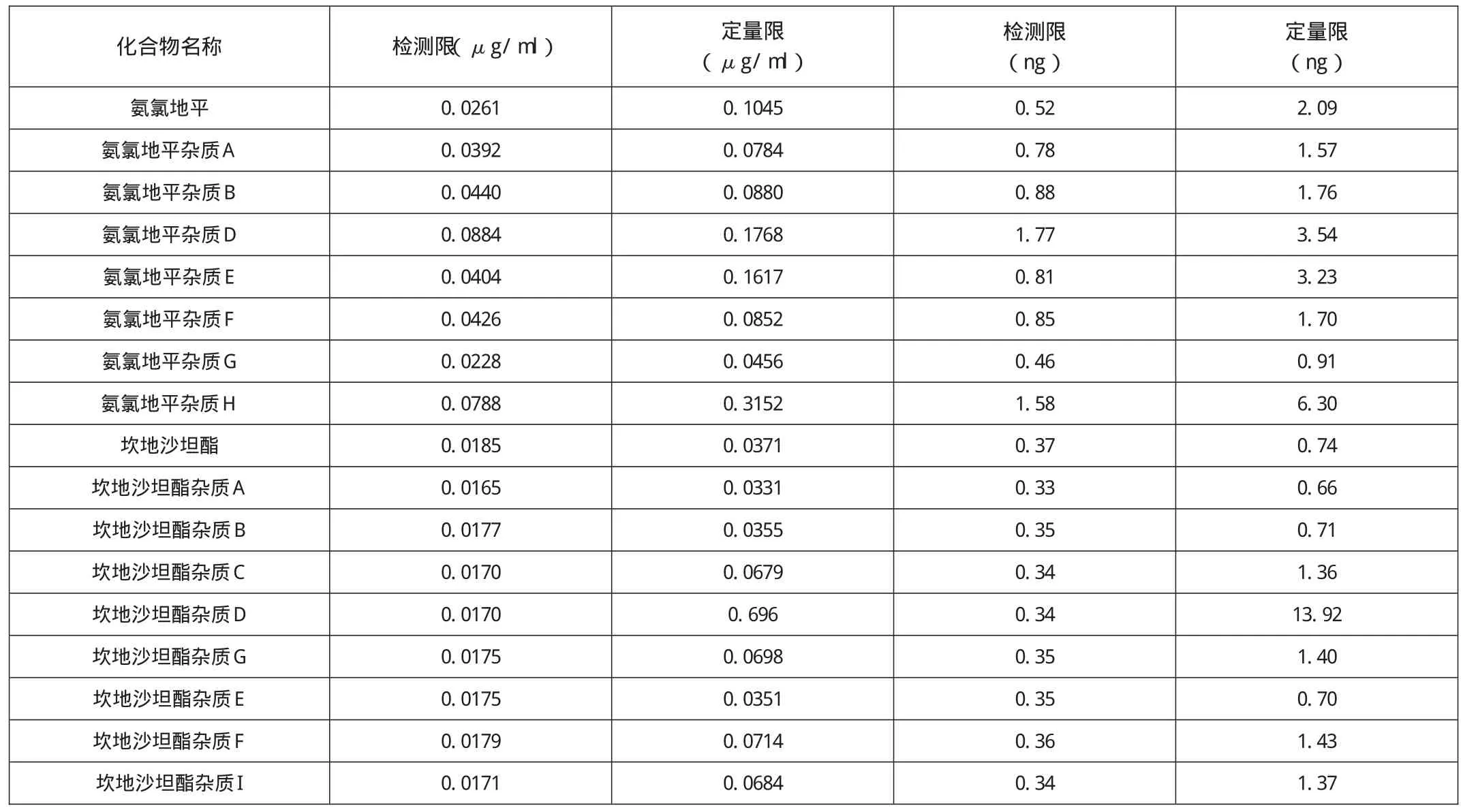
表2 检测限定量限试验结果
色谱柱:Agilent C18(4.6 mm×250mm,5μm),流动相:以磷酸-三乙胺缓冲液(取三乙胺4 ml,加水1000 ml溶解,用磷酸调节pH值至5.0)为流动相A,以乙腈为流动相B,线性梯度洗脱程序为:0 min(65%A)→15 min(65%A)→45 min(20%A)→68 min (20%A)→72 min(65%A)→90 min(65%A),流速:1.0 mL·min-1,柱温35℃,检测波长:254nm,进样体积:20 μL。
2.3波长选择
在EP7.3、USP36、BP2012及JP16中坎地沙坦酯的有关物质检测波长为254,而在JP16中,苯磺酸氨氯地平的有关物质检测波长为237。通过主药及其已知杂质对照品的紫外光谱扫描试验,坎地沙坦酯及其已知杂质在254nm波长处有较大吸收,氨氯地平及其降解杂质峰在254nm波长处有较大吸收,且峰型良好;而在237nm处,坎地沙坦酯峰型对称性欠佳,故将本品有关物质检查检测波长确定为254nm。
2.4专属性试验
2.4.1已知杂质分离度
分别取各组分定性溶液和混合杂质溶液20 μl,注入HPLC测定。从试验色谱图可知主峰与各杂质分离均符合要求,结果见表1及图1。
(1)有关物质检测限与定量限
精密量取各组分定性溶液,逐步对倍稀释,分别精密量取上述溶液份20 μl注入HPLC测定,直至样品色谱峰低至噪音水平。结果见表2。
(2)线性关系试验
取杂质对照品储备液适量,加乙腈-水(3:2)稀释制成一定浓度的溶液。分别精密量取上述溶液20 μl注入HPLC测定。以样品色谱峰面积A与浓度c进行线性回归。试验结果见表3。
(3)破坏试验

表3 线性试验结果
取坎地沙坦酯氨氯地平片粉末(约含坎地沙坦酯30mg),置20ml量瓶中,分别加1 mol/L盐酸溶液1 ml、1 mol/L氢氧化钠溶液1 ml、3%的过氧化氢溶液1 ml、强光照射、沸水浴加热破坏,中和后,加乙腈-水(3:2)稀释至刻度,摇匀,滤过,作为破坏溶液。对坎地沙坦酯原料药、苯磺酸氨氯地平原料药、坎地沙坦酯和苯磺酸氨氯地平混合原料以及混合空白辅料进行同法破坏。
试验结果表明,本品在强光破坏试验条件下无明显变化,在氧化破坏、高温破坏、强酸破坏、强碱破坏条件下有关物质均有所增加。在上述破坏试验中,两个主峰纯度在各破坏条件下,纯度因子均达到995以上,其主峰与降解产物的色谱峰均能分离,分离度均符合要求。结果见表4。
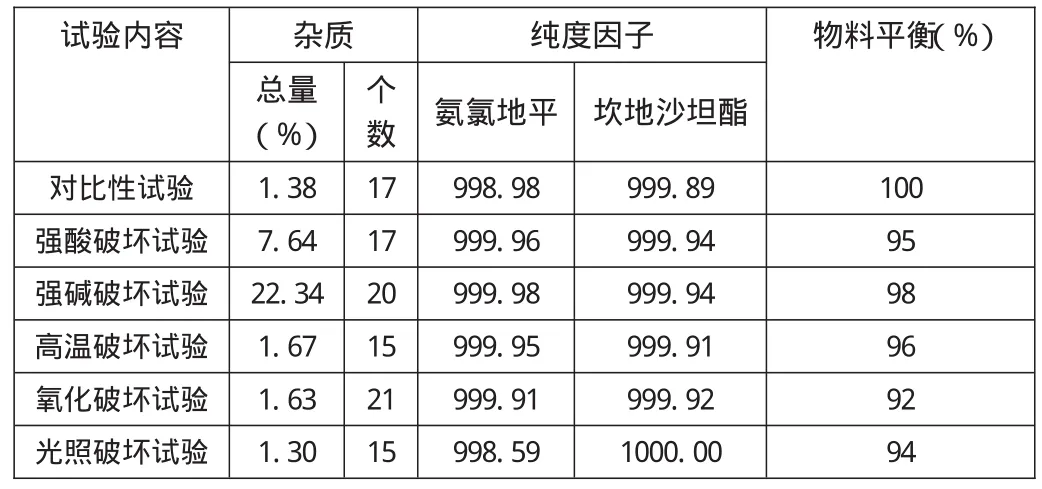
表4 破坏性试验结果
(4)精密度试验
取本品供试品溶液及其对照溶液,连续进样9次。已知杂质峰面积、单个杂质峰面积及总杂质峰面积RSD值均小于2.0%,表明仪器进样精密度良好。
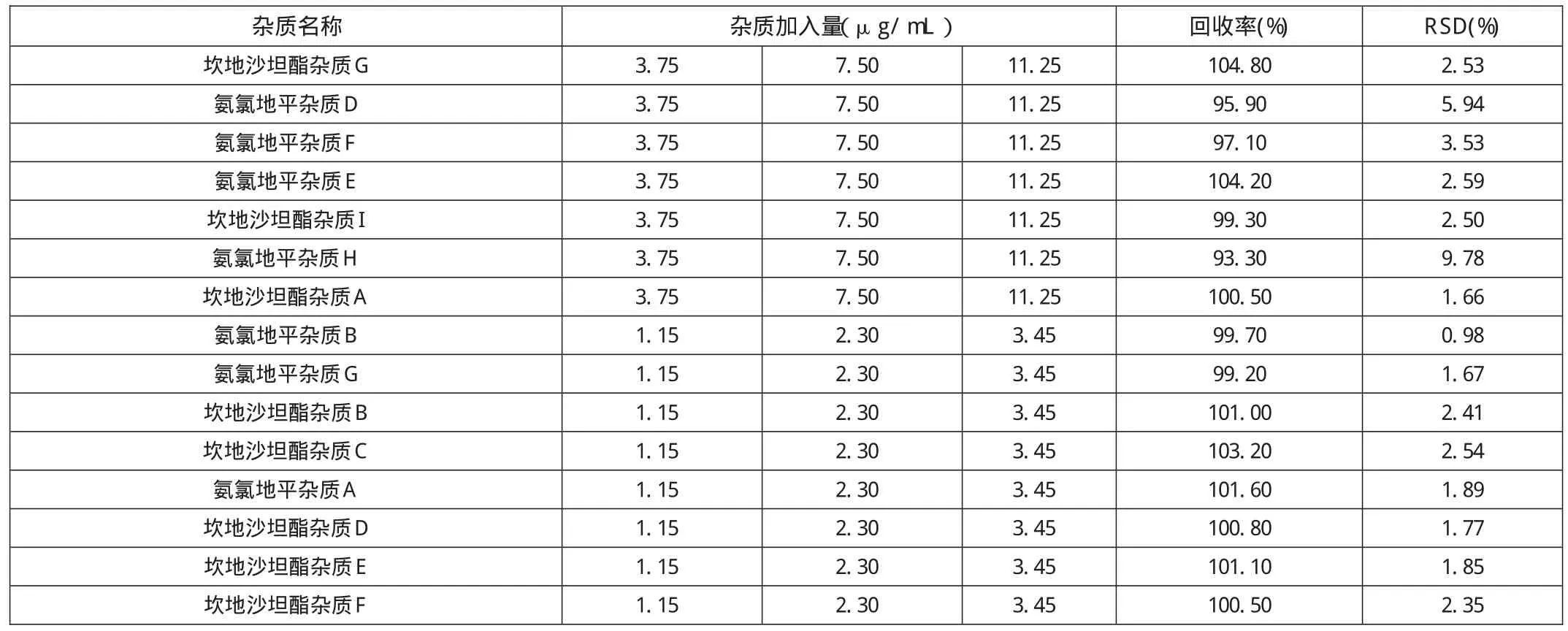
表5 回收率试验(n=9)
(5)溶液稳定性
取同一混合杂质溶液、供试品溶液,室温放置,分别于0、80、160、240、320、400、480、560、640、720 min注入HPLC测定。结果表明各杂质峰在12 h内稳定,RSD<2%,表明溶液室温放置12 h稳定。
(6)回收率试验
分别取杂质对照品溶液储备液及片粉适量(约相当于30mg坎地沙坦酯),按2.1供试品溶液的制备方法处理,注入HPLC测定。结果见表5。
结果表明杂质回收率均小于10%,符合注册要求。
(7)有关物质测定方法与结果
取本品的细粉适量,按2.1供试品溶液的制备方法处理,注入HPLC测定。供试品溶液色谱图中如有杂质峰,以对照溶液的主峰面积计算单个最大杂质和各杂质总和。坎地沙坦酯杂质B杂质应不得大于0.8%,坎地沙坦酯杂质F杂质应不得大于0.5%,氨氯地平杂质D杂质应不得大于0.8%,其他单个杂质应不得大于0.5%,杂质总量应不得大于3.0%。分别测定4批样品,结果见表6。
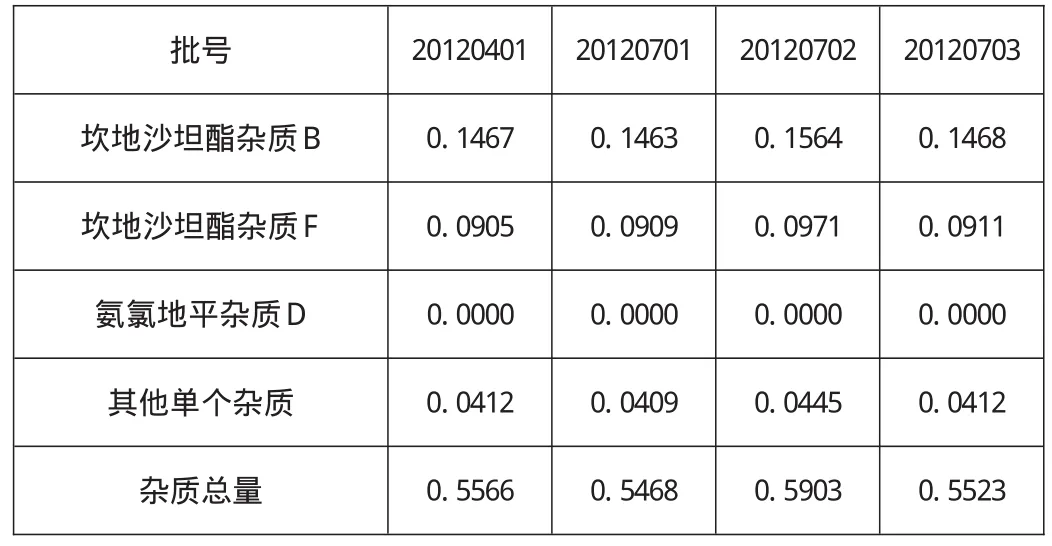
表6 有关物质测定结果
3 讨论
坎地沙坦酯氨氯地平片属于复方制剂,包含坎地沙坦酯和苯磺酸氨氯地平两种成分,在BP2013、USP35、EP7.8等中均未收载,仅在JP16收载坎地沙坦酯氨氯地平片标准。但按当前药品注册标准,JP16标准不足以完成药品注册。我们开发了HPLC,该法分析时间适中,各已知杂质和破坏降解杂质与主成分之间分离度均符合要求。
根据参比制剂原质量标准仅测定3个已知杂质和总杂。因此本文参照JP16、BP2013、USP35、EP7.8中坎地沙坦酯和苯磺酸氨氯地平的有关物质测定方法和杂质类别,同时对多达15个已知杂质进行了研究,并根据稳定性试验数据最终确定测定3个特性杂质和总杂质。结果表明该法专属性强、灵敏度高,可以作为本品有关物质测定方法,确保产品质量。
[1]2003 World Health Organization(WHO)/International Society of Hypertension(ISH)statement on management of hypertension.http://www.who.int/cardiovascular_diseases/guidelines/hypertension_guidelines.pdf?ua=1[EB/OL]2015-6-8.
[2]陈宁,毛柯,周卫,等.HPLC测定坎地沙坦酯氨氯地平片有关物质及降解产物.中国现代应用药学.2014,31(4):465-468.
[3]靳茂礼,姚振江,申磊,等.坎地沙坦酯氨氯地平片中降解产物的研究.中国药业.2014,23(3):29-30.
[4]Japanese Pharmacopoeia[S].2014:2660-2664.
[5]EUROPEAN PHARMACOPOEIA 8.0[S].2013:1754-1756.
[6]U.S.Pharmacopeia/National Formulary[S].2012:20185-2188,2468-2469.
