高分散高微细阻燃型氢氧化镁合成工艺的研究
2016-09-18于文强乔建江
于文强, 乔建江
(华东理工大学安全工程咨询中心,上海 200237)
高分散高微细阻燃型氢氧化镁合成工艺的研究
于文强,乔建江
(华东理工大学安全工程咨询中心,上海 200237)
以六水合氯化镁(MgCl2·6H2O)和氢氧化钠(NaOH)为原料,十二烷基硫酸钠和乙醇为分散剂,采用液相沉淀法制备氢氧化镁(Mg(OH)2)阻燃剂,设计正交试验,研究了投料顺序、分散剂用量、反应温度、反应物浓度及浓度配比对其粒径和吸光度的影响; 采用电子扫描显微镜(SEM)、X射线衍射仪(XRD)对其特性进行对比表征。结果显示最佳制备工艺为:投料顺序为向氯化镁和分散剂的混合溶液中滴加氢氧化钠,分散剂用量(分散剂质量与理论所得氢氧化镁质量之比)为6%,反应温度为50 ℃,反应物氯化镁溶液浓度为0.75 mol/L,氯化镁与氢氧化钠浓度配比为1∶2。表明此合成方法的工艺简便、条件缓和,合成的阻燃型氢氧化镁与市售样品相比,具有颗粒均匀、粒径更小、分布更窄的特点,颗粒的极性、分散性、抗团聚性等性能全面优于市售样品。
氢氧化镁; 阻燃剂; 合成; 分散剂; 正交试验
氢氧化镁因其阻燃性好、无毒、抑烟、抗酸、热稳定性好、热分解能高等优点,已逐步成为新一代的绿色环保无机添加型阻燃剂,广泛应用于各种有机高分子聚合材料的阻燃和抑烟,市场前景广阔[1-2]。市售的氢氧化镁阻燃剂极性较强,晶粒趋于二次团聚,导致颗粒的粒径较大,在有机物中的分散性较差,严重影响了阻燃材料的加工性能和力学性能。因此研究制备颗粒粒径小、分散性好的氢氧化镁阻燃剂意义重大。
氢氧化镁阻燃剂的制备方法主要有天然水镁石粉体的加工、镁盐溶液的碱法沉淀以及氧化镁水化等。为了改善阻燃性能,大多研究者采用水热处理,孙雨等[3]研究了加料方式、水热温度和水热时间对晶体粒径及晶体生长方向的影响,在170 ℃下水热9 h得到了粒径较小、分散性较好的氢氧化镁粉体。也有研究者采用一些特殊的方法或设备制备氢氧化镁,Zou等[4]以硝酸镁为原料,采用电化学的方法合成片状氢氧化镁; Wu等[5]以氯化镁为原料,采用微乳液法得到分散且尺寸小的氢氧化镁颗粒; Qian等[6]以氧化镁为原料,采用低温水化法制备片状氢氧化镁粉体; 宋云华等[7]采用超重力技术,制备出粒径为70 nm的六方型片状氢氧化镁; Shirure V S等[8]利用狭长通道反应器制备出粒径较小、分布集中的氢氧化镁沉淀; Henrist C等[9]对反应溶液进行超声处理制备出分散性较好的氢氧化镁颗粒。这些方法虽然可以制备出颗粒较小、分散性较好的氢氧化镁粉体,但制备工艺复杂、条件苛刻、设备要求高。研究工艺简便、条件缓和的阻燃型氢氧化镁生产技术,是氢氧化镁无机阻燃剂研究的趋势。
本文研究了以十二烷基硫酸钠和乙醇为分散剂,用液相沉淀法制备氢氧化镁的合成工艺及其最佳的工艺条件,对合成产物进行了粒径、分散性和形貌测定,并将其与市售样品进行了比照。
1 实验部分
1.1原料及仪器
六水合氯化镁(MgCl26H2O,化学纯),氢氧化钠(NaOH,化学纯),上海凌峰化学试剂有限公司; 无水乙醇(C2H6O,化学纯),十二烷基硫酸钠(SDS,化学纯),国药集团化学试剂有限公司。
恒温水浴槽,HWT-2,上海昌吉地质仪器有限公司; 蠕动泵,BT300-2J型,保定兰格恒流泵有限公司; 顶置式搅拌器,WB2000-M,WIGGENS; 电热鼓风干燥箱,DHG-9070A型,上海一恒科学仪器有限公司; 电子天平,YP6001N,上海精密科学仪器有限公司; 分析天平,AL104,梅特勒-托利多仪器(上海)有限公司; 激光粒度分析仪,Winner2302,济南微纳颗粒技术有限公司; 分光光度仪,UV-2550型,日本岛津公司。
1.2实验方法
1.2.1合成工艺的研究主要考察投料顺序、分散剂用量、反应温度、反应物浓度和浓度配比的影响。
以SDS和乙醇为分散剂,以氯化镁和氢氧化钠为原料,采用液相沉淀法制备氢氧化镁。用醇水体积比为1∶5的溶剂,配置一定浓度的MgCl2溶液和NaOH溶液,按照设定的投料顺序,将反应液与一定的SDS混合后,经蠕动泵缓慢加入到三口烧瓶中进行反应,水浴控制在一定温度,并控制搅拌转速为500 r/min,反应2 h后自然冷却至室温,所得乳浊液静置24 h。用乙醇和去离子水抽滤洗涤多次,滤饼在120 ℃下真空干燥24 h,烘干后研磨过150 μm筛,获得氢氧化镁粉体。
1.2.2产物粒径的测定取少量的氢氧化镁粉体分散于适量的无水乙醇中,用激光粒度仪测其粒径。粒径直接反映了氢氧化镁颗粒的大小,粒径越小则氢氧化镁团聚现象越弱,将其添加到有机物中的分散性越好,阻燃效果也就越明显,对材料加工性能和力学性能的负面影响越小[10]。
1.2.3产物分散性的测定称取氢氧化镁粉体(0.500 0±0.000 5)g置于50 mL小烧杯中,加入20 mL无水乙醇,用玻璃棒搅拌5 min使其分散均匀后,静置2 h,取上层清液,用分光光度计在500 nm的波长下测其吸光度,每个样品平行测试3次。
吸光度用于表征氢氧化镁样品在有机物中的分散性。因为固液悬浮体的吸光度与颗粒表面和液体的亲和作用相关[11],如果固液相容性好,那么颗粒在液体介质中具有较好的分散性,颗粒在液体介质中分散均匀且不易沉降,导致悬浮液较浑浊,对可见光的透过率低,吸光度较高; 反之,如果固液相容性较差,那么吸光度较低,说明颗粒在液体介质中的分散性较差。
1.2.4产物形貌的测定采用JSM-6360LV型SEM仪分析阻燃型氢氧化镁产品形貌,采用D/Max-Ra 转靶X-衍射仪分析阻燃型氢氧化镁产品晶体结构。
2 结果与讨论
2.1合成工艺研究
考虑到影响氢氧化镁制备效果的因素较多,本文通过正交试验确定最优的工艺方案,选取L25(55)正交表,其因素水平的选取如表1所示,正交试验的结果如表2所示。表中投料顺序(A)为先将箭头后物质加入到三口烧瓶中,再用蠕动泵将箭头前物质逐滴加入到三口烧瓶中进行反应; 分散剂用量(B)为SDS质量与理论所得氢氧化镁质量之比; 反应物浓度(D)为氯化镁溶液浓度; 浓度配比(E)为氯化镁溶液浓度与氢氧化钠浓度之比。
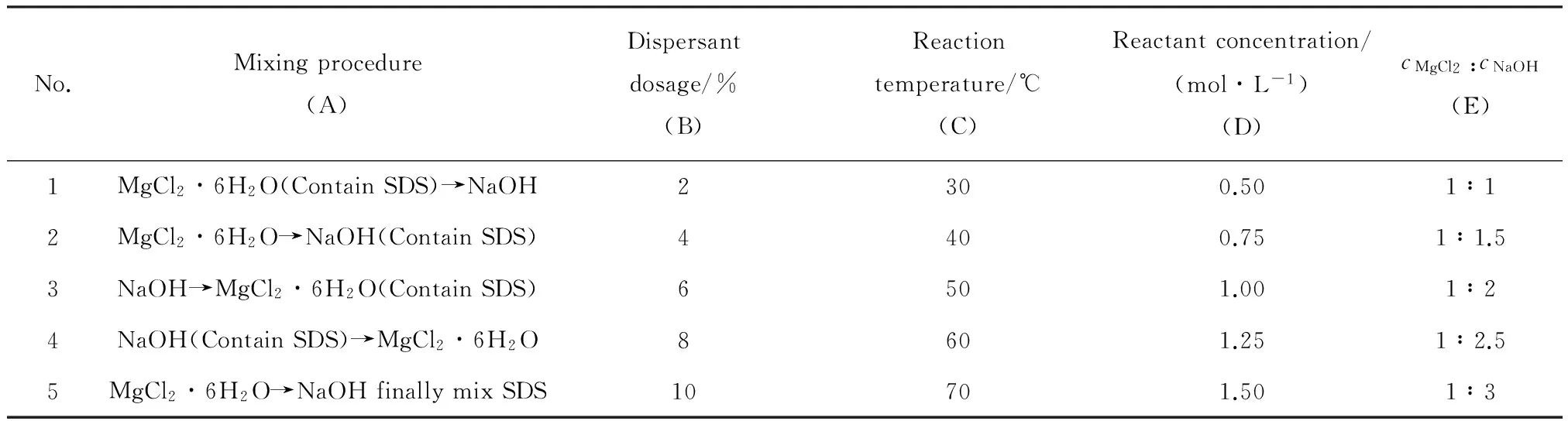
表1 因素水平表
2.1.1投料顺序的影响图1和图2分别示出了投料顺序对氢氧化镁粒径和吸光度的影响。
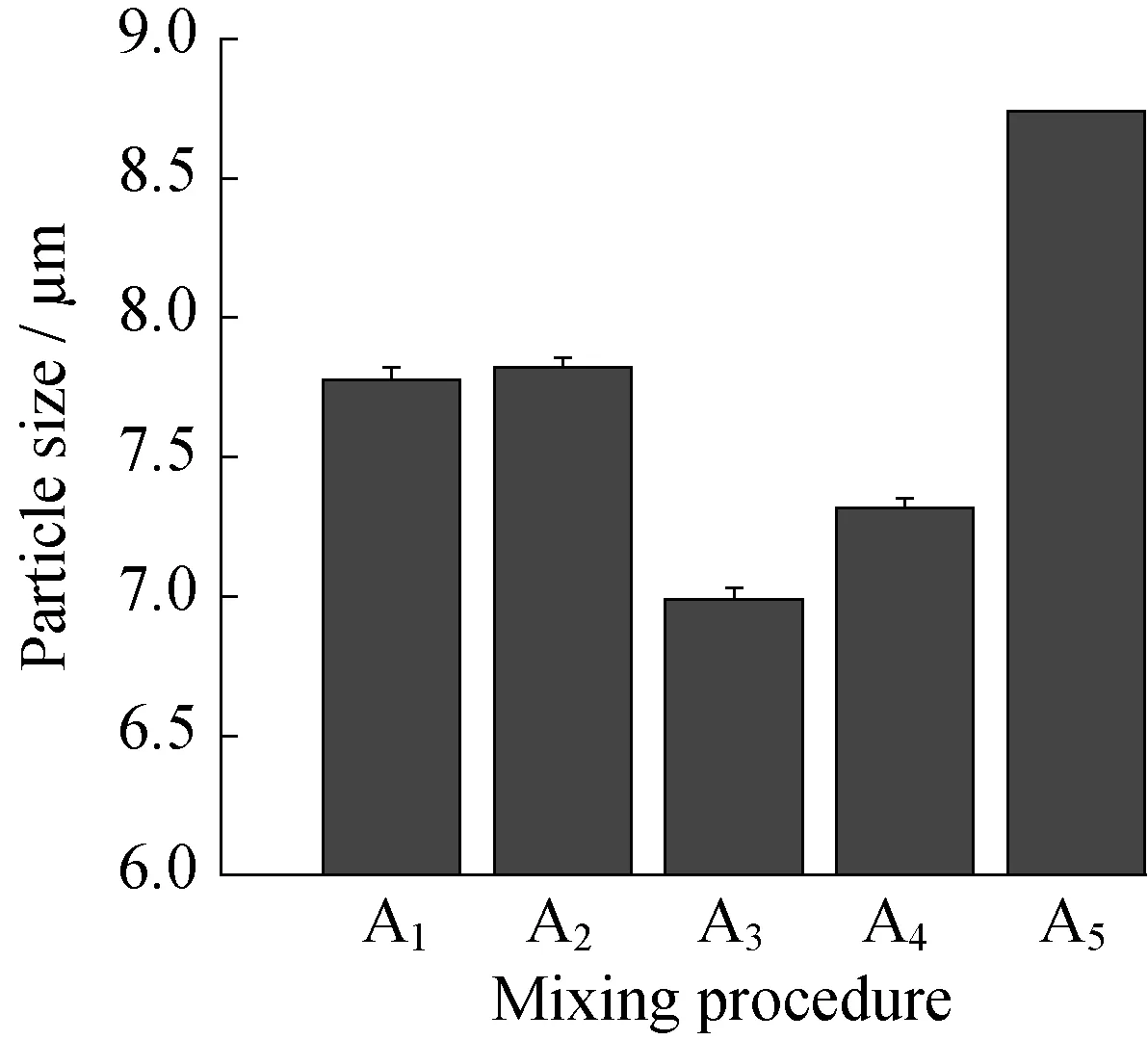
图1 投料顺序对氢氧化镁粒径的影响Fig.1 Influence of mixing procedure on the particle size of Mg(OH)2
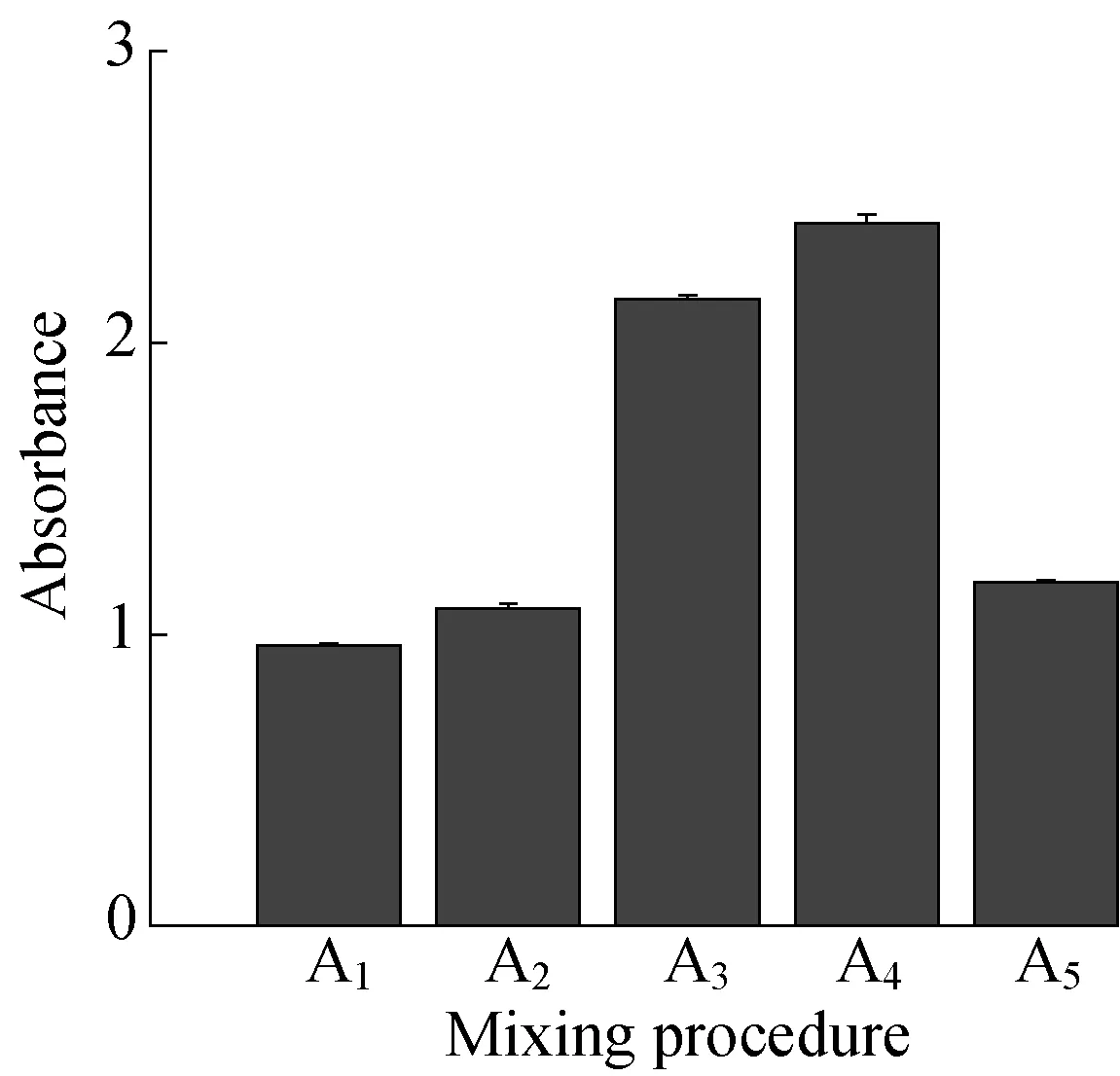
图2 投料顺序对氢氧化镁吸光度的影响Fig.2 Influence of mixing procedure on the absorbance of Mg(OH)2
从图1中可以看出,采用将氢氧化钠溶液逐滴向氯化镁溶液中滴加的投料顺序所获得粒径相对较小,其中,先将氯化镁与分散剂混合,再向混合溶液中滴加氢氧化钠,可以获得最小粒径的氢氧化镁。从图2可以看出,采用将氢氧化钠溶液逐滴向氯化镁溶液中滴加的投料顺序所获得氢氧化镁的吸光度相对较高,说明其在有机物中的分散性相对较好,其中,先将氢氧化钠与分散剂混合,再向氯化镁溶液中滴加,可以获得最高吸光度的氢氧化镁。分别比较投料顺序A1、A2和A3、A4可以发现,分散剂加入时机对产品粒径和吸光度的影响不大。这是因为,在制备氢氧化镁时,无论采取哪一种投料顺序,即Mg2+加入到OH-或OH-加入到Mg2+中,溶液的离子积都很快大于氢氧化镁的溶度积,因此都可以快速形成氢氧化镁沉淀。采用将Mg2+加入到OH-中的投料顺序时,溶液的离子积较大,过饱和度较高,导致成核的速度快,生成的氢氧化镁粒径很小且趋于团聚,因此最终制得的氢氧化镁粉体粒径较大且分散性较差; 而将OH-加入到Mg2+中的投料顺序可以使溶液的离子积维持在较小的水平,溶液的过饱和度比较低,有利于制备分散性较高的氢氧化镁粉体。
综合对比图1和图2可以发现,投料顺序对氢氧化镁粒径和吸光度的影响基本一致,即采用向氯化镁和分散剂混合溶液中滴加氢氧化钠的投料顺序时,制得的氢氧化镁效果最佳。

表2 实验数据
2.1.2分散剂用量的影响图3和图4分别示出了不同分散剂用量对氢氧化镁粒径和吸光度的影响。

图3 分散剂用量对氢氧化镁粒径的影响Fig.3 Influence of dispersant dosage on the particle size of Mg(OH)2

图4 分散剂用量对氢氧化镁吸光度的影响Fig.4 Influence of dispersant dosage on the absorbance of Mg(OH)2
从图3可以看出,随着分散剂用量的增加,粒径呈现出先减小后增大的变化规律,当分散剂用量为6%时,所获得的氢氧化镁粒径最小。从图4可以看出,随着分散剂用量的增加,吸光度呈现出先升高后降低的变化规律,当分散剂用量为6%时,所获得的氢氧化镁吸光度最高。这是因为SDS是一种阴离子表面活性剂,反应过程中,SDS包覆在氢氧化镁表面,阻止了氢氧化镁粒子之间的相互吸引,包覆程度越高,生成氢氧化镁颗粒的极性越小,二次凝聚的趋势较弱,因此其粒径越小,在有机物中的分散性越好。包覆程度的高低与分散剂的用量密切相关。从图3、图4中可以发现,当SDS用量低于6%时,随着添加量的增加,SDS在氢氧化镁表面的包覆程度逐渐升高; 当SDS的用量超过6%时,所得氢氧化镁的粒径反而变大,吸光度也不再升高,主要是因为一定量氢氧化镁的比表面积是一定的,当SDS用量达到一定的数值时,氢氧化镁的粒子表面刚好包覆了一层SDS,分散效果最好,随着SDS用量的进一步增加,分散剂分子间的相互作用也进一步加大,影响了SDS在氢氧化镁表面的包覆效果,使制得的氢氧化镁效果变差。
综合对比图3和图4可以发现,分散剂用量对氢氧化镁粒径和吸光度的影响一致,即分散剂用量为6%时,制得的氢氧化镁效果最佳。
2.1.3反应温度的影响图5和图6分别示出了反应温度对氢氧化镁粒径和吸光度的影响。

图5 反应温度对氢氧化镁粒径的影响Fig.5 Influence of reaction temperature on the particle size of Mg(OH)2
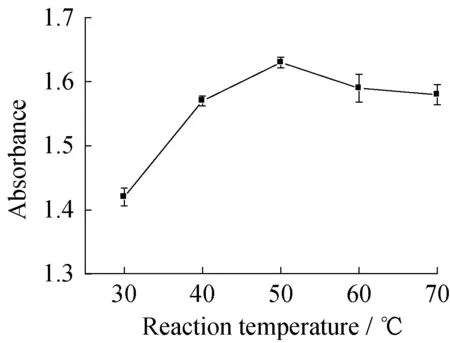
图6 反应温度对氢氧化镁吸光度的影响Fig.6 Influence of reaction temperature on the absorbance of Mg(OH)2
从图5可以看出,随着反应温度的升高,粒径呈现出先减小后增大的变化规律,当反应温度为50 ℃时,所获得的氢氧化镁粒径最小。从图6可以看出,随着反应温度的升高,吸光度呈现出先升高后降低的变化规律,当反应温度为50 ℃时,所获得的氢氧化镁吸光度最高。这是因为温度较低时,反应体系的黏度较大,物质的扩散性较差,影响了分散剂在氢氧化镁表面的包覆效果,反应温度升高有利于反应体系黏度的降低以及物质扩散性的增加,因此在50 ℃以下时,制得氢氧化镁的效果随温度的升高越来越好; 而分散剂的包覆实质上是一个吸附的过程,该过程为放热反应,温度升高将不利于吸附过程的进行,因此当反应温度超过50 ℃时,继续升温会使吸附的效果变差甚至发生解吸,使制得的氢氧化镁效果变差。
综合对比图5和图6可以发现,反应温度对氢氧化镁粒径和吸光度的影响一致,即反应温度为50 ℃时,制得的氢氧化镁效果最佳。
2.1.4反应物浓度的影响图7和图8分别示出了反应物浓度(氯化镁浓度)对氢氧化镁粒径和吸光度的影响。

图7 反应物浓度对氢氧化镁粒径的影响Fig.7 Influence of reactant concentration on the particle size of Mg(OH)2
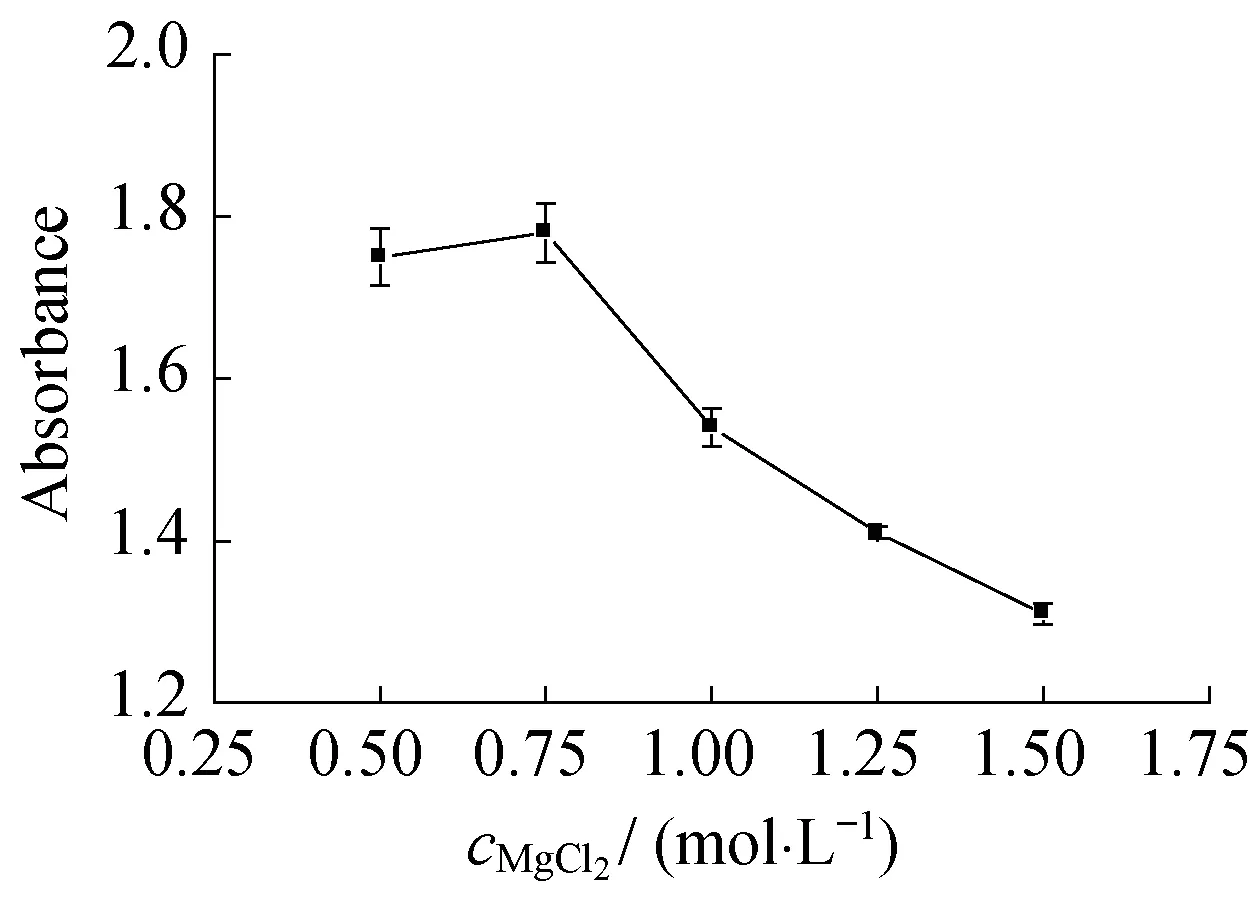
图8 反应物浓度对氢氧化镁吸光度的影响Fig.8 Influence of reactant concentration on the absorbance of Mg(OH)2
从图7可以看出,随着氯化镁浓度的增大,粒径呈现出先变小后增大的变化规律,当氯化镁浓度为0.75 mol/L时,所获得的氢氧化镁粒径最小。从图8可以看出,随着氯化镁浓度的增大,吸光度呈现出先升高后降低的变化规律,当氯化镁浓度为0.75 mol/L时,所获得的氢氧化镁吸光度最高。这是因为,氢氧化镁颗粒的大小取决于成核速率和生长速率,当氯化镁浓度小于0.75 mol/L时,溶液的过饱和度较小,成核速率较慢;当氯化镁浓度增大时,溶液的过饱和度变大,晶体的成核速率加快,同时反应体系的黏度增大,物质的扩散性降低,晶体的生长速率降低,因此制得的氢氧化镁粒径减小,效果变好; 当氯化镁浓度大于0.75 mol/L时,溶液的过饱和度较大,晶体的成核速率较快,大于生长速率,分散剂不能充分发挥作用,大量的晶核未能长大而团聚,因此制得的氢氧化镁粒径增大,效果变差。
综合对比图7和图8可以发现,反应物浓度对氢氧化镁粒径和吸光度的影响一致,即氯化镁浓度为0.75 mol/L时,制得的氢氧化镁效果最佳。
2.1.5浓度比的影响图9和图10分别示出了氯化镁与氢氧化钠浓度比对氢氧化镁粒径和吸光度的影响。

图9 氯化镁与氢氧化钠浓度比对氢氧化镁粒径的影响Fig.9 Influence of cMgCl2 ∶cNaOH on the particle size of Mg(OH)2
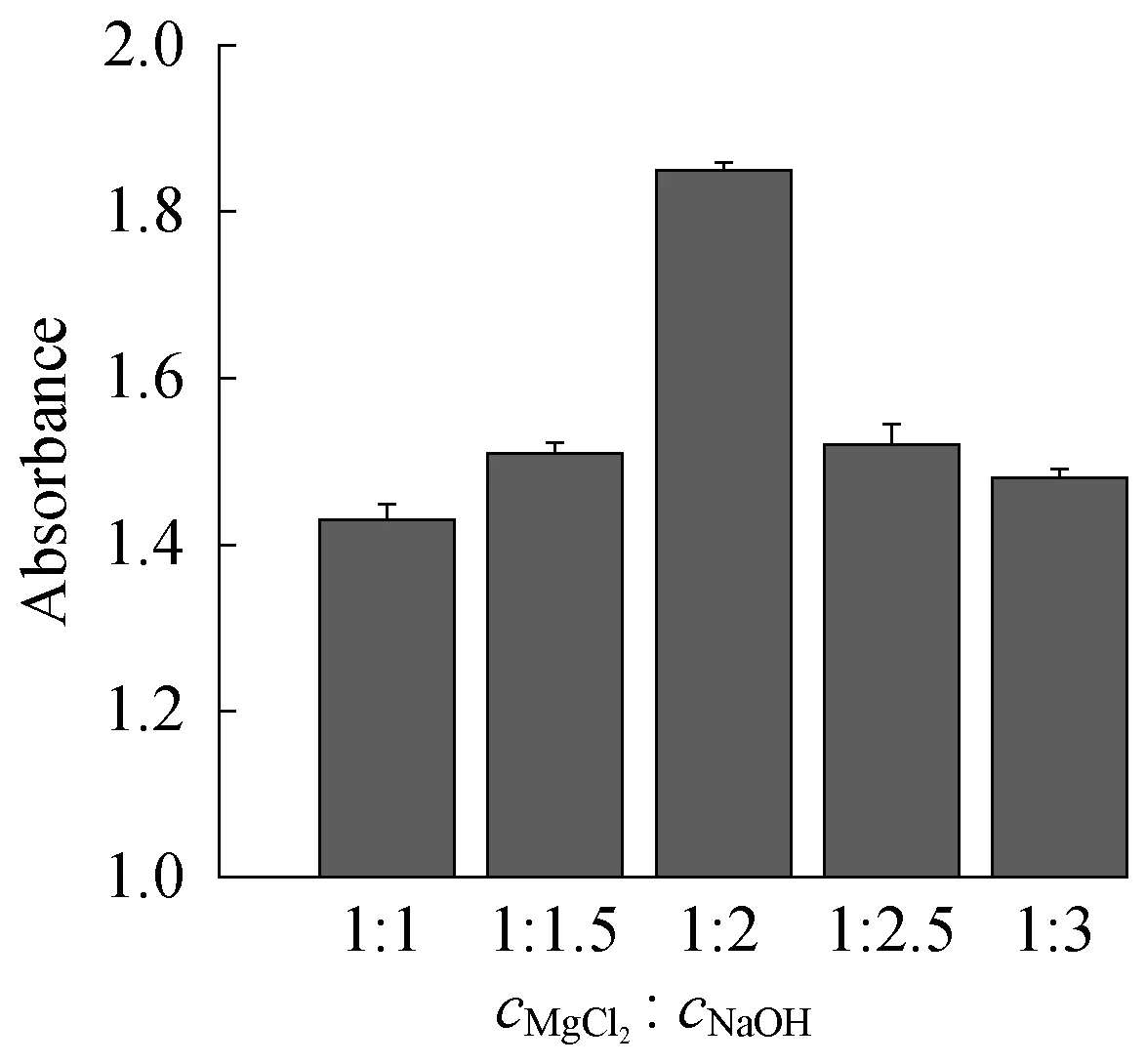
图10 氯化镁与氢氧化钠浓度比对氢氧化镁吸光度的影响Fig.10 Influence of cMgCl2 ∶cNaOH on the absorbance of Mg(OH)2
从图9可以看出,当cMgCl2∶cNaOH=1∶2时,所获得的氢氧化镁粒径最小。从图10可以看出,当cMgCl2∶cNaOH=1∶2时,所获得的氢氧化镁吸光度最高。这是因为制备氢氧化镁所用的Mg2+和OH-的理论浓度比为1∶2,反应结束后溶液中不存在多余的Mg2+和OH-,而Mg2+和OH-过多,均会导致溶液的离子积较大,从而使溶液过饱和度较高,不利于制备高分散的氢氧化镁粉体。
综合对比图9和图10发现,氯化镁与氢氧化钠浓度比对氢氧化镁粒径和吸光度的影响一致,当cMgCl2∶cNaOH=1∶2时,制得的氢氧化镁效果最佳。
根据R(极差)分析可知,各因素对氢氧化镁粒径的影响顺序依次为:投料顺序>反应温度>分散剂用量>反应物浓度>原料浓度配比,各因素对氢氧化镁吸光度的影响顺序依次为:投料顺序>反应物浓度>原料浓度配比>分散剂用量>反应温度。氢氧化镁制备的最佳工艺条件为:投料顺序为向氯化镁和分散剂的混合溶液中滴加氢氧化钠,分散剂用量为6%,反应温度为50 ℃,反应物浓度为0.75 mol/L,cMgCl2∶cNaOH=1∶2。该最佳工艺条件并不包含在上述25个正交试验中,这也正体现了设计正交试验的优越性。
2.2对比分析
将最佳工艺条件下制得的氢氧化镁产品与市售氢氧化镁样品的粒径与吸光度进行对比(图11,表3),其中样品1为上海试四赫维化工有限公司提供的实验室用分析纯氢氧化镁; 样品2为浙江旭森非卤消烟阻燃剂有限公司提供的合成氢氧化镁阻燃剂产品,牌号为XS-MHS-7; 样品3为浙江旭森非卤消烟阻燃剂有限公司提供的天然氢氧化镁阻燃剂产品,牌号为XS-MHB-3。

图11 不同氢氧化镁的粒径分析图Fig.11 Particle sizes distribution curves of different Mg(OH)2 particles 表3 不同氢氧化镁的吸光度分析表 Table 3 Absorbance table of different Mg(OH)2 particles
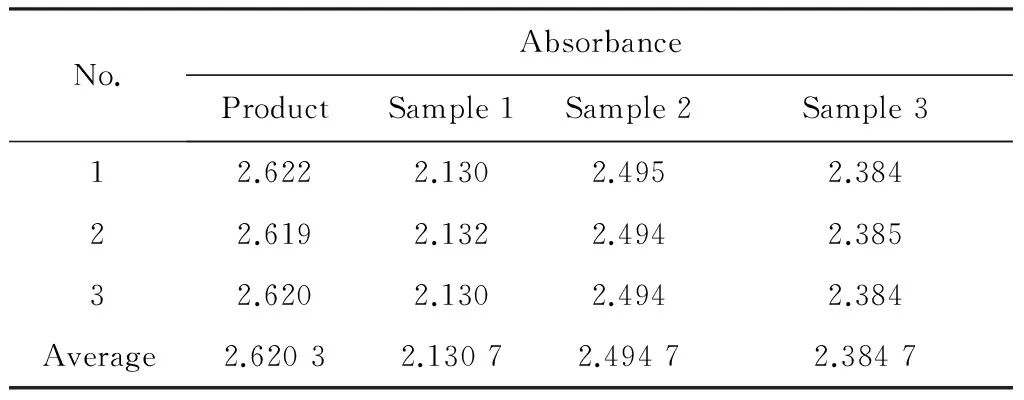
No.AbsorbanceProductSample1Sample2Sample312.6222.1302.4952.38422.6192.1322.4942.38532.6202.1302.4942.384Average2.62032.13072.49472.3847
氢氧化镁产品的D50(样品的累计粒度分布百分数达到50%时所对应的粒径)为5.487 μm,平均粒径为6.470 μm; 市售氢氧化镁样品1的D50为9.295 μm,平均粒径为13.445 μm,样品2的D50为8.345 μm,平均粒径为11.099 μm,样品3的D50为9.424 μm,平均粒径为17.196 μm。比较分析可知,所制得阻燃型氢氧化镁产品的粒径较小,分布集中,团聚现象较弱。表3所示所得产品的吸光度较大,说明其在有机物中具有更好的分散性,因此所得产品的性能优于市售的氢氧化镁样品。
图12所示为氢氧化镁产品和市售样品的XRD图谱。由图12(a)可以看出,所得氢氧化镁产品的XRD衍射峰位置与标准氢氧化镁衍射图谱(PDF44-1482)一致,无其他杂质峰,说明所得产品结构为六方晶型且纯度很高。对氢氧化镁而言,(001)晶面是生长基元在面上的延伸,粒子间以离子键的方式连接;(101)晶面则是生长基元层与层之间的叠加,两层之间以弱氢键相连。由于(001)晶面所显露的是配位体的面,因此其表面能较低,极性较弱。反之(101)晶面所显露的是配位体的顶点,使(101)晶面上表面能增大,极性提高,因此(001)面强度提高有助于降低氢氧化镁极性,提高产品分散性[12-13]。由图12可以看出,氢氧化镁产品(001)面的峰强相对较高,而(101)面的峰强相对较低,说明氢氧化镁产品极性较弱的(001)晶面生长明显,显露较多,而极性较强的(101)晶面相对减少,产品表面极性相对较弱,微观内应力较低,分散性提高,颗粒二次团聚的趋势减弱,因此所得产品颗粒的粒径较小,分散性较好。
图13所示为氢氧化镁产品和市售样品的SEM图,其中图13 (a)和13 (b)为所得氢氧化镁产品在不同放大倍数下的SEM图,图13 (c)、13 (d)、13 (e)分别为市售样品1、2、3的SEM图。由图13 (a)和13 (b)可以看出,制得氢氧化镁产品的颗粒大小均匀,粒径较小,形貌统一,为规则的片状结构,粒子之间的界限比较清晰,基本无团聚现象,分散性较好。市售的样品由于比表面积较大,表面能较高,容易吸附周围其他颗粒来降低其表面能,因此二次团聚现象严重,甚至出现大片结块的现象。
3 结 论
(1) 投料顺序、分散剂用量、反应温度、反应物浓度及浓度比对制得氢氧化镁的粒径和分散性有影响。各因素对氢氧化镁粒径的影响顺序依次为:投料顺序>反应温度>分散剂用量>反应物浓度>反应物浓度比; 各因素对氢氧化镁分散性的影响顺序依次为:投料顺序>反应物浓度>反应物浓度比>分散剂用量>反应温度。
(2) 以SDS和乙醇为分散剂体系的氢氧化镁阻燃剂合成方法,具有工艺简便、条件缓和的特点。其最佳工艺条件为:投料顺序为向氯化镁和分散剂的混合溶液中滴加氢氧化钠;分散剂用量为6%; 反应温度为50 ℃; 反应物氯化镁溶液浓度为0.75 mol/L;氯化镁与氢氧化钠浓度比为1∶2。

图12 不同氢氧化镁的XRD图Fig.12 XRD pattern of different Mg(OH)2 particles

a,b—Product; c—Sample 1; d—Sample 2; e—Sample 3 图13 不同氢氧化镁的SEM图Fig.13 SEM pattern of different Mg(OH)2 particles
(3) 采用本文方法合成的阻燃型氢氧化镁与市售样品相比,具有颗粒均匀、粒径更小、分布更窄的特点,颗粒的极性、分散性、抗团聚性等性能全面优于市售样品。
[1]LU Shuiyu,HAMCRTON Ian.Recent development in the chemistry of halogen-free retardant polymers[J].Progress in Polymer Science,2002,27(8):1661-1712.
[2]赵丽,盖广清,王立艳,等.氢氧化镁阻燃剂的改性进展[J].河南科技,2015,565(6):116-118.
[3]孙雨,高恩双,潘旭杰,等.水热法合成高分散易过滤高阻燃氢氧化镁[J].无机盐工业,2013,4(45):29-31.
[4]ZOU Guanglong,LIU Run,CHEN Weixiang.Highly textural lamellar mesostructured magnesium hydroxide via a cathodic electrodeposition process[J].Materials Letters,2007,61(10):1990-1993.
[5]WU Jianming,YAN Hong,ZHANG Xuehu,etal.Magnesium hydroxide nanoparticles synthesized in water-in-oil micro-emulsions[J].Journal of Colloid and Interface Science,2008,324(1-2):167-171.
[6]QIAN Haiyan,DENG Min,ZHANG Shaoming,etal.Synthesis of superfine Mg(OH)2particles by magnesite[J].Materials Science and Engineering A,2007,445-446:600-603.
[7]宋云华,陈建铭,李立华,等.超重力技术制备纳米氢氧化镁阻燃剂的应用研究[J].化工矿物与加工,2004(5):19-23.
[8]SHIRURE V S,PORE A S,PANGARKAR V G.Intensification of precipitation using narrow channel reactors:Magnesium hydroxide precipitation[J].Industrial and Engineering Chemistry Research,2005,44(15):5500-5507.
[9]HENRIST C,MATHIEU J P,VOGELS C,etal.Morphological study of magnesium hydroxide nano particles precipitated in dilute aqueous solution[J].Journal of Crystal Growth,2002,249(1):321-330.
[10]许荣辉,石海涛,任凤章,等.纳米氢氧化镁晶体阻燃剂的制备及其性质[J].河南科技大学学报(自然科学版),2010,31(5):8-11.
[11]朱新兵,曹长年,李含雪,等.复合改性剂对氢氧化镁的表面改性研究[J].青海大学学报(自然科学版),2013,6(31):42-47.
[12]赵卓雅,李祥高,王世荣,等.六角片状氢氧化镁(001)晶面优先生长条件的研究[J].人工晶体学报,2014,43(7):1611-1619.
[13]LI Xue,MA Guobao,LIU Yiyun.Synthesis and Characterization of Magnesium Hydroxide Using a Bubbling Setup[J].Industrial and Engineering Chemistry Research,2009,48(2):763-768.
Synthesis of Flame Retardant Magnesium Hydroxide with High Dispersion and High Degree of Fineness
YU Wen-qiang,QIAO Jian-jiang
(Safety Engineering Consulting Center,East China University of Science and Technology,Shanghai 200237 China)
Flame retardant magnesium hydroxide (Mg(OH)2) particles were synthesized by liquid phase hydrolysis method with magnesium chloride (MgCl2·6H2O) and sodium hydroxide (NaOH) as raw materials,sodium dodecyl sulfate and ethanol as dispersing agents.The influences of mixing procedure,the dosage of dispersants,reaction temperature,reactant concentration and concentration ratio on particle size and absorbance were explored by orthogonal experiment.The magnesium hydroxide particles obtained under the best technological conditions were characterized by X-ray diffraction (XRD) and scanning electron mmicroscope (SEM).The best technological conditions are as following:sodium hydroxide was added to magnesium chloride and dispersant mixed solution,the dosage of dispersants 6%,reaction temperature 50 ℃,reactant magnesium chloride concentration 0.75 mol/L and concentration ratio of magnesium to hydroxyl 1∶2.This synthetic method is featured by simplicity in process and mild operation condition.The synthesized flame retardant magnesium hydroxide particles are more uniformed and with smaller size,narrower size distribution,better polarity,dispersion and anti-aggregation performance compared to the commercially available products.
magnesium hydroxide; flame retardant; synthesis; dispersant; orthogonal experiment
1006-3080(2016)04-0521-08
10.14135/j.cnki.1006-3080.2016.04.013
2015-11-10
于文强(1991-),男,山东青岛人,硕士生,主要研究领域为无机阻燃剂。E-mail:wqyu@mail.ecust.edu.cn
通信联系人:乔建江,E-mail:jjqiao@ecust.edu.cn
X932
A
