盐酸托烷司琼注射液不同处方及灭菌工艺对产品质量影响的研究
2016-09-18张建礼董旭刘绪贵李后涛王宏伟山东齐都药业有限公司山东省脑神经保护类药物重点实验室山东淄博255400
张建礼,董旭,刘绪贵,李后涛,王宏伟山东齐都药业有限公司,山东省脑神经保护类药物重点实验室,山东淄博 255400
盐酸托烷司琼注射液不同处方及灭菌工艺对产品质量影响的研究
张建礼,董旭,刘绪贵,李后涛,王宏伟
山东齐都药业有限公司,山东省脑神经保护类药物重点实验室,山东淄博255400
目的通过对盐酸托烷司琼注射液不同处方及灭菌工艺的研究,选择出最佳的处方和灭菌工艺,为大生产工艺提供依据。方法采用不同的处方和不同的pH值配制药液,考察不同灭菌工艺灭菌前后样品的性状、pH值、溶液的澄清度与颜色、含量、有关物质。 结果盐酸托烷司琼注射液受pH调节剂、pH值的影响较大。结论冰醋酸-醋酸钠处方的样品稳定性好,工艺条件简单,适合大规模生产操作。
盐酸托烷司琼;pH值;杂质;稳定性
[Abstract]Objective To research the different prescriptions of tropisetron hydrochloride injection and sterilization processes and select the best prescription and sterilization process and provide basis for the high-yield process.Methods The soup was prepared by different prescriptions and pH values,and the property,pH value,solution clarify,color,content and relevant materials of samples before and after sterilization of different sterilization processes were examined.Results The pH regulator and pH value had a big effect on the tropisetron hydrochloride injection.Conclusion The sample stability of glacial acetic acid-sodium acetate prescription is good,and the process condition is easy,which is suitable for the largescale production and operation.
[Key words]Tropisetron hydrochloride;pH value;Impurity;Stability
盐酸托烷司琼(Tropisetron Hydrochloride)是继昂丹司琼和格拉司琼之后上市的第2代止吐药,由瑞士诺华公司原研开发,是具有高度选择性的5-羟色胺受体拮抗药。盐酸托烷司琼注射液1999年由瑞士诺华进口到中国,商品名“欧必亭”,主要用于预防和治疗放化疗引起的恶心和呕吐以及术后恶心呕吐。盐酸托烷司琼作为强效止吐药,具有半衰期长,高效低毒,不良反应小的特点[1-2],近年来在临床上得到了广泛应用。盐酸托烷司琼为吲哚甲酸衍生物,盐酸托烷司琼注射液制备及长期放置过程中易降解产生3-吲哚甲酸、3-吲哚甲醛,对产品质量有较大影响。中国药典2015年版收载的盐酸托烷司琼原料药标准中列明了杂质Ⅰ(3-吲哚甲酸)、杂质Ⅱ(3-吲哚甲醛),但原料和制剂中均未明确要求控制杂质Ⅰ和杂质Ⅱ,仅要求按主成分自身对照法控制未知杂质的含量。经杂质谱分析,3-吲哚甲酸是托烷司琼原料药合成的关键中间体,同时也能通过降解杂质3-吲哚甲醛进一步降解生成[3],因此从仿制药质量一致性方面来说,有必要对制剂中的杂质Ⅰ和Ⅱ详细研究,并与原研品进行质量对比。盐酸托烷司琼杂质结构式如图1、图2所示。
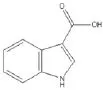
图1 杂质|:3-吲哚甲酸
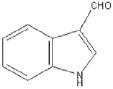
图2 杂质‖:3-吲哚甲醛
该文参考诺华上市品“欧必亭”原研品处方,采用不同的处方和制备工艺,对制备的盐酸托烷司琼注射液进行质量和稳定性研究,重点考察不同处方工艺条件的样品杂质Ⅰ和杂质Ⅱ的含量,最终为选择适合大生产规模的处方工艺提供依据。经调研,笔者尚未发现该方面的研究报道。具体研究内容如下。
1 试验部分
1.1仪器与材料
1.1.1仪器与设备 pHS-3C型精密pH计(上海精密科学仪器有限公司),RFG型实验用安瓿瓶熔封机(长沙中亚制药设备有限公司),不锈钢配液桶,TMQ.C/3850J型台式灭菌器(新华医疗器械股份有限公司),LC-20AT型高效液相色谱仪(日本岛津公司)。
1.1.2材料盐酸托烷司琼(批号:150201,山东齐都药业有限公司),氯化钠(批号:201505002,山东肥城精制盐厂),冰醋酸,醋酸钠,盐酸,注射用水,5 mL安瓿瓶。
1.2处方与制备工艺
原研品“欧必亭”辅料使用冰醋酸、醋酸钠,成品pH值为4.6~5.2,为考察不同pH调节剂、半成品不同pH值以及不同灭菌工艺对产品质量的影响,设计处方及制备工艺如下。
1.2.1处方盐酸托烷司琼注射液为盐酸托烷司琼的灭菌水溶液,以氯化钠为渗透压调节剂,同时使用醋酸钠-冰醋酸缓冲对或者盐酸为pH调节剂,两种pH调节剂的处方组成见表1。

表1 盐酸托烷司琼注射液处方
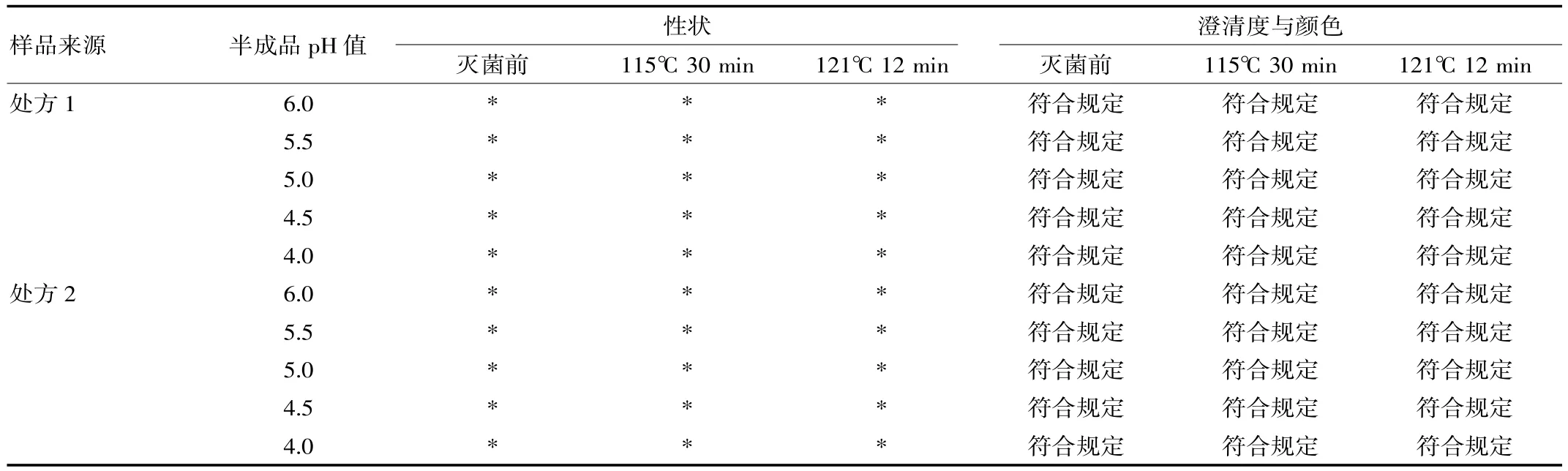
表2 灭菌前后样品的性状、澄清度与颜色对比
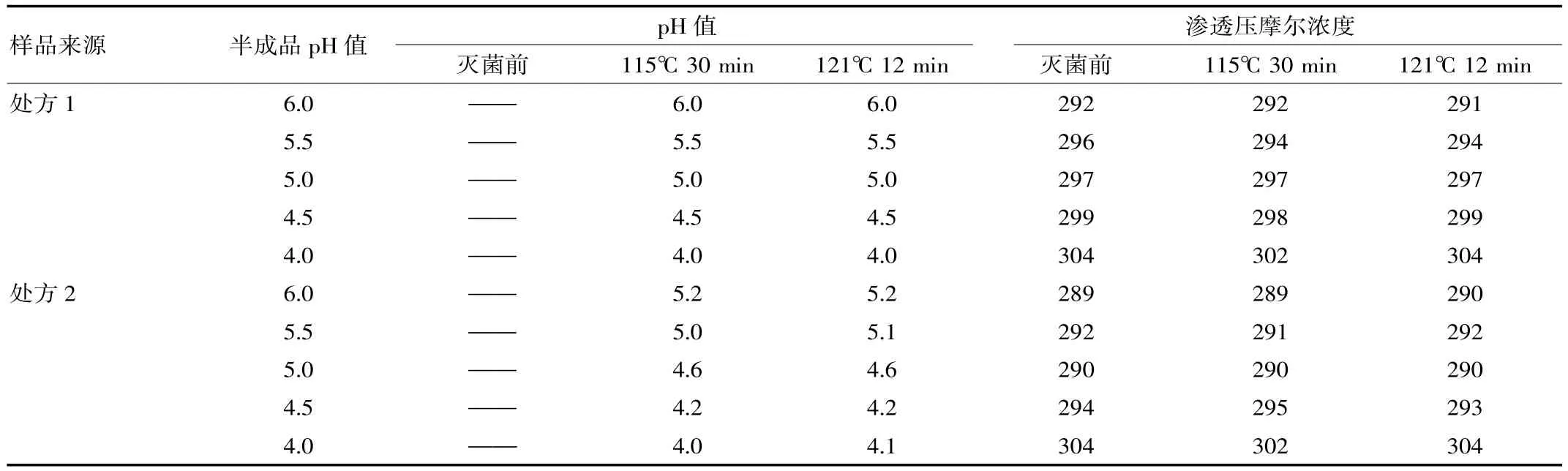
表3 灭菌前后样品的pH值对比
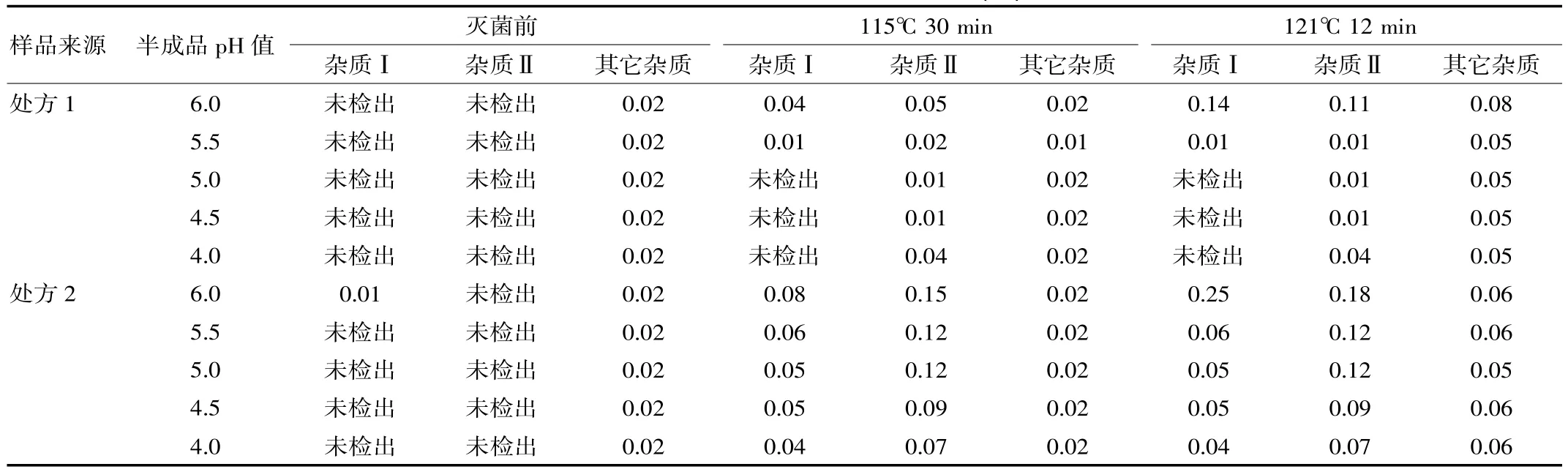
表5 灭菌前后样品的有关物质含量对比(%)
1.2.2制备工艺(1)按处方1分别称取盐酸托烷司琼5.64 g,氯化钠45.0 g,醋酸钠5.0 g,冰醋酸适量,备用。向不锈钢配液桶内加入约4 000 mL注射用水,加入称量好的氯化钠、醋酸钠和盐酸托烷司琼,搅拌至完全溶解,加注射用水至5 000 mL。用冰醋酸调节药液pH值至6.0,灌装200支;剩余药液平均分为4份,分别使用冰醋酸调节药液pH值至5.5、5.0、4.5、4.0,各个pH值药液均灌封200支。每个pH值样品取20支不灭菌,作为留样,其余样品每个pH值样品平均分为2份,分别在115℃30 min和121℃12 min条件下灭菌,得成品。(2)按处方2分别称取盐酸托烷司琼5.64 g,氯化钠45.0 g,盐酸适量,备用。向不锈钢配液桶内加入约4 000 mL注射用水,加入称量好的氯化钠、盐酸托烷司琼,搅拌至完全溶解,加注射用水至5 000 mL。用盐酸调节药液pH值至6.0,灌装200支;剩余药液平均分为4份,分别使用盐酸调节药液pH值至5.5、5.0、4.5、4.0,各个pH值药液均灌封200支。每个pH值样品取20支不灭菌,作为留样,其余样品每个pH值样品平均分为2份,分别在115℃30 min和121℃12 min条件下灭菌,得成品。
2 样品检验部分
2.1仪器与试剂
LC-20A型高效液相色谱仪(日本岛津),BS110S型电子天平(北京赛多利斯仪器系统有限公司),盐酸托烷司琼对照品(中国食品药品检定研究院,规格:100 mg/支,批号:100683-200401),盐酸托烷司琼杂质Ⅰ、Ⅱ对照品(EDQM,规格:10 mg/支),澄明度检测仪,pH-3C型pH计(上海精密科学仪器有限公司)。
2.2检验项目
灭菌前后自制样品的性状、澄清度与颜色、pH值、渗透压摩尔浓度、盐酸托烷司琼含量和有关物质。
2.3检验结果
2.3.1性状、澄清度与颜色 对制备的样品进行目测,检查不同pH值对样品性状、澄清度与颜色是否有影响,试验结果见表2。
2.3.2pH值、渗透压摩尔浓度 对制备的样品进行pH值、渗透压摩尔浓度检测,对比灭菌前后变化情况,试验结果见表3。
2.3.3含量(1)色谱条件:十八烷基硅烷键合硅胶柱(250 mm×4.6 5 μm);流动相:磷酸盐缓冲液(取磷酸二氢钾6.8 g,加水500 mL使溶解,加三乙胺5 mL,用水稀释至1 000 mL,用磷酸调节pH值至3.5)-乙腈(80∶20);检测波长:284 nm。(2)试验方法。精密量取该品,用流动相A稀释制成每mL含托烷司琼约20 μg的溶液,作为供试溶液。精密量取托烷司琼对照品适量,用流动相A制成每mL含托烷司琼约20 μg的溶液,作为对照品溶液。分别取供试品溶液和对照品溶液10 μL注入液相色谱仪,记录色谱图,按外标法计算托烷司琼的含量。检验结果见表4。
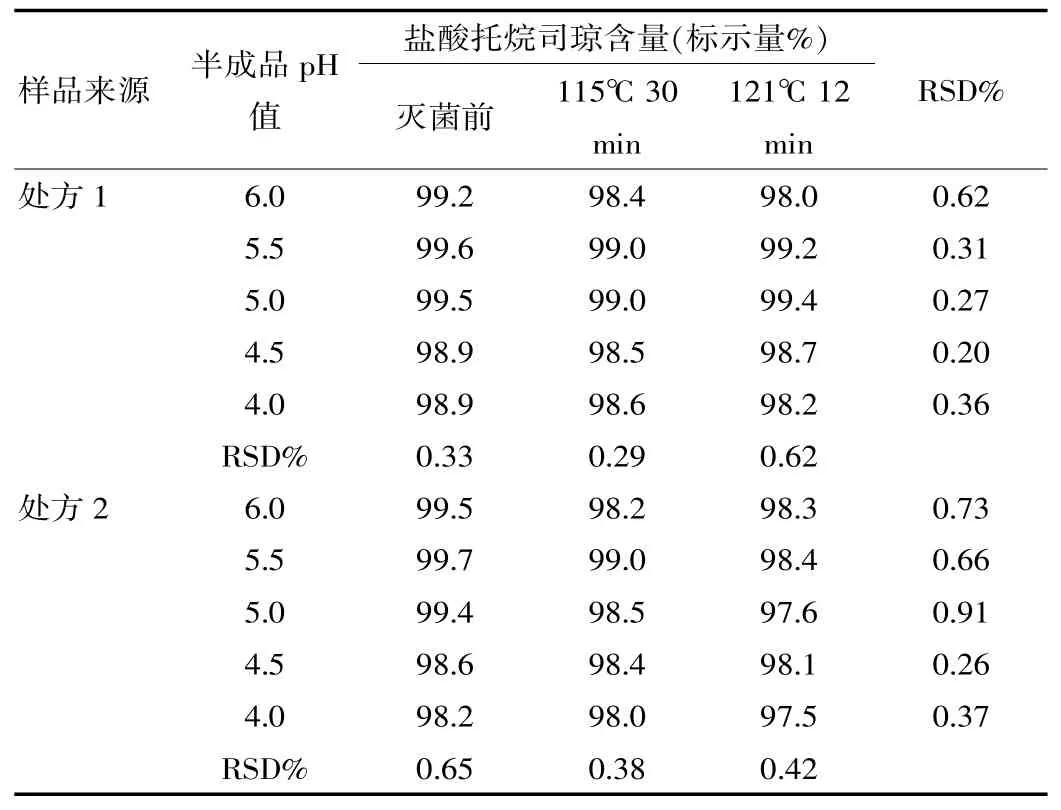
表4 灭菌前后样品的含量对比
2.3.4有关物质(1)色谱条件:同含量检测项下色谱条件;(2)试验方法:精密量取该品,每毫升含托烷司琼约1 mg的溶液,作为供试溶液。精密量取供试溶液1 mL,置500 mL容量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液。另取杂质Ⅰ、杂质Ⅱ对照品适量,加流动相稀释制成各含杂质Ⅰ和Ⅱ1 μg的溶液,摇匀,作为对照品溶液。分别精密量取供试溶液、对照及对照品溶液20 μL注入液相色谱仪,记录色谱图。供试溶液中溶剂峰和小于0.05%对照溶液主成份峰的杂质峰除外,如显与杂质Ⅰ、Ⅱ一致和杂质峰,不得大于对照品溶液中的峰面积(0.1%),如有其他杂质峰,单个杂质峰面积不得过对照溶液主峰面积的0.5倍(0.1%),各杂质峰面积和不得过对照溶液主峰面积的2.5倍(0.5%)。检测结果见表5。
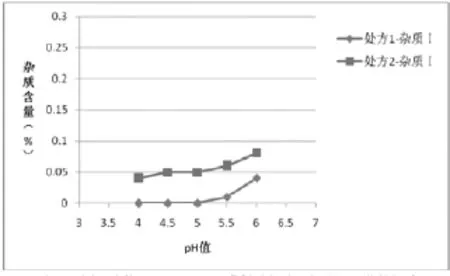
图1 两种处方均115℃30 min灭菌样品杂质|含量与pH值的关系
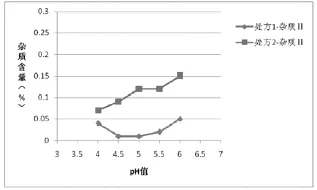
图2 两种处方均115℃30 min灭菌样品杂质‖含量与pH值的关系
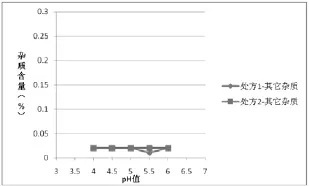
图3 两种处方均115℃30 min灭菌样品其它杂质含量与pH值的关系
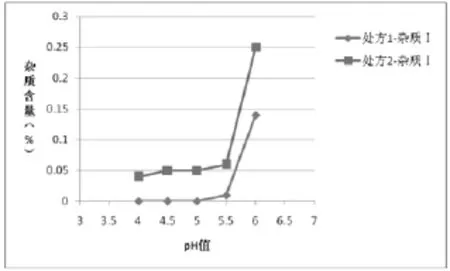
图4 两种处方均121℃12 min灭菌样品杂质|含量与pH值的关系
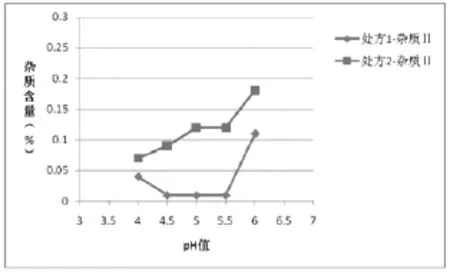
图5 两种处方均121℃12 min灭菌样品杂质‖含量与pH值的关系
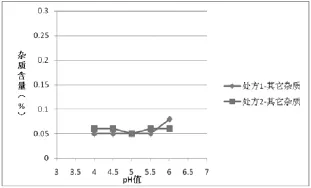
图6 两种处方均121℃12 min灭菌样品其它杂质含量与pH值的关系
2.4结果分析
(1)表2表明,不同处方工艺制备的样品灭菌前后性状均为无色的澄明液体,溶液澄清无色,符合标准规定。
(2)表3表明,处方2样品灭菌后pH值较灭菌前有所下降,呈现灭菌前pH值越高,灭菌后pH下降越明显的趋势;而处方1样品灭菌前后pH值没有变化。试验表明,处方1使用冰醋酸调节pH值,与醋酸钠形成缓冲对有利于灭菌前后pH值保持稳定。不同处方工艺样品的渗透摩尔浓度差别不明显,均符合等渗要求。
(3)表4表明,相同处方及pH值的样品不同条件灭菌前后含量测定RSD均小于1%;相同处方、不同pH值的样品相同条件灭菌前后含量测定RSD均小于1%;两种处方的样品经灭菌后托烷司琼含量均有下降趋势;处方2样品经121℃12 min灭菌后,含量下降较其他产品下降更为明显,使用盐酸调节pH值的样品对121℃12 min较高灭菌强度的耐受性较差,不利于产品质量控制。相反,处方1使用冰醋酸-醋酸钠缓对调节pH的样品,pH值介于4.5~5.5时,经115℃30 min和121℃12 min两种工艺灭菌后,含量下降最不明显,基本处于相对稳定的范围。
(4)根据表5绘制不同工艺条件下处方1和处方2杂质含量对比图:①两种灭菌条件下的样品,各个pH条件下处方1的杂质Ⅰ、杂质Ⅱ的含量相比处方2较少,如图1、2(115℃30min)、图4、5(121℃12min)所示,两种处方下其它杂质的含量基本相同,如图3、6所示;处方1样品整体质量优于处方2。②两种处方下样品均有pH值越高,杂质Ⅰ含量越高的趋势,如图1、4所示,但是对杂质Ⅱ来说,处方1样品pH值在4.5~5.5时,能够控制杂质Ⅱ含量在较低范围,如图2、3所示。③在pH值不大于5.5时,不同灭菌条件对各杂质含量影响差异不明显;pH值大于5.5时,不同处方样品的杂质含量均有明显升高,如图1、2、4、5所示。④由图1~6可分别看出,处方1下样品在pH值4.0~5.5范围内,杂质含量较低且趋于稳定。
3 试验结论
参考原研处方,处方1冰醋酸-醋酸钠缓对调节pH的样品,pH值介于4.5~5.5时,121℃12 min灭菌条件下能够较好的控制盐酸托烷司琼注射液中的杂质Ⅰ和杂质Ⅱ及其它有关物质的含量,且能够稳定控制产品性状、澄清度与颜色、托烷司琼含量,保证产品质量。
4 讨论
盐酸托烷司琼为生物碱类,本身含有的酯结构易在高温灭菌条件下水解,且与pH值关系较大,该文通过不同处方、不同pH及灭菌工艺的对比研究,为盐酸托烷司琼注射液开发初期的质量的设计提供了依据,为产品大生产规规模确定生产工艺提供了指导。
[1]上官新英.托烷司琼防治肿瘤化疗恶心、呕吐的临床疗效[J].中国肿瘤临床,2008(24):113-114.
[2]吴锋,朱敏,杨俊,等.盐酸托烷司琼合成工艺改进[J].中南药学,2011(1):27.
[3]Abdel-Fattah LS,El-Sherif ZA,Kilani KM,et al.HPLC,TLC,and first-derivative spectrophotometry stability-indicating methods for the determination of tropisetron in the presence of its acid degradates[J].J AOAC Int,2010,93(4): 1180.
Research on Effect of Different Prescriptions of Tropisetron Hydrochloride Injection and Sterilization Processes on the Product Quality
ZHANG Jian-li,DONG Xu,LIU Xu-gui,LI Hou-tao,WANG Hong-wei
Shandong Qi Du Pharmaceutical Co.,Ltd&Shandong Provincial Key Laboratory of brain nerve protection,Zibo,Shandong Province,255400 China
R943
A
1672-5654(2016)07(c)-0173-05
10.16659/j.cnki.1672-5654.2016.21.173
张建礼(1963.9-),男,山东淄博人,大专,高级工程师,研究方向:药品生产与研发。
2016-04-20)
