缺氧对红曲霉桔霉素相关基因表达量及产量的影响
2016-09-18马博雅王雪莲王昌禄天津科技大学食品工程与生物技术学院食品营养与安全教育部重点实验室天津300457廊坊出入境检验检疫局河北廊坊065000
马博雅,张 佳,王雪莲,王昌禄(.天津科技大学 食品工程与生物技术学院,食品营养与安全教育部重点实验室,天津 300457;.廊坊出入境检验检疫局,河北 廊坊 065000)
缺氧对红曲霉桔霉素相关基因表达量及产量的影响
马博雅1,2,张佳2,王雪莲2,王昌禄1*
(1.天津科技大学 食品工程与生物技术学院,食品营养与安全教育部重点实验室,天津 300457;2.廊坊出入境检验检疫局,河北 廊坊 065000)
为了比较有氧与缺氧条件下与桔霉素合成相关的3个基因表达量的差异及探讨桔霉素产量与相关基因表达量之间的对应关系,将高产桔霉素的红曲霉MX1分别置于有氧及缺氧条件下培养20 d,动态监测桔霉素产量及相关基因表达量的变化。有氧条件下桔霉素产量及相关基因表达量均呈现先升高后降低的趋势且均在第8天达到峰值;缺氧条件下,桔霉素产量一直处于较低状态且终产量比有氧条件下低40.16%,ctnA基因的表达量总是低于有氧条件,而orf7基因的表达量总是高于有氧条件,pksCT基因的表达量没有呈现明显的规律性。结果表明,缺氧条件可能是通过抑制ctnA基因的表达和促进orf7基因的表达来抑制桔霉素的合成,而pksCT基因不是调控桔霉素合成的关键基因。
红曲霉;桔霉素;缺氧;基因表达量
红曲霉(Monascus)在食品工业中的应用已有悠久的历史。近年来,由于它能够生成多种生理活性物质而备受各国专家学者的关注[1]。然而,红曲霉在产生对人体有益的生物活性物质的同时,还会产生一种真菌毒素—桔霉素。桔霉素主要作用于肾脏,不仅可以致畸、致癌,而且可以诱发突变[2-3]。
红曲霉桔霉素的产量受到各种外界环境因子的影响,如培养基种类[4-6]、温度[7]、光照[8-9]、pH[10]、物理化学诱变[11]、溶解氧[12]等。红曲霉属于好氧微生物,发酵液中的溶解氧直接影响着红曲霉的生长以及次生代谢产物合成。通气培养红曲霉有利于菌丝体生长及活性物质生成,但桔霉素的产量提高的更为显著。因此,低氧气转换系数是降低桔霉素产量的重要因素。
红曲霉菌产生的桔霉素属于聚酮类化合物,由聚酮合酶(polyketide synthase,PKS)基因编码合成。目前,与桔霉素合成相关的PKS基因和相应基因簇的相关序列测定及功能分析已有报道。SHIMIZU T等[13-15]根据真菌PKS保守区设计简并引物,从紫色红曲菌(Monascus purpureus)中克隆得到一段13 kbp的基因组片段,得到桔霉素合成相关的PKS基因(pksCT)全长,随后又克隆了pksCT基因的两侧序列,得到一个21 kbp桔霉素合成相关基因簇(共6个基因,其中包括ctnA)。LI Y P等[16]对橙色红曲菌(Monascus aurantiacus)基因组文库进行筛选,对获得的克隆子进行测序分析后,得到长约43kbp的序列,除了包含SHIMIZUT等[13]报道的6个基因外,还有10个新发现的开放阅读框架(openreadingframe,ORF)(包括orf7)。
虽然国内外学者已经对红曲霉桔霉素进行的比较深入的研究,然而在缺氧环境诱导下桔霉素产量与其合成相关基因表达量的对应关系的研究却鲜有报道。本研究从缺氧对红曲霉桔霉素产量及其报道的桔霉素合成相关的3个基因(ctnA,pksCT,orf7)的表达量影响入手,从基因表达角度解释缺氧环境诱导红曲霉桔霉素代谢机理,为真菌的次生代谢途径研究提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1菌株
红曲霉(Monascus)MX1:天津科技大学食品工程与生物技术学院食品生物技术实验室保藏。
1.1.2培养基
菌种保藏培养基:麦芽汁(糖度10~12°Bx),琼脂粉2%。
种子培养基:葡萄糖60 g/L,蛋白胨20 g/L,NaNO310 g/L,MgSO4·7H2O 5 g/L,KH2PO410 g/L。
发酵培养基:蔗糖160 g/L,酵母浸粉40 g/L。
以上培养基均采用高压蒸汽灭菌,121℃、20 min。
1.1.3化学试剂
乙腈(色谱纯)、甲醇(色谱纯):德国Merck公司;超纯水:娃哈哈集团有限公司;桔霉素标准品(纯度99%):美国Sigma公司。
1.2仪器与设备
1260高效液相色谱仪、MX3000P实时荧光定量PCR仪:美国Agilent公司;YQX-Ⅱ型厌氧培养箱:上海新苗医疗器械制造有限公司。
1.3方法
1.3.1培养条件及方法
将菌种接种于斜面培养基,30℃恒温培养4 d,制成浓度为2×106个/mL孢子悬浮液,以每瓶5 mL接种于50 mL发酵培养基中,摇匀,分别置于有氧与缺氧条件下进行培养,每个样品做3个平行。下层发酵液用于桔霉素的测定,上层菌丝体用于核糖核酸(ribose nucleic acid,RNA)的提取及生物量的测定。
1.3.2样品处理
准确吸取0.5 mL红曲发酵液,放入10 mL容量瓶中,用无水乙醇定容至10 mL,混匀后60℃水浴1 h,水浴过程中每隔10 min颠倒混匀一次,5 000 r/min离心15 min,取上清液,经0.22 μm滤膜过滤后备用。
1.3.3桔霉素含量检测高效液相色谱条件
色谱柱:Agilent TC-C18(5 μm,4.6 mm×250 mm);流动相:乙腈∶甲醇∶水=70∶10∶20(V/V),放置过夜,用磷酸调pH 2.66~2.68;荧光检测器,λex=331 nm,λem=500 nm;柱温:25℃;流速:1 mL/min;进样量:20 μL。
1.3.4桔霉素标准曲线的绘制
准确称取5.00 mg桔霉素标准品用色谱纯乙腈定容至10 mL,得到质量浓度为500 μg/mL的桔霉素标准母液,配制成质量浓度为0、0.10 μg/mL、0.25 μg/mL、2.00 μg/mL、5.00 μg/mL、10.00 μg/mL的桔霉素标准溶液,经0.22 μm滤膜过滤后备用。
1.3.5桔霉素合成相关基因表达量测定方法
Takara RNA提取试剂盒、Takara反转录试剂盒进行RNA的提取及反转录。以美国国家生物技术信息中心(national center of biotechnology information,NCBI)上报道的红曲霉桔霉素合成相关各基因序列为参考序列,ctnA(No.AB243687),pksCT(No.AB167465),orf7(No.EU309474)以及内参基因actin(No.AJ417880),用NCBIPrimer-BLAST设计引物,用以扩增红曲霉MX1上述3个基因。采用SYBR Green染色,实时荧光定量PCR(real time fluorogenic quanti tativePCR,RT-qPCR)方法对红曲霉桔霉素合成相关基因相对表达量进行监控。PCR扩增程序:95℃、30 s;95℃、5 s,60℃、30 s,72℃、30 s,42个循环。
2 结果与分析
2.1桔霉素含量及红曲霉产量的测定
桔霉素标准品的高效液相色谱图如图1所示,桔霉素标准品的保留时间为4.830 min。

图1 桔霉素标品HPLC色谱图Fig.1 HPLC chromatogram of citrinin standard
桔霉素标准曲线如图2所示。由标准曲线求得峰面积(y)对桔霉素质量浓度(x)的线性回归方程为:y=58.06x,相关系数R2=0.999 4。结果表明,二者线性关系良好。
红曲霉发酵样品的液相色谱图如图3所示,红曲霉发酵样品中桔霉素保留时间为4.828 min。按照桔霉素标准回归方程计算发酵液中桔霉素含量(以mg/g干菌质量计),红曲霉菌丝体烘干至恒质量,作为干菌质量即生物量。
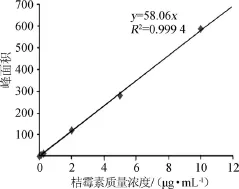
图2 桔霉素标准曲线Fig.2 Standard curve of citrinin

图3 发酵样品HPLC色谱图Fig.3 HPLC of fermentation sample
2.2缺氧对红曲霉桔霉素产量的影响
按1.3.1的方法将红曲霉MX1置于有氧培养箱及厌氧培养箱,30℃恒温培养20d,生物量及桔霉素产量结果见图4。

图4 有氧与缺氧条件下生物量和桔霉素产量Fig.4 Biomass and citrinin yield under aerobic and anaerobic conditions
由图4可知,在有氧条件下,桔霉素产量呈现先升高后降低的趋势,在第8天达到峰值,为6.64 mg/g干菌质量,发酵最后桔霉素产量降低至2.54 mg/g干菌质量;而在缺氧条件下,桔霉素产量一直处于较低的水平,在第18天产量最高,为2.13 mg/g干菌质量,发酵终产量为1.52 mg/g干菌质量,比有氧条件下低40.16%。
结果表明,在缺氧条件下,红曲霉MX1桔霉素产量显著低于有氧条件,生产上可以通过控制通氧量来抑制桔霉素的产量。
2.3缺氧对红曲霉桔霉素合成相关基因表达量的影响
按1.3.5的方法设计RT-qPCR实验所用引物,引物序列如表1所示。

表1 RT-qPCR实验所用引物Table 1 Primers for RT-qPCR
按照1.3.5的方法,以actin作为内参基因,以有氧条件下培养至第6天时各基因表达量为单位1,比较有氧条件与缺氧条件下桔霉素合成相关基因表达量的差异,基因相对表达量测定结果如图5所示。
由图5可知,在有氧条件下,3个基因的表达量都呈现先升高后降低的趋势,而且都是在第8天达到最高值,这与桔霉素产量变化趋势一致。在缺氧条件下,只有ctnA基因表达量与桔霉素产量变化趋势呈正相关且与有氧条件相比一直处于较低水平,pksCT基因的表达量没有表现出明显的规律性,orf7基因的表达量随着培养时间的延长而增加且一直高于有氧条件。
由图5可知,在有氧条件下,3个基因的表达量都呈现先升高后降低的趋势,而且都是在第8天达到最高值,这与桔霉素产量变化趋势一致。但在缺氧条件培养下,各基因表达量的变化各有不同,缺氧条件打乱了相关基因表达量与桔霉素产量之间的对应关系。在缺氧条件下,ctnA基因表达量与桔霉素产量变化趋势呈正相关且与有氧条件相比一直处于较低水平。ctnA基因编码锌指转录因子,是桔霉素合成途径中的激活因子[14,17]。缺氧条件可能是通过抑制ctnA基因的表达来抑制桔霉素的合成。pksCT基因是第一个被发现的与桔霉素合成相关的基因,一度被认为是调控桔霉素合成的关键基因[13,18-20]。本试验中,在缺氧条件下该基因的表达量没有表现出明显的规律性,这表明在缺氧条件下,pksCT基因并不是调控桔霉素合成的关键基因。值得注意的是,邹乐花等[21]的研究表明,敲除orf7基因后,桔霉素产量是野生型菌株的2.42倍,orf7基因可能对桔霉素的合成起到抑制作用。由图5可知,在缺氧条件下orf7基因的表达量与有氧条件相比显著升高,这同样表明了缺氧条件可能是通过促进orf7基因的表达来抑制桔霉素的生成。

图5 缺氧条件对桔霉素合成ctnA(A),pksCT(B)及orf7(C)基因表达量的影响Fig.5 Effect of anaerobic conditions on expression level ofctnA(A),pksCT(B)andorf7(C)genes of the citrinin synthesis
3 结论
缺氧培养可以显著降低红曲霉桔霉素的产量。缺氧条件可以抑制ctnA基因的表达、促进orf7基因的表达。缺氧条件可能是通过抑制ctnA基因的表达和促进orf7基因的表达来抑制桔霉素的合成,而pksCT基因不是调控桔霉素合成的关键基因。
[1]雷萍,金宗濂.红曲中生物活性物质的研究进展[J].食品工业科技,2004,25(9):86-89.
[2]唐僖,宋航.红曲中桔霉素的检测控制及无桔霉素红曲产业化[J].中国酿造,2009,28(9):1-6.
[3]FÖLLMANN W,BEHM C,DEGEN G H.Toxicity of the mycotoxin citrinin and its metabolite dihydrocitrinone and of mixtures of citrinin and ochratoxin Ain vitro[J].Arch Toxicol,2014,88(5):1097-1107.
[4]陈泉,吴远征,扈进冬,等.高产Monacolin K红曲霉菌种的筛选及液态发酵条件优化[J].中国酿造,2015,34(6):48-52.
[5]周建建,苏里,赵双枝,等.采用响应曲面法优化红曲霉发酵培养基组分[J].食品工业科技,2012,33(23):152-157.
[6]陈勉华,吉达维,马人杰,等.不同发酵基质对红曲重要代谢产物的影响[J].中国酿造,2013,32(3):22-24.
[7]CHEN M H,WANG C L,BAN Z,et al.Restriction of citrinin accumulation inMonascusby improving culture temperature[C]//The 3th International Conference on Bioinformatics and Biomedical Engineering.Beijing:Institute of Electrical and Electronics Engineers,2009:1-4.
[8]WANG C L,YANG H,CHEN M H,et al.Real-time quantitative analysis of the influence of blue light on citrinin biosynthetic gene cluster expression inMonascus[J].Biotechnol Lett,2012,34(9):1745-1748.
[9]杨华.红曲霉代谢调控及蓝光诱导分子机制初步研究[D].天津:天津科技大学,2012.
[10]刘波,邓姗.pH对红曲色素呈色的影响[J].四川食品与发酵,2006,42(4):48-50.
[11]JIA X Q,XU Z N,ZHOU L P,et al.Elimination of the mycotoxin citrinin production in the industrial important strainMonascus purpureus SM001[J].Metab Eng,2010,12(1):1-7.
[12]YANG J,CHEN Q,WANG W P,et al.Effect of oxygen supply on Monascuspigments and citrinin production in submerged fermentation[J].J Biosci Bioeng,2015,119(5),564-569.
[13]SHIMIZU T,KINOSHITA H,ISHIHARA S,et al.Polyketide synthase gene responsible for citrinin biosynthesis inMonascus purpureus[J]. Appl Environ Microbiol,2005,71(7):3453-3457.
[14]SHIMIZU T,KINOSHITA H,NIHIRA T.Identification andin vivo functional analysis by gene disruption ofctnA,an activator gene involvedincitrininbiosynthesisinMonascus purpureus[J].Appl Environ Microbiol,2007,73(16):5097-5103.
[15]SAKAI K,KINOSHITA H,SHIMIZU T,et al.Construction of a citrinin gene cluster expression system in heterologousAspergillus oryzae[J].J Biosci Bioeng,2008,106(5):466-472.
[16]LI Y P,XU Y,HUANG Z B.Isolation and characterization of the citrinin biosynthetic gene cluster fromMonascus aurantiacus[J].Biotechnol Lett,2012,34(1):131-136.
[17]XU M J,YANG Z L,LIANG Z Z,et al.Construction of aMonascus purpureusmutant showing lower citrinin and higher pigment production by replacement ofctnAwithpks1without using vector and resistance gene[J].J Agr Food Chem,2009,57(20):9764-9768.
[18]曹丽凌.红曲霉T-DNA突变体库的构建、生物学特性分析及桔霉素合成基因的克隆[D].金华:浙江师范大学,2013.
[19]周礼红.红曲霉遗传转化系统及桔霉素、Monacolin K生物合成相关PKS基因的克隆与功能鉴定[D].无锡:江南大学,2005.
[20]付桂明.橙色红曲菌pksCT基因的敲除和长同源臂置换型打靶载体的构建[D].南昌:南昌大学,2007.
[21]邹乐花,李燕萍,黄志兵,等.橙色红曲菌As 3.4384orf7基因缺失菌株的构建及其功能分析[J].中国生物工程杂志,2011,31(7):79-84.
Effect of anaerobic condition on the citrinin yields and the expression level of citrinin biosynthetic genes inMonascus
MA Boya1,2,ZHANG Jia2,WANG Xuelian2,WANG Changlu1*
(1.Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Langfang Entry-Exit Inspection and Quarantine Bureau,Langfang 065000,China)
In order to compare the difference of expression level of the three genes involved with citrinin synthesis under aerobic and anaerobic conditions and discuss the corresponding relationship between yield and expression level of genes involved,high citrinin-producingMonascusMX1 was cultured for 20 d under the aerobic and anaerobic conditions,respectively.The changes of citrinin yield and expression level of genes involved were monitored dynamically.Under aerobic conditions,both the citrinin yield and expression level of genes involved first increased,then decreased,and reached their highest levels on the 8th day.While under anaerobic conditions,the citrinin yield was in a low level and the final yield of citrinin was 40.16%lower than that under aerobic conditions.The expression level ofctnAgene under anaerobic conditions was always lower than that under aerobic conditions,while the expression level oforf7gene was higher,and the expression level ofpksCTgene had no obvious regularity.The results showed that anaerobic conditions could inhibitionctnAgene expression and promoteorf7gene expression to inhibit the synthesis of citrinin,but pksCTgene was not the key gene of citrinin synthesis.
Monascus;citrinin;anaerobic conditions;expression level of gene
Q786
0254-5071(2016)07-0143-04
10.11882/j.issn.0254-5071.2016.07.031
2016-02-20
国家自然科学基金资助项目(31171729)
马博雅(1988-),女,硕士研究生,研究方向为食品生物技术。
王昌禄(1960-),男,教授,硕士,研究方向为食品生物技术。
