耐酸性布拉氏酵母的筛选及高密度培养条件优化
2016-09-18李飞龙陈晓华谢永振谭之磊贾士儒
李飞龙,陈晓华,郑 鑫,谢永振,谭之磊,贾士儒
耐酸性布拉氏酵母的筛选及高密度培养条件优化
李飞龙,陈晓华,郑鑫,谢永振,谭之磊,贾士儒*
(天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津 300457)
布拉氏酵母菌(Saccharomyces boulardii)是临床上作为益生菌药物治疗肠道疾病使用的唯一一株酵母菌,作为微生态制剂,要保证其生物效果,必须能够在胃肠道中保持一定的活菌数,研究发现影响布拉氏酵母菌在胃肠道中存活的最主要因素是低pH,为提高布拉氏酵母菌在低pH条件下的存活率,该研究采用常压室温等离子体(ARTP)诱变技术对S.boulardii进行诱变,最终筛选出3株对低pH值耐受性较好的突变株。对突变株耐低pH稳定性的研究结果表明,在传代20次后,突变株YB-3具有较好的遗传稳定性,其存活率为51.79%。在5 L发酵罐中,对突变株YB-3高密度培养条件进行优化,最终所得布拉氏酵母菌体干质量为58.79 g/L,比原始菌株提高了55.52%。
布拉氏酵母菌;室温常压等离子体诱变;高密度培养;耐酸性
布拉氏酵母(Saccharomyces boulardii)是法国科学家Henri Boulard在20世纪20年代初期于印尼水果荔枝中分离得到的一株非致病性酵母菌[1-2]。S.boulardii是临床上作为益生菌药物治疗肠道疾病使用的唯一一株酵母菌[3-5],目前广泛用于预防和治疗抗生素相关性腹泻、艰难梭菌相关性腹泻、胃肠道炎症的药物中。在许多国家,S.boulardii冻干制剂常作为用于预防儿童和成人的腹泻药物[2-6]。作为微生态制剂,S.boulardii常被用于治疗由抗生素和微生物感染引起的腹泻,维持胃肠道微环境平衡[6-9]。此外,其作为饲料添加剂的应用已得到包括中国、欧盟在内的世界上许多国家的认可,在畜牧业中也有广阔的应用前景[10-12]。
研究表明,用S.boulardii处理感染艰难梭菌(Clostridium difficile)的限菌鼠一次,预防小鼠患结肠炎的有效率为16%,而当小鼠连续摄入S.boulardii时,有效率可达56%;进一步研究表明,这种保护作用不仅依赖于摄入S.boulardii的剂量,还和S.boulardii的活体细胞数有关[13]。在鼠肠道细胞上的研究结果证实了S.boulardii对霍乱弧菌(cholera toxin,CT)具有抑制作用,实验组细胞中CT诱导环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的量比对照组下降了50%,经确认发挥作用的是一个120 ku的蛋白,如果将布拉氏酵母菌细胞加热杀死时,酵母对cAMP的抑制作用也随之消失[14-15]。
根据杜晓蒙[16]研究表明,影响摄入细胞活性的主要因素是胆汁盐、胃肠道消化酶和pH值的变化,其中对S.boulardii活性影响最大的是pH。HUDSON L E等[17]使小鼠口服108个S.boulardii活细胞,4 h后从小鼠肠道只能回收到10~20个活细胞,直接证明了低pH对于S.boulardii菌存活率的影响。
由于S.boulardii对低pH耐受性较差,动物口服S.boulardii后到达肠道内的活菌数很少,作为饲料添加剂,要保证其生物效果,必须能够在胃肠道中保持一定的活菌数[18-20]。为提高S.boulardii对低pH的耐受性和在胃肠道中存活效率,本研究通过常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术筛选出耐酸性的S.boulardii,提高S.boulardii对低pH的耐受性,并对筛选出的S.boulardii突变菌株高密度发酵条件进行了优化,提高S.boulardii的菌体产量,为其工业化应用打下基础。
1 材料与方法
1.1材料与试剂
布拉氏酵母菌(S.boulardii):由天津科技大学生化工程研究室保藏。
沙氏液体培养基:葡萄糖4%,蛋白胨1%,pH 5.5;
酵母浸出粉蛋白胨葡萄糖(yeast peptone dextrose,YPD)固体培养基:葡萄糖2%,酵母膏1%,蛋白胨2%,琼脂2%,pH 6.0;
初始发酵培养基:葡萄糖1%,酵母膏1.2%,KH2PO40.08%,MgSO40.05%,pH 5.5。
1.2仪器与设备
ARTP-IIS ARTP育种仪:无锡源清天木生物科技有限公司;BIOTECH-5BG-7000A 5 L全自动发酵罐:上海保兴生物设备工程有限公司;IS-RDS3叠加式恒温培养振荡器:美国精骐生物工程有限公司;BioSpectrometer basic生物紫外分光光度计:德国Eppendorf公司;Bioscreen全自动生长曲线分析仪:芬兰OY Growth Curves公司。
1.3方法
1.3.1S.boulardii的培养
将S.boulardii接种到装液量为100 mL/500 mL沙氏液体培养基中,30℃、180 r/min振荡培养24 h。
S.boulardii种子液的制备:将上述S.boulardii菌液按10%的接种量接种到装液量为90 mL/500 mL沙氏液体培养基中,30℃、180 r/min振荡培养12 h。
1.3.2 ARTP诱变方法
将培养至对数期的S.boulardii种子液于4℃、4 000 r/min离心5 min,收集菌体,用生理盐水重悬浮后调节OD600nm至0.7,吸取10 μL菌液均匀涂布在载片表面,将载片置于载物台上,设置ARTP育种仪2 mm射距照射,分别照射0、5 s、10 s、15 s、20 s、25 s、30 s、35 s、40 s、45 s、50 s。将经过诱变处理后的载片置于装有1 mL生理盐水的离心管中,振荡均匀后稀释涂布YPD固体培养基上,每个梯度3个平行,采用稀释涂布法测定菌落数,以菌落数来反映活菌数,计算致死率。致死率计算公式如下:

1.3.3耐酸性S.boulardii突变株的初筛
将经过ARTP诱变处理的S.boulardii稀释涂布于YPD固体培养基上,30℃静置培养48 h,挑取单菌落接种至装液量为50 mL/250 mL pH 2.0的沙氏液体培养基中,30℃、180 r/min振荡培养12 h,在波长600 nm处测定其光密度OD600nm值,选择OD600nm值较高的培养液中的菌株进行复筛。
1.3.4耐酸性S.boulardii突变株的复筛及耐酸性测定
制备初筛得到单菌落种子液后,以10%的接种量接种至装液量为50mL/250mLpH2.0的沙氏液体培养基中,30℃、180 r/min振荡培养6 h,采用稀释涂布法测定菌落数,并按照下列公式计算存活率。

1.3.5S.boulardii突变菌株高密度培养条件优化
杜晓蒙[16]对摇瓶培养S.boulardii的培养基进行了优化,本文在此基础上对S.boulardii突变菌株YB-3高密度培养条件经行了优化。将制备的种子液按一定比例接种至装有3 L发酵培养基的5 L自动发酵罐中,30℃发酵36 h,分别考察接种量(5.0%、7.5%、10.0%、12.5%和15.0%)、pH(4.0、4.5、5.0、5.5和6.0)、溶氧水平(dissolved oxygen,DO)(15%、20%、25%、30%和40%)和发酵过程中葡萄糖质量浓度(0.5 g/L、2.5 g/L、5 g/L、7.5 g/L和10 g/L)对S.boulardii干质量的影响,确定高密度培养S.boulardii的最适条件。
1.3.6分析检测方法
菌体干质量(dry cell mass,DCM)的测定:取8 mL发酵液,4 000 r/min离心5 min,用去离子水清洗菌体2~3次,离心后弃上清液,于95℃条件下烘干至恒质量,计算菌体干质量。
发酵液葡萄糖质量浓度的测定:取8 mL发酵液,4 000 r/min离心5min,取上清液适当稀释,用SBA-40E生物传感分析仪测定其中葡萄糖的质量浓度。
2 结果与分析
2.1 ARTP诱变致死曲线的测定
根据1.3.2所述方法对S.boulardii进行ARTP诱变,得到致死率曲线,结果如图1所示。
由图1可知,等离子体对S.boulardii的杀伤有一个突变的过程,当ARTP处理时间<15 s时,S.boulardii的致死率不足20%;当ARTP处理时间为35 s,S.boulardii的致死率约为97.38%;40 s以后检测不到有活性的S.boulardii,此时致死率达到100%。为保持有一个较高的突变率,因此设定ARTP诱变时间为35 s,这与金丽华等[21-22]选择的诱变致死率基本一致。
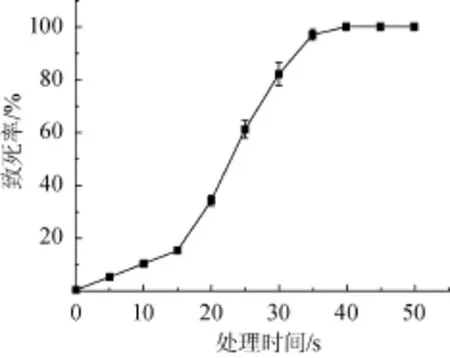
图1 布拉氏酵母菌的ARTP致死率曲线Fig.1 Lethal rate curve ofS.boulardiiby ARTP
2.2耐酸性S.boulardii突变株筛选
经ARTP诱变处理后,从酸性平板上共挑取1 025株S.boulardii进行二次初筛,共筛选出118株长势明显优于出发菌的突变株;经过复筛后得到11株S.boulardii突变株,其在pH 2.0条件下的存活率如表1所示。

表1 S.boulardii突变株在pH 2.0条件下培养6 h的存活率Table 1 Survival rate ofS.boulardiimutant strains under the conditions of pH 2.0 for 6 h
由表1可知,突变株YB-1、YB-2和YB-3在pH 2.0条件下培养6 h的存活率为分别29.63%、23.77%和50.83%,比出发菌株(存活率为11%)分别提高了169.36%、116.09%和462.09%。这三株菌对低pH的耐受性明显优于出发株与其他诱变株,因此选定这三株菌作为突变菌进行下一步研究。2.3S.boulardii突变株耐低pH稳定性的测定

图2 突变株在pH 2.0条件下的传代培养Fig.2 Generation culture of mutant strains under the conditions of pH 2.0
为确定诱变菌株的遗传稳定性,对筛选出的突变株YB-1、YB-2和YB-3进行20代的传代培养,每周传代一次,测定其存活率,结果如图2所示。
由图2可知,传代20次之后的突变株YB-1、YB-2和YB-3分别在pH 2.0条件下培养6 h后的存活率,分别是10.93%,23.77%和51.79%。突变株YB-1对低pH的耐受性变差,而突变株YB-2、YB-3对低pH的耐受性保持较好的遗传稳定性,说明ARTP诱变技术选育耐低pHS.boulardii突变株是可行的。突变株YB-3的在低pH条件下存活率较高且稳定性较好,因此,选用突变株YB-3进行后续发酵优化试验。
2.4 5 L发酵罐高密度培养S.boulardii条件的优化
2.4.1接种量的选择
接种量对高密度培养S.boulardii菌体干质量的影响,结果见图3。
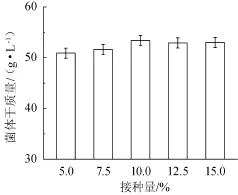
图3 接种量对布拉氏酵母菌菌体干质量的影响Fig.3 Effect of inoculum on dry cell mass ofS.boulardii
由图3可知,当接种量为5.0%~10.0%时,菌体干质量随接种量的增而增加;当接种量为10%时,所得到菌体干质量达到最大值,为53.41 g/L,继续增加接种量,菌体干质量稍有下降因此,选择接种量10%为宜。
2.4.2 pH的确定
pH对高密度培养S.boulardii菌体干质量的影响,结果见图4。

图4 pH对布拉氏酵母菌菌体干质量的影响Fig.4 Effect of pH on dry cell mass ofS.boulardii
由图4可知,S.boulardii的干质量随着pH的增高呈现出先升高后降低的趋势,其中在pH 5.5时,菌体干质量达到最高,为53.95 g/L。同时为了防止发酵初期pH过高发酵液染菌,在高密度培养初期采用pH 5.0,当培养至对数期时pH再改为5.5。
2.4.3溶氧水平的确定
溶氧水平对高密度培养S.boulardii菌体干质量的影响,结果见图5。
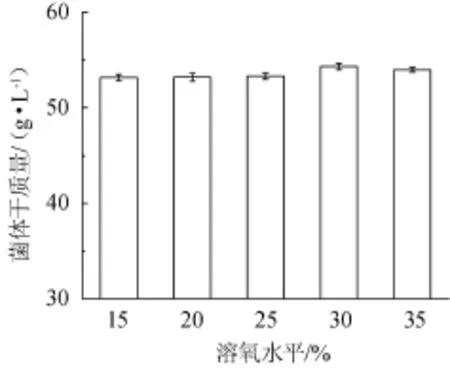
图5 溶氧水平对布拉氏酵母菌菌体干质量影响Fig.5 Effect of dissolved oxygen level on dry cell mass ofS.boulardii
由图5可知,S.boulardii干质量在一定范围内随着发酵液中溶氧水平的增加变化不显著,发酵结束之后,不同组别之间S.boulardii干质量差别不大,其中在溶解氧水平为30%时,菌体干质量达到最高,为54.33 g/L。因此溶氧水平选择30%为宜。
2.4.4发酵过程中葡萄糖质量浓度的测定
发酵过程中葡萄糖质量浓度对高密度培养S.boulardii菌体干质量的影响,结果见图6。
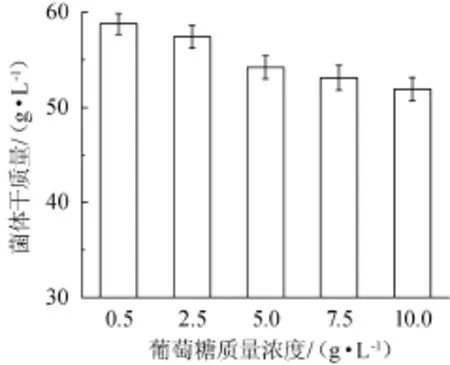
图6 发酵过程中葡萄糖质量浓度对布拉氏酵母菌菌体干质量影响Fig.6 Effect of glucose content during the fermentation on dry cell mass ofS.boulardii
由图6可知,研究发酵过程中葡萄糖的质量浓度对S.boulardii菌体干质量的影响发现,随着发酵液中葡萄糖含量的提高,S.boulardii菌体干质量逐渐减低,当葡萄糖浓度分别维持在0.5 g/L时,发酵结束时S.boulardii的干质量最高可达58.79 g/L。因而发酵过程中选择将葡萄糖的质量浓度维持在0.5 g/L左右。
2.4.6高密度培养S.boulardii的耐酸性测定
为了验证高密度培养对是否对S.boulardii突变株YB-3的耐酸性有影响,取上述优化高密度培养条件结束后的S.boulardii突变株YB-3于pH 2.0的沙氏液体培养基中,30℃、180 r/min振荡处理6 h后,计算其存活率。
结果表明,突变株YB-3的存活率为40.19%,相比于诱变结束时的存活率(50.83%),降低了26.47%。分析其原因可能是高密度发酵结束时,S.boulardii处于稳定期末开始进入衰亡期,此状态下的S.boulardii对外界环境的适应性较差,因而在低pH条件下的存活率有了明显的降低。后续研究表明,将此状态下的S.boulardii接种至新鲜沙氏液体培养基培养至对数期,测定其耐酸性,发现其在低pH条件下的存活率能恢复至50%的水平,说明突变株YB-3的耐酸性具有良好的稳定性。
3 结论
通过ARTP诱变的方法对S.boulardii进行了筛选,共获得了3株对低pH耐受性较好的菌株,其中突变株YB-3在pH 2.0条件下培养6 h的存活率为50.83%,相比于原始菌株的11%提高了462.1%,有效地提高了对低pH的耐受性,达到了本次试验的目的。
同时以诱变株YB-3为出发菌株优化了高密度培养S.boulardii的条件,最终确定液态高密度培养S.boulardii的条件为:接种量为10%,溶氧水平30%,发酵过程中葡萄糖质量浓度维持在0.5 g/L左右,发酵初期pH 5.0,当培养至对数期时pH改为5.5,30℃培养36 h。发酵结束时所得S.boulardii菌体干质量为58.79 g/L,比原始菌株提高了55.52%。
本研究筛选出了对低pH的耐受性较好的S.boulardii突变菌株,有助于提高S.boulardii在胃肠道中的存活率,对于其在养殖业上的应用具有深远的意义。
[1]MARTINS F S,VIEIRA A T,ELIAN S D A,et al.Inhibition of tissue inflammation and bacterial translocation as one of the protective mechanisms ofSaccharomyces boulardiiagainstSalmonellainfection in mice[J].Microbes Infect,2013,15(4):270-279.
[2]BUTS J P.Twenty-five years of research onSaccharomyces boulardii trophic effects:updates and perspectives[J].Digest Dis Sci,2009,54(1):15-18.
[3]CANANI R B,CUCCHIARA S,CUOMO R,et al.Saccharomyces boulardii:a summary of the evidence for gastroenterology clinical practice in adults and children[J].Eur Rev Med Pharmacol Sci,2011,15(7):809-822.
[4]SURAWICZ C M,ELMER G W,SPEELMAN P,et al.Prevention of antibiotic-associated diarrhea bySaccharomyces boulardii:A prospective study[J].Gastroenterol,1989,96(4):981-988.
[5]MOMBELLI B,GISMONDO M R.The use of probiotics in medical practice[J].Int J Antimicrob Ag,2000,16(4):531-536.
[6]BUTS J P,BERNASCONI P,VAERMAN J P,et al.Stimulation of secretory IgA and secretory component of immunoglobulins in small intestine ofratstreatedwithSaccharomycesboulardii[J].Digest Dis Sci,1990,35(2):251-256.
[7]CZERUCKA D,PICHE T,RAMPAL P.Review article:yeast as probiotics-Saccharomyces boulardii[J].Aliment Pharm Therap,2007,26(6):767-778.
[8]EDWARDS-INGRAM L,GITSHAM P,BURTON N,et al.Genotypic and physiological characterization ofSaccharomyces boulardii,the probiotic strain ofSaccharomyces cerevisiae[J].Appl Environ Microbiol,2007,73(8):2458-2467.
[9]MOEINI H,RAHIM R A,OMAR A R,et al.Lactobacillus acidophilusas a live vehicle for oral immunization against chicken anemia virus[J]. Appl Microbiol Biot,2011,90(1):77-88.
[10]GIANG H H,VIET T Q,OGLE B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with a complex of lactic acid bacteria alone or in combination withBacillus subtilisandSaccharomyces boulardii[J].Livest Sci,2012,143(2-3):95-103.
[11]朱建军,徐伟祺,邱怡芳,等.布拉迪酵母菌的作用机制及其在养猪生产中的应用[J].饲料博览,2010,(6):30-32.
[12]胡小媛,滕达,张勇,等.布拉酵母抗腹泻作用机制研究进展[J].中国饲料,2012(23):5-8.
[13]CORTHIER G,DUBOS F,DUCLUZEAU R.Prevention ofClostridium difficileinduced mortality in gnotobiotic mice bySaccharomyces boulardii[J].Can J Microbiol,1986,32(11):894-896.
[14]JUST I,SELZER J,WILM M,et al.Glucosylation of rho proteins by Clostridium difficiletoxin B[J].Nature,1995,375(6531):500-503.
[15]GENEROSO S V,VIANA M L,SANTOS R G,et al.Protection against increased intestinal permeability and bacterial translocation induced by intestinal obstruction in mice treated with viable and heat-killedSaccharomyces boulardii[J].Eur J Nutr,2011,50(4):261-26.
[16]杜晓蒙.益生菌布拉氏酵母培养及其微胶囊抗逆性研究[D].天津:天津科技大学,2014.
[17]HUDSON L E,FASKEN M B,MCDERMOTT C D,et al.Functional heterologous protein expression by genetically engineered probiotic yeastSaccharomyces boulardii[J].Plus One,2014,11(9):1-12.
[18]杜鹏,霍贵成.国内外益生菌制品发展现状[J].食品科学,2004,25(5):194-198.
[19]李琴,张世春,曾晓燕,等益生菌营养及保健作用[J].食品研究与开发,2004,25(2):106-109.
[20]ANIL K A,HARJINDER S.Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery[J].Trend Food Sci Tech,2007,18(5):240-251.
[21]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467.
[22]王方方,孙沛勇,银会娟,等.常压室温等离子体快速诱变酒精酵母及其突变株的特性研究[J].中国酿造,2013,32(10):117-119.
[23]楚杰,王子辉,刘可春,等.布拉酵母菌高生物量菌株的诱变及选育[J].饲料工业,2011,16(3):52-55.
[24]房贤坤,丛伟国,刘德林,等.布拉酵母高密度培养条件的研究[J].安徽农业科学,2012,40(23):11619-11620,11671.
Screening of an acid-resistantSaccharomyces boulardiiand optimization of its high density cultivation conditions
LI Feilong,CHEN Xiaohua,ZHENG Xin,XIE Yongzhen,TAN Zhilei,JIA Shiru*
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
Saccharomyces boulardiiis the only strain of yeast as clinical probiotic drugs for the treatment of intestinal diseases.As a microecology preparation,in order to ensure its biological effect,it must be able to maintain a certain number of viable bacteria in the gastrointestinal tract.Research showed that low pH was the most important factor affectingS.boulardiisurvival rate in the gastrointestinal tract.To improve the survival rate ofS.boulardiiin low pH condition,atmospheric and room temperature plasma(ARTP)was used forS.boulardiimutagenesis.Finally,three mutant stains with thelow pH-resistant were selected.The results of stability of the mutant strains resistant to low pH showed that after 20 times generation,mutant YB-3 had good genetic stability and its survival rate was 51.79%.In 5 L fermentor,the high density cultivation conditions of mutant YB-3 were optimized.The dry cell weight ofS.boulardiiobtained was 58.79 g/L,which was increased by 55.52%than that of the original strain.
Saccharomyces boulardii;atmospheric and room temperature plasma;high density cultivation;acid resistant
Q815
0254-5071(2016)07-0015-05
10.11882/j.issn.0254-5071.2016.07.004
2016-03-10
长江学者和创新团队发展计划资助(IRT1166)
李飞龙(1988-)男,硕士研究生,主要从事饲料添加剂方面的研究工作。
贾士儒(1954-)男,教授,博士,主要从事生物防腐剂、发菜、细菌纤维素等的研究工作。
