生香酵母筛选鉴定及其对辣椒酱发酵的影响
2016-09-18李梦雅邓毛程陈维新梁增章广东轻工职业技术学院广东广州510300
李梦雅,邓毛程,李 静,王 瑶,陈维新,梁增章(广东轻工职业技术学院,广东 广州 510300)
生香酵母筛选鉴定及其对辣椒酱发酵的影响
李梦雅,邓毛程*,李静,王瑶,陈维新,梁增章
(广东轻工职业技术学院,广东 广州 510300)
为了获得适用于辣椒酱发酵的生香酵母,从自然发酵辣椒酱中筛选优良菌种,并对菌种形态特征、生理生化特性、菌种发酵辣椒基料等进行了研究。经筛选,获得一株生香能力较强的菌株LA-Y09,该菌株被鉴定为鲁氏酵母(Saccharomycesrouxii)。菌种LA-Y 09的最适生长温度为28℃,在NaCl质量分数为12%的培养基中仍有较高菌数,说明其具有良好的耐盐特性,在质量分数为8%的辣椒基料中能够生成多种呈现蜜香和果香的香气成分,使辣椒发酵醪香气得到明显提升。
生香酵母;辣椒酱;筛选;耐盐
辣椒果实味辛香、性温热,含有丰富的辣椒碱、辣椒色素、维生素、有机酸和矿物质等成分,是兼有营养价值和调味作用的蔬菜[1]。我国辣椒的种植面积仅次于白菜类蔬菜,已成为我国第二大蔬菜作物,现有年产量达2 800万t,约占全球产量的46%左右[2]。随着世界各地及各应用领域的需求量增大,辣椒除了直接被鲜食以外,还被加工成辣椒干、辣椒粉、辣椒油、辣椒酱、辣椒碱和辣椒色素等产品[3]。其中,辣椒酱是人们最常见的一种佐餐调味品,产品种类繁多,风味多样,大致分为两类:一类是利用辣椒及其制品为基料,配以蔬菜及其制品或动物肉品、水产品、植物油、香辛料及其他调味辅料而制成[4];另一类是利用微生物对辣椒或其酱料进行发酵而制成,或再添加其他辅料调制而成。
发酵型辣椒酱制作技术源于传统的蔬菜腌制,经微生物(主要是乳酸菌)自然发酵后,产品酸辣可口,风味独特,深受消费者青睐。但是,传统的发酵辣椒酱的生产周期长,参与自然发酵的微生物复杂,亚硝酸盐和黄曲霉毒素等有害物质的积累不易控制[5-6],导致产品品质不稳定。为了提高发酵型辣椒酱的生产效率和有效控制有害物质的积累,人工利用乳酸菌纯种的强化发酵技术已得到较深入研究及工业化应用[7]。与自然发酵的辣椒酱相比,单一乳酸菌强化发酵所得的辣椒酱在香气方面却相对逊色。以生香微生物与乳酸菌组合,对辣椒酱进行混合菌强化发酵,是提高产品香气风味的有效方法,但这方面的研究报道尚少。本研究通过筛选获得生香酵母,并将其应用于辣椒酱发酵试验,期望能够为开展混合菌强化发酵辣椒酱研究提供优良菌种,为发酵型辣椒酱生产提供参考。
1 材料与方法
1.1料与试剂
1.1.1料
自然发酵的辣椒酱:广东茂德公食品集团有限公司;鲜红辣椒:市售;母膏、蛋白胨、麦芽汁等生化试剂:广东环凯微生物科技有限公司;蔗糖、K2HPO4·3H2O、KH2PO4、NaCl、MgSO4·7H2O等均为国产分析纯。
1.1.2养基
富集培养基[8]:蔗糖50g/L,酵母膏10g/L,蛋白胨10 g/L,K2HPO4·3H2O 1 g/L,KH2PO41 g/L,NaCl 100 g/L,氯霉素0.4 g/L,调节pH 5.5。
平板培养基[8]:蔗糖20g/L,酵母膏10 g/L,蛋白胨5 g/L,NaCl10 g/L,氯霉素0.4 g/L,琼脂20 g/L,调节pH 5.5。将平板培养基去除NaCl和氯霉素,作为斜面培养基。
种子培养基:蔗糖20 g/L,酵母膏5 g/L,蛋白胨5 g/L,K2HPO4·3H2O 1 g/L,KH2PO41 g/L,MgSO4·7H2O 0.4 g/L,pH 5.5。
筛选培养基的成分同种子培养基,但蔗糖质量浓度调节至50 g/L。
发酵培养基:200 g新鲜辣椒,经清洗、打浆,加入8 g蔗糖、1 g酪蛋白胨和2 g麦芽汁浸膏,自然pH,混匀后装入1 000m L三角瓶,121℃灭菌20min,冷却后备用。
1.2器与设备
250B型生化培养箱:江苏省金坛市环宇科学仪器厂;BSD150型振荡培养箱:上海博讯实业有限公司;S-3000N型扫描电镜:日本日立公司;SW-CJ-2FD型超净工作台:苏州安泰空气技术有限公司;A 200型基因扩增仪:杭州朗基科学仪器有限公司;RDY-SP1Z型核酸电泳仪:北京荣阳经典科技有限公司;Agilent7890GC/5977AMS气相色谱-质谱联用仪:美国Agilent公司。
1.3法
1.3.1种分离
选择香气浓郁的自然发酵辣椒酱,称取5 g,接入装有200m L富集培养基的三角瓶,28℃、200 r/min振荡培养20 h,再吸取5m L培养液转接到新的富集培养基中,置于同样条件下培养,再将培养液进行稀释,涂布于平板培养基上,经培养,挑取表面湿润、光滑的单个菌落,接入斜面培养基,培养后保藏于4℃冰箱,备用。
1.3.2香微生物的筛选
将平板分离所得的各菌株,分别接入种子培养基,28℃、200 r/min振荡培养20h。然后,取5m L种子液接入100m L的筛选培养基进行振荡培养24 h,培养条件同种子培养。最后,通过嗅觉对培养液进行感官评定,辣椒酱品质的优劣很大程度取决于气味,嗅觉测定是通过评鉴员嗅觉器官来测评,评价时香气主要分为正常气味和不正常气味,并选取大多数评鉴员偏好的培养液样品,进一步测定其总酯。测定总酯时,取100m L发酵液,加入等体积的纯净水,利用玻璃蒸馏装置蒸出100m L馏出液,采用回流皂化法测定馏出液的总酯[9],含量以乙酸乙酯计。根据感官评定和总酯测定的结果,优选生香菌种。
1.3.3酯含量的计算
馏出液中总酯含量(以乙酸乙酯计)的计算公式如下:
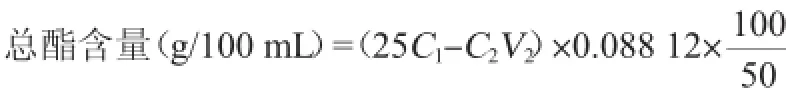
式中:25为加入氢氧化钠溶液的体积,mL;C1为氢氧化钠溶液的浓度,mol/L;C2为滴定用盐酸溶液的浓度,mol/L;V2为滴定用盐酸溶液的消耗体积,mL;0.088 12为乙酸乙酯的毫摩尔质量,g/mmol。
1.3.4种鉴定
利用显微镜观察优选菌种的形态,并利用扫描电镜对菌体形态进行观察。参照文献的生理生化试验方法[10],对优选菌种进行生理生化特征分析。利用18S rDNA鉴定方法进行分子生物学鉴定,PCR扩增的引物为通用引物[11]:5′-GTAGTCATATGCTTGTCTC-3′和5′-TCCGCAGGTTCACCTACGGA-3′,PCR反应体系为20μL,包括:5× PCR缓冲液4μL,dNTP混合物1.6μL,引物1和引物2各1.0μL,Taq DNA聚合酶0.4μL(1.25U/μL),模板DNA 1μL,ddH2O补足至20μL。PCR反应条件为98℃、3min;98℃、10 s;55℃、15 s;72℃、90 s;31个循环,72℃延伸10min。PCR产物送至北京华诺时代科技有限公司测序,在NCBI(http://blast.ncbi.nlm.nih.gov)中对拼接序列进行同源性检索,并利用软件MEGA 5.1构建优选菌种的系统发育树。
1.3.5同温度下的生长试验
准备若干瓶发酵培养基,各接入10m L种子液,分别置于26℃、28℃、30℃、32℃和200 r/min条件下进行振荡培养36 h。在培养过程中,每隔6 h取样,进行梯度稀释,涂布于平板培养基上,置于28℃培养48 h,然后进行菌落计数,每克发酵醪所含菌数的表示单位为CFU/g。根据菌体生长情况,优选菌种的最佳生长温度。
1.3.6同盐度条件下的生长试验
在发酵培养基中,分别加入质量分数4%、8%、12%和16%的氯化钠,并以无氯化钠的发酵培养基为对照,按上述方法接入种子液,置于最佳的生长温度下进行振荡培养24 h。然后,按上述的稀释涂布法测定发酵醪的酵母菌数。根据菌体生长情况,分析菌种的耐盐性。
1.3.7酵辣椒酱的挥发性成分分析
在优选盐度和温度下,按上述方法,利用优选菌种对辣椒基料进行发酵3 d,然后利用气相色谱-质谱仪对发酵醪的挥发性成分进行测定。测定时,采用固相微萃取法收集样品中的挥发性物质,即称取6g样品密封于20m L顶空瓶中,放入三合一自动进样器的样品盘中,将带有美国Supelco公司65μm PDMS/DVB SPME萃取头的固相微萃取针穿过密封塞,插入顶空瓶中,于50℃条件下萃取40min,取出固相微萃取针迅速插入气相色谱进样口中,在250℃条件下解吸5m in,进行气相色谱-质谱(gaschromatography-massspectrometer,GC-MS)测定[12]。
参照文献选择气相色谱条件和质谱条件[13]。气相色谱条件:AB-5MS(30m×0.25mm×0.25μm)弹性石英毛细管柱;载气为He,流速为0.8m L/min;程序升温,以8℃/min的升温速度从50℃升至270℃,保持5.5min;进样口温度为250℃,进样量为1.0μL。质谱条件:电子轰击离子源,离子源温度230℃,四极杆温度150℃,电子能量70 eV,电子倍增器电压1 500 V,质量扫描范围29~550 amu。
2 结果与分析
2.1种筛选
从分离平板上挑取了38个单菌落,通过摇瓶发酵和嗅觉评定,发现发酵液香气较强的菌株有5株,分别为LA-Y04、LA-Y09、LA-Y16、LA-Y18、LA-Y21。对发酵液测定总酯,结果如表1所示。在5株生香菌中,菌株LA-Y09产酯最大,其发酵液具有浓郁的果香和蜜香,适宜用于辣椒酱发酵,故被确定为进一步研究的菌种。
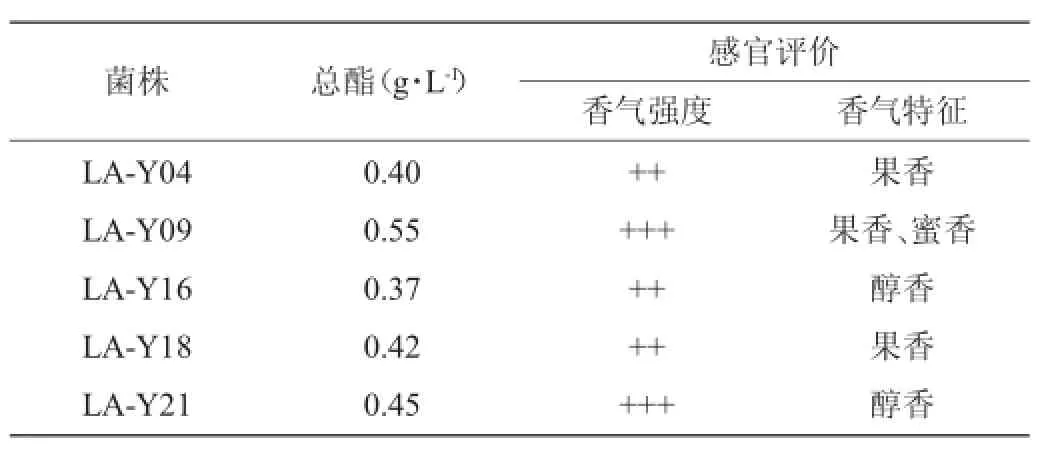
表1 5株菌的香气评价和产酯情况Table 1 Flavorassessment and totalester yield of five strains
2.2株特征及鉴定
2.2.1株形态特征
在分离平板上,菌株LA-Y09的菌落表面湿润、光滑、白色,呈边缘整齐的圆形。在扫描电镜下观察,结果如图1所示。由图1可知,菌体形态呈椭圆形,短轴直径约为2.5~3.5μm,有子囊孢子的形成。

图1 菌种LA-Y09的扫描电镜图(×4 000)Fig.1 SEM photographs of cellm orphology of strain LA-Y09(×4 000)
2.2.2株生理生化特征
菌种LA-Y 09的主要生理生化特征如表2所示,由表2可知,菌种可发酵D-葡萄糖、麦芽糖、蔗糖,可同化D-山梨醇同化、D-甘露醇和乙胺同化,不能发酵D-半乳糖、乳糖、海藻糖、蜜二糖、纤维二糖、棉子糖和松三糖等,不能以硝酸盐、亚硝酸盐和尿素为唯一碳源。
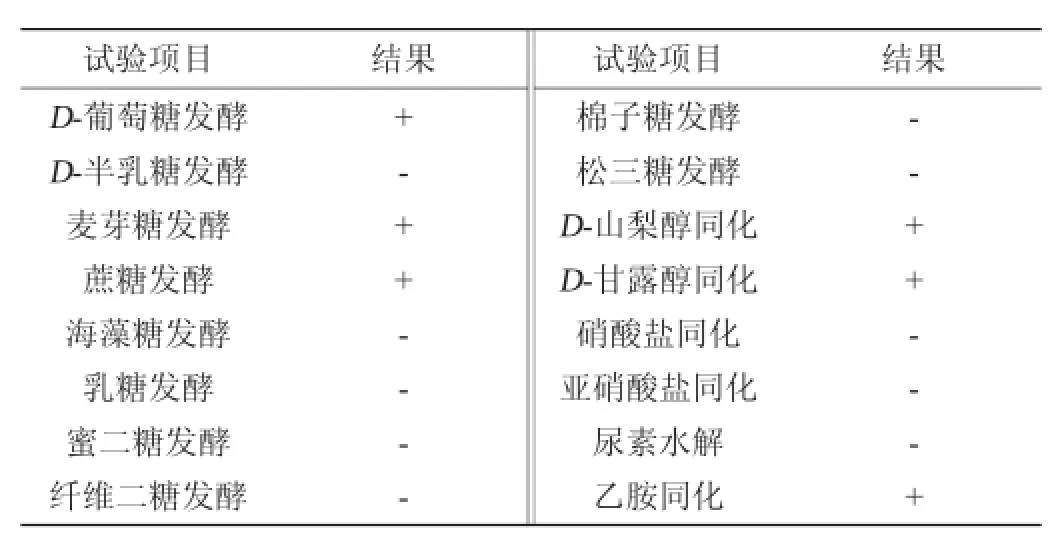
表2 菌种LA-Y09的生理生化鉴定结果Table 2 Physiologicaland biochem ical identification results of strain LA-Y09
2.2.3株分子鉴定
菌株的PCR扩增电泳图结果见图2。利用软件MEGA5.1以Neighbor-joining法对菌种LA-Y09构建系统发育树,结果如图3所示。
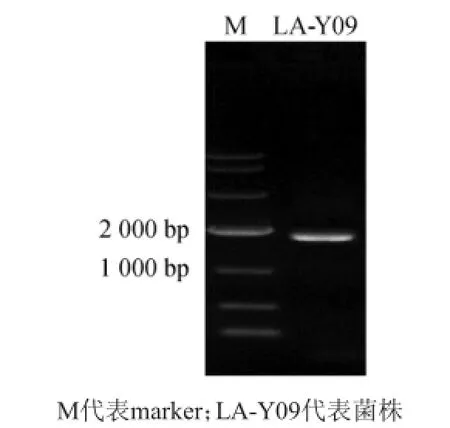
图2菌种LA-Y09的18S rDNA PCR扩增电泳图Fig.2 The 18S rDNA PCR am plification electrophoretogram of strain LA-Y09

图3 菌种LA-Y09的系统发育树Fig.3 The sequence phy logenetic tree of strain LA-Y09
由图2可知,菌株LA-Y 09的18S rDNA序列长度为1 706 bp,在NCBI中进行同源性比对,与鲁氏酵母(Zygosaccharomyces rouxii)IFO 0494(登录号:AY227007.1)的亲缘关系最为接近,同源性达95%。根据上述特征分析,菌种LA-Y09被确定为鲁氏酵母菌(Zygosaccharomyces rouxii),但其与NCBI数据库中菌种的最高同源性仅为95%,可能是新发现的鲁氏酵母菌,有待进一步证实。
2.3度对菌种生长的影响
在不同温度下,菌种LA-Y09的生长情况如图4所示。菌种LA-Y09在以辣椒为基料的培养基中生长,培养温度对菌体生长速度和生物量均有影响。当培养温度为28℃、30℃和32℃时,菌种LA-Y 09都在24 h达到生长稳定;当培养温度为26℃时,菌种LA-Y09生长速度稍慢,至30 h才达到稳定。在上述不同温度下,28℃条件下培养的菌体数最大,达到4.98×108CFU/g,其对数值为8.69。上述结果表明,菌种LA-Y 09生长的最适温度为28℃,这与其他文献报道是一致的[14]。
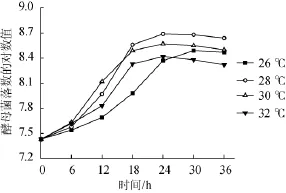
图4 不同温度对菌体生长的影响Fig.4 Effectof different tem perature on strain growth
2.4度对菌种生长的影响
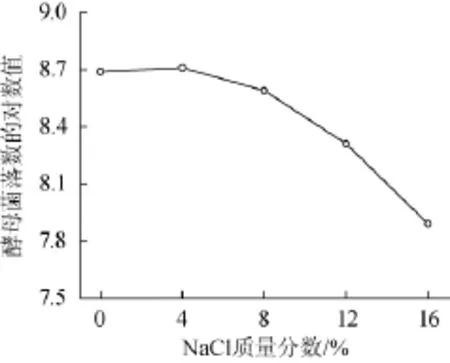
图5 不同盐度下菌体生长情况Fig.5 Effectof different salt concentration on strain grow th
在不同盐度的培养基中,菌种LA-Y09的生长情况如图5所示。当培养基的NaCl含量为4%时,菌体数略高于对照培养基,这表明质量分数4%NaCl对菌种LA-Y09生长无影响。随着培养基中NaCl含量继续增大,菌体生长受到抑制的程度也逐渐增大。当NaCl质量分数增加至12%时,菌体数最大值仍可达108CFU/g的数量级(对数值8.69);但是,质量分数16%NaCl条件下的菌体数只能达到107CFU/g的数量级(对数值<7.88),说明此盐度的抑制作用较为严重。据文献报道[15],当NaCl质量分数10%时,一些耐盐酵母虽可存活,但其生长已受到明显的抑制。在本实验中菌种LA-Y 09在质量分数达12%的培养基中仍有较高菌体数,因此该菌株具有较强的耐盐性,适合用于NaCl质量分数低于12%的调味品的发酵生产。
2.5椒酱发酵的香气成分分析
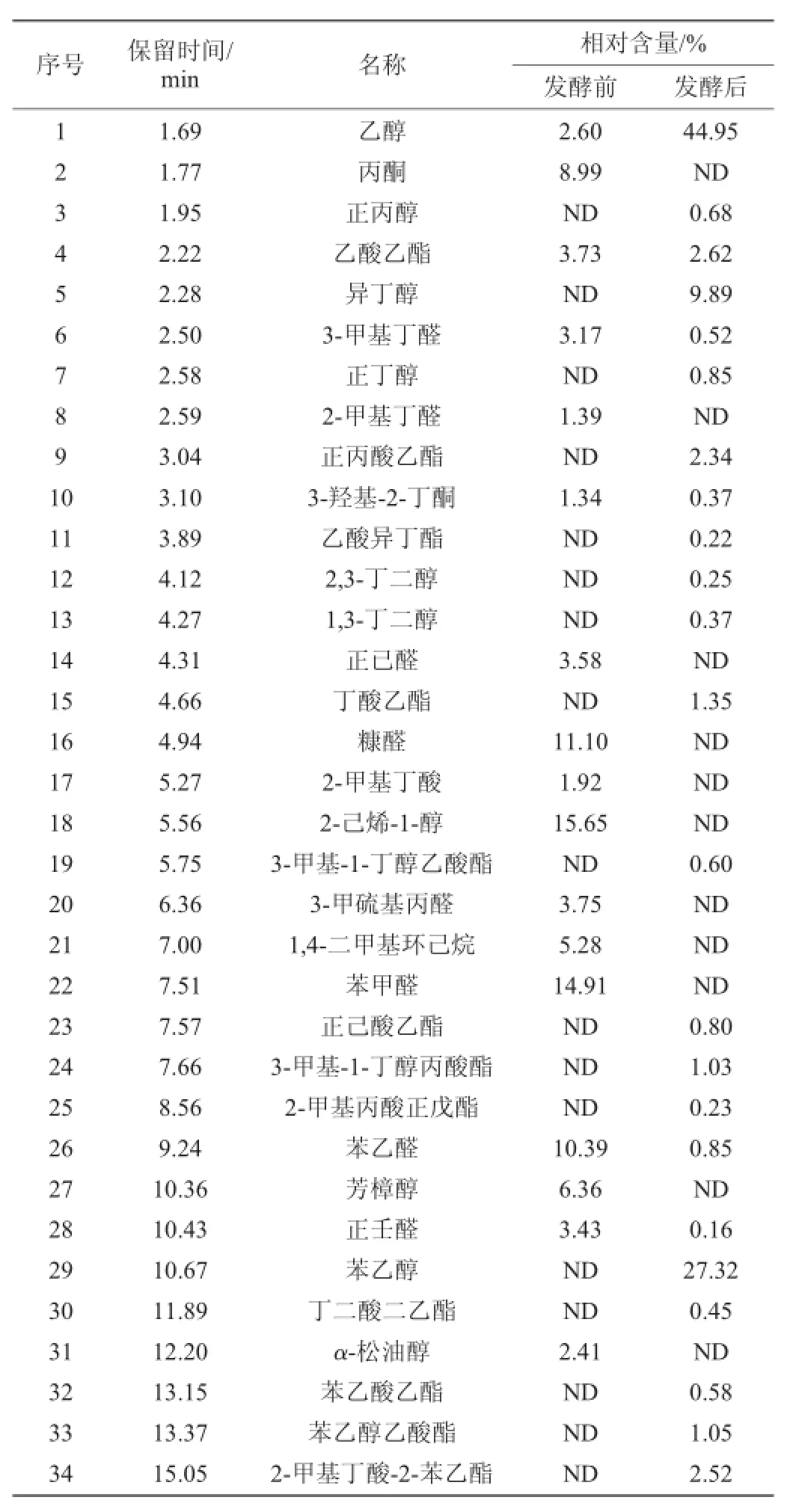
表3 辣椒基料发酵前后的主要挥发性成分比较Table 3 Com parison ofmain volatile com ponents in chillisubstrate before and after ferm entation
利用菌种LA-Y 09在含8%NaCl的发酵培养基中进行发酵,发酵前后的主要挥发性成分如表3所示。由于菌种LA-Y09利用了蔗糖和辣椒酱一些组分进行生长和代谢,导致发酵前后的培养基中主要挥发性成分有很大差异。辣椒基料中丙酮、糠醛、2-己烯-1-醇、1,4-二甲基环己烷、苯甲醛、苯乙醛、芳樟醇和正壬醛等挥发性组分含量较高,占总挥发成份比例76.11%,经过发酵变得微量或未能检出。新生成的挥发性成分包括正丙醇、异丁醇、正丁醇、正丙酸乙酯、乙酸异丁酯、2,3-丁二醇、1,3-丁二醇、丁酸乙酯、3-甲基-1-丁醇乙酸酯、正己酸乙酯、3-甲基-1-丁醇丙酸酯、2-甲基丙酸正戊酯、苯乙醇、丁二酸二乙酯、苯乙酸乙酯、苯乙醇乙酸酯和2-甲基丁酸-2-苯乙酯等,占总挥发成份比例50.53%。发酵醪的香气特征是各种挥发性成分协同作用的效果,其中苯乙醇、苯乙酸乙酯和苯乙醇乙酸酯呈现较明显的蜜香特征,占总挥发成份比例28.95%。乙酸乙酯、正丙酸乙酯、乙酸异丁酯、丁酸乙酯、正己酸乙酯等酯类对果香特征均具有不同程度的贡献。
3 结论
从自然发酵的辣椒酱中,筛选获得1株生香能力较强的菌种LA-Y09。经过形态特征、生理生化特征和18S rDNA分子生物学特征等方面分析,该菌种被鉴定为鲁氏酵母(Saccharomycesrouxli)。菌种LA-Y09的最适生长温度为28℃,并在含12%NaCl的发酵培养基中生长良好。菌种LA-Y09在含8%NaCl的发酵培养基中、28℃发酵3 d后,发酵醪香气浓郁,发酵前后的挥发性组分有很大差别,新生成了多种呈现蜜香和果香的香气成分,如苯乙醇、苯乙酸乙酯和苯乙醇乙酸酯,占总挥发成份比例28.95%。菌种LA-Y09具有良好的生香特性和耐盐特性,有望在辣椒酱发酵中得到应用,但仍需进一步优化发酵工艺。
[1]刘易伟,胡文忠,姜爱丽,等.辣椒的营养价值及其加工品的研发进展[J].食品工业科技,2014,35(15):377-381.
[2]马艳青.我国辣椒产业形势分析[J].辣椒杂志,2011(1):1-5.
[3]姚明华,尹延旭,王飞,等.中国加工辣椒育种现状与发展对策[J].湖北农业科学,2015,54(11):2569-2573.
[4]罗静,龚丽,车振明.辣椒酱发酵过程中主要质量指标变化规律的研究[J].食品与发酵工业,2013,49(2):47-49.
[5]梁单,杨富民,潘玲,等.庆阳地区自然发酵辣椒酱优势菌种筛选及鉴定[J].甘肃农业大学学报,2014(6):162-167.
[6]李玲玲,仇厚援,麦力文,等.黄灯笼辣椒酱中腐败菌的分离鉴定[J].中国调味品,2013,38(12):75-78.
[7]胡博涵,吴晖,赖富饶,等.耐盐乳酸菌的筛选及其在剁辣椒发酵中的应用[J].食品与机械,2014,30(1):51-54.
[8]陈维新,李静,王瑶,等.一株乙酸乙酯高产酵母的筛选及其特性研究[J].食品与发酵工业,2015,41(9):87-90.
[9]邓毛程,李静,方俊鹏,等.甘蔗汁发酵产酯的研究[J].中国酿造,2011,30(3):82-84.
[10]BARNETT JA.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
[11]柴洋洋,葛菁萍,宋刚,等.传统发酵豆酱中酵母菌的分离、筛选及功能酵母的鉴定[J].中国食品学报,2013,13(3):183-188.
[12]李学伟,陈强,朱新贵.添加生香酵母改善酱油风味的研究[J].中国酿造,2014,33(3):121-124.
[13]赵丽云.天然酱醪中生香酵母的分离鉴定及香气特征分析[J].食品与机械,2012,28(4):11-14.
[14]康远军,李欣,陈雄,等.鲁氏酵母发酵培养基及发酵条件的优化[J].中国调味品,2015,40(7):61-65.
[15]连鑫,杨锡洪,解万翠,等.中国传统虾酱中产香酵母的分离鉴定及其耐盐性分析[J].现代食品科技,2014,30(7):92-97.
Screening and identification ofa flavor-producing yeastand its influenceon chillisauce fermentation
LIMengya,DENGMaocheng*,LIJing,WANG Yao,CHENWeixin,LIANG Zengzhang
(Guangdong Industry Technical College,Guangzhou 510300,China)
To obtain flavor-producing yeast for chillisauce fermentation,strains were screened from the natural fermented chilli sauce.Meanwhile,themorphological characteristics,grow th characteristicsof the strain and culturemedia for strain fermentation were also studied.A flavor-producing yeast LA-Y09was isolated and identified asSaccharomyces rouxii,and theoptimal culture temperature foryeast LA-Y09was28℃.Therewasstilla high numberofbacteria in culturemedium containing NaCl12%,which indicated that LA-Y09 showed thesalt-tolerance.In addition,avarietyofhoney and fruitaroma componentswereproduced in chillisubstratew ith NaCl8%,andm ixing flavorof the fermented chillimashwasimproved obviously.
flavor-producing yeast;chillisauce;screening;salt tolerant
TS26
0254-5071(2016)01-0100-05
10.11882/j.issn.0254-5071.2016.01.022
2015-11-22
2015年度广东大学生科技创新培育专项资金重点项目(156021);湛江市科技计划项目(2014A 03001);创新强校工程专项资金项目(1A20201、1A10205、1A20105、1A30205);广东高校特色调味品工程技术开发中心建设项目(GCZX-B1103)
李梦雅(1994-),女,大专生,研究方向为生物工程。
邓毛程(1971-),男,教授,博士,研究方向为生物工程。
