木聚糖酶产生菌Gh-5培养基配方及发酵条件的优化
2016-09-18杨子荣北方民族大学生物科学与工程学院宁夏银川750021
杨子荣,王 静,许 萌,张 琇(北方民族大学 生物科学与工程学院,宁夏 银川 750021)
木聚糖酶产生菌Gh-5培养基配方及发酵条件的优化
杨子荣,王静,许萌,张琇*
(北方民族大学 生物科学与工程学院,宁夏 银川 750021)
研究培养基组分与发酵工艺条件对试验菌株Gh-5产木聚糖酶的发酵影响,并对木聚糖酶的酶学性质进行初步研究。结果表明,该菌最适发酵产酶培养基组分为甘露糖15 g/L,氯化铵10 g/L,ZnSO40.3 g/L,KH2PO40.5 g/L;最适发酵条件为温度37℃;pH值为8.0;接种量14%;发酵培养生长周期36 h。木聚糖酶产生菌株Gh-5发酵优化后的酶活力为114.64U/mL,较优化前38.02U/mL提高了201.53%。木聚糖酶酶学性质研究结果表明,木聚糖酶酶活最适pH值为8.0;最适温度为65℃;Zn2+对木聚糖酶酶活有较好促进作用。
木聚糖酶;分离筛选;发酵优化;酶学性质
木聚糖(xylan)是存在于植物细胞壁中的异质多糖,作为植物半纤维素的主要组成成分,大约占植物含量的1/3[1]。木聚糖是除了纤维素之外自然界中含量最丰富的多糖[2]。我国是农业生产大国,小麦、水稻、玉米、高粱等收获后所剩秸秆既可以作为家畜的主要饲料食用[3],又可以经发酵生产能源乙醇等。秸秆中富含木聚糖,不易直接利用,经木聚糖酶作用,可降解为可以直接利用的糖类如木糖、低聚木糖等。木聚糖酶是一类重要的木聚糖苷水解酶[4],来源及其广泛。已报道的能够产木聚糖酶的微生物有细菌、放线菌、真菌和酵母[5]。国内研究木聚糖酶最多的是木霉、青霉、黑曲霉和棒曲霉[6]。
木聚糖酶在饲料工业、造纸工业、能源工业以及食品医疗领域具有重要应用价值,作为一种多酶体系,其酶学性质、分子结构、催化机制等一直是科学领域研究的热点[7-11]。然而,目前的研究大多停留在实验室,能真正投入工业生产的菌种寥寥无几。滕超等[12]报道,一株嗜热踝节菌生产耐热木聚糖酶,在50℃培养7 d木聚糖酶酶活力高达1 002.86U/m L,但由于发酵时间长和发酵温度高并不利于工业生产发酵。周秀梅[13]报道黑曲霉(Aspergillus niger ZU-06)45℃发酵5 d后,酶活力可达516U/m L,虽然菌株产酶活力较高,但同样具有发酵时间较长的缺点。
因此,本研究通过对土壤中筛选出能发酵产生木聚糖酶的野生菌株进行培养基组成及发酵条件优化,并对木聚糖酶的酶学性质进行初步研究,以期得到高效率产木聚糖酶的发酵体系,为今后菌株大规模降解秸秆,发酵生产乙醇提供前期实验基础。
1 材料与方法
1.1料与试剂
1.1.1株
菌株Gh-5:本实验室分离自贵州黄平县枫树下土样,作为本研究实验菌株。
1.1.2学试剂
可溶性淀粉、K2SO4、K2HPO4、KH2PO4、MgSO4·7H2O、NaCl、FeSO4·7H2O、琼脂、蛋白胨、酵母浸粉、麦芽糖、葡萄糖、蔗糖、甘露糖、牛肉浸粉、(NH4)2SO4、NH4Cl、NH4NO3、尿素、CaSO4、CuSO4、Fe2(SO4)3、ZnSO4、MnSO4、(Na)2SO4,所有试剂均为国产分析纯。
1.1.3养基
种子培养基:可溶性淀粉20 g/L;KNO31 g/L;K2HPO40.5 g/L;MgSO4·7H2O 0.5 g/L;NaCl 0.5 g/L;FeSO4·7H2O 0.01 g/L;琼脂15 g/L;pH 7.2~7.4,高温灭菌20m in。
发酵培养基:木聚糖10g/L;酵母膏5g/L;MgSO4·7H2O 0.2 g/L;KH2PO40.5 g/L;pH 8.0。
1.2器与设备
LRH-250恒温培养箱:上海一恒精密仪器有限公司;D-37520高速离心机:美国Sigma公司;UV1102II紫外分光光度计:天美(中国)科学仪器有限公司;LDZX-50KB立式压力蒸汽灭菌器:上海申安医疗器械厂;ZWY-100H恒温培养振荡器:上海智城分析仪器制造有限公司;JA5003B电子天平:上海精科天美科学仪器有限公司;Five Easy-台式pH计:梅特勒-托利多国际股份有限公司。
1.3验方法
1.3.1聚糖酶活力的测定
将斜面培养的菌株接种于25m L种子培养液,20℃、180 r/min振荡培养18 h后,吸取1m L接种于25m L发酵培养基(25m L/250m L),37℃、180 r/min继续振荡培养48 h,10 000 r/min离心5min,上清液即为粗酶液[14]。
采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定粗酶液的酶活力,酶活力测定、标准曲线的制作及酶活力的计算参照文献[15]。
每分钟从质量浓度为5mg/m L的木聚糖溶液中降解释放1μmol木糖所需要的酶量,定义为一个酶活力单位(U)[15]。
1.3.2养基配方优化
以OD540nm值及酶活力作为考察指标,分别添加质量浓度为10 g/L碳源(木聚糖、麦芽糖、木糖、葡萄糖、蔗糖、淀粉、甘露糖);质量浓度为5 g/L氮源(牛肉浸粉、蛋白胨、酵母浸粉、硫酸铵、氯化铵、硝酸铵、尿素);质量浓度为0.2 g/L金属离子(K+、Ga2+、Cu2+、Mg2+、Fe2+、Zn2+、Mn2+),对产酶菌株发酵培养基配方进行优化[16]。
以OD540nm值及酶活力作为考察指标,分别设定为碳源为(2.5g/L、5g/L、10g/L、15g/L、20g/L)、氮源为(2.5g/L、5g/L、 10g/L、15g/L、20g/L)及金属离子为(0.1 g/L、0.2g/L、0.3g/L、0.4 g/L、0.5 g/L),进行单因素试验,确定碳源、氮源及金属离子的最佳添加量。
在单因素试验基础上,固定KH2PO4添加量为0.5 g/L,pH值为8.0。以OD540nm值及酶活力为参考指标,采用L9(33)正交试验设计对菌株产酶培养基配方进行优化,正交试验因素与水平见表1。

表1 培养基配方优化正交试验因素与水平Table 1 Factors and levels of orthogonalexperiments formedium formu la optimization
1.3.3酵条件优化
在优化发酵培养基组成的基础上,分别从初始pH值(3、4、5、6、7、8、9、10、11)、接种量(2%、6%、10%、14%、18%),发酵温度(30℃、35℃、37℃、45℃、50℃)、发酵时间(6 h、12 h、18 h、24 h、30 h、36 h、42 h、48 h、54 h、60 h、66 h、72 h、78 h)进行发酵条件优化。
1.3.4学性质研究
pH值对酶活性的影响:分别取pH值为5.0、6.0、6.5、7.0、8.0、9.0的乙酸-乙酸钠缓冲液(0.1mol/L)配制木聚糖底物,测定酶活。
温度对酶活性的影响:分别在50℃、55℃、60℃、65℃、70℃、75℃条件下,测定酶活。
金属离子对酶活的影响:测定分别含有0.001mol/L的Mg2+、Zn2+、Ca2+、Cu2+、Na+、Fe2+、Fe3+和K+底物溶液的酶活,以不含金属离子的底物溶液测定的酶活为对照,研究金属离子对酶活的影响。
2 结果与分析
2.1养基配方优化
2.1.1源、氮源及金属离子对发酵的影响
碳源、氮源及金属离子对发酵的影响,结果见表2。
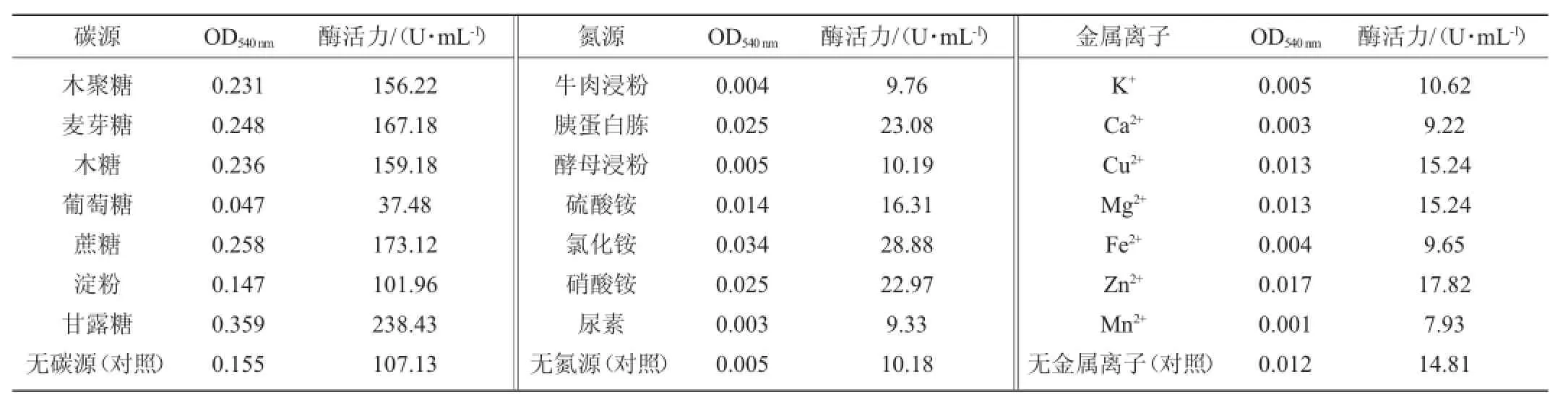
表2 碳源、氮源及金属离子对发酵产酶的影响Table 2 Effects of carbon sources,nitrogen sources and metal ions on xylanase production
由表2可知,菌株Gh-5能够利用多种碳源,其中对甘露糖利用率最高,产酶最多,酶活可达238.43U/m L此外,甘露糖对Gh-5的生长最为有利,生物量最高,OD540nm达0.359。因此,甘露糖既促进菌株Gh-5的生长又使其产酶最多,为最佳碳源。
由表2可知,菌株Gh-5对氯化铵、胰蛋白胨和硝酸铵的利用都比较好,其中,以氯化铵为氮源,酶活力可高达28.88U/m L,生物量最高,OD540nm达0.034。因此,氯化铵既促进菌株Gh-5的生长又使其产酶最多,为最佳氮源。
由表2可知,Zn2+、Mg2+、Cu2+均具有促进菌株产酶的作用,其中Zn2+对菌株生物量及产酶促进效果最好,酶活17.82U/m L,OD540nm达0.017。因此,Zn2+为培养基中最佳的金属离子。
2.1.2露糖、氯化铵及硫酸锌添加量对发酵的影响
甘露糖、氯化铵及硫酸锌添加量对发酵的影响,结果见表3。
由表3可知,菌株Gh-5的生物量及产酶随培养基中甘露糖、氯化铵、硫酸锌添加量的升高呈现先增加后降低的趋势。当甘露糖添加量为15 g/L时,菌株具有最大生物量及最高酶活,分别达0.268、107.23U/m L;氯化铵添加量为10 g/L时,菌株具有最大生物量及最高酶活,分别达0.135、54.21U/m L;当硫酸锌添加量为0.4 g/L时,菌株均具有最大生物量及最高酶活,分别达0.122、48.82U/m L;因此,甘露糖、氯化铵及硫酸锌最佳添加量分别为15g/L、10g/L及0.4g/L。
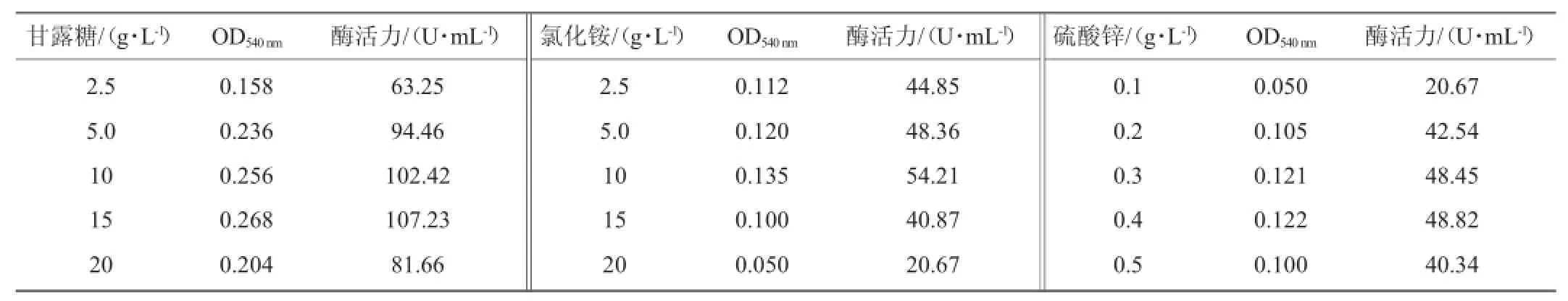
表3 甘露糖、氯化铵及硫酸锌添加量对发酵产酶的影响Table 3 Effects ofmannose,ammomnia chloride and ZnSO4addition on xylanase production
2.2养基配方优化正交试验
在单因素试验基础上,固定KH2PO4为0.5 g/L,pH值为8.0。以OD540nm值及酶活力为评价指标,采用L9(33)正交试验设计对菌株产酶培养基配方进行优化,正交试验结果与分析如表4所示。
由表4可知,以OD540nm作为评价指标,对结果影响顺序由小到大顺序为A>B=C,即甘露糖添加量>硫酸锌添加量=氯化铵添加量,发酵培养基最佳组合是A3B3C3,即甘露糖15 g/L、氯化铵10 g/L、硫酸锌0.5 g/L。以酶活力作为评价指标,对结果影响顺序由小到大顺序为A>B=C,即甘露糖添加量>硫酸锌添加量=氯化铵添加量,发酵培养基最佳组合是A3B3C3,即甘露糖15 g/L、氯化铵10 g/L、硫酸锌0.5 g/L。综合考虑,最终确定最佳发酵培养基组合为9号试验组,即甘露糖15 g/L、氯化铵10 g/L、硫酸锌0.5 g/L,KH2PO40.5 g/L。在此最佳条件下,OD540nm为0.064,酶活力为48.44U/m L。
2.3酵条件优化
2.3.1始pH值对产酶菌株Gh-5发酵的影响
不同初始pH对产酶菌株Gh-5发酵的影响,结果见图1。
由图1可知,随着初始pH值增加,产酶菌株Gh-5发酵产酶活力先升高后降低。在初始pH值为8.0时,菌株产酶活最高,达44.47U/m L。因此,菌株Gh-5发酵最适初始pH值为8.0。
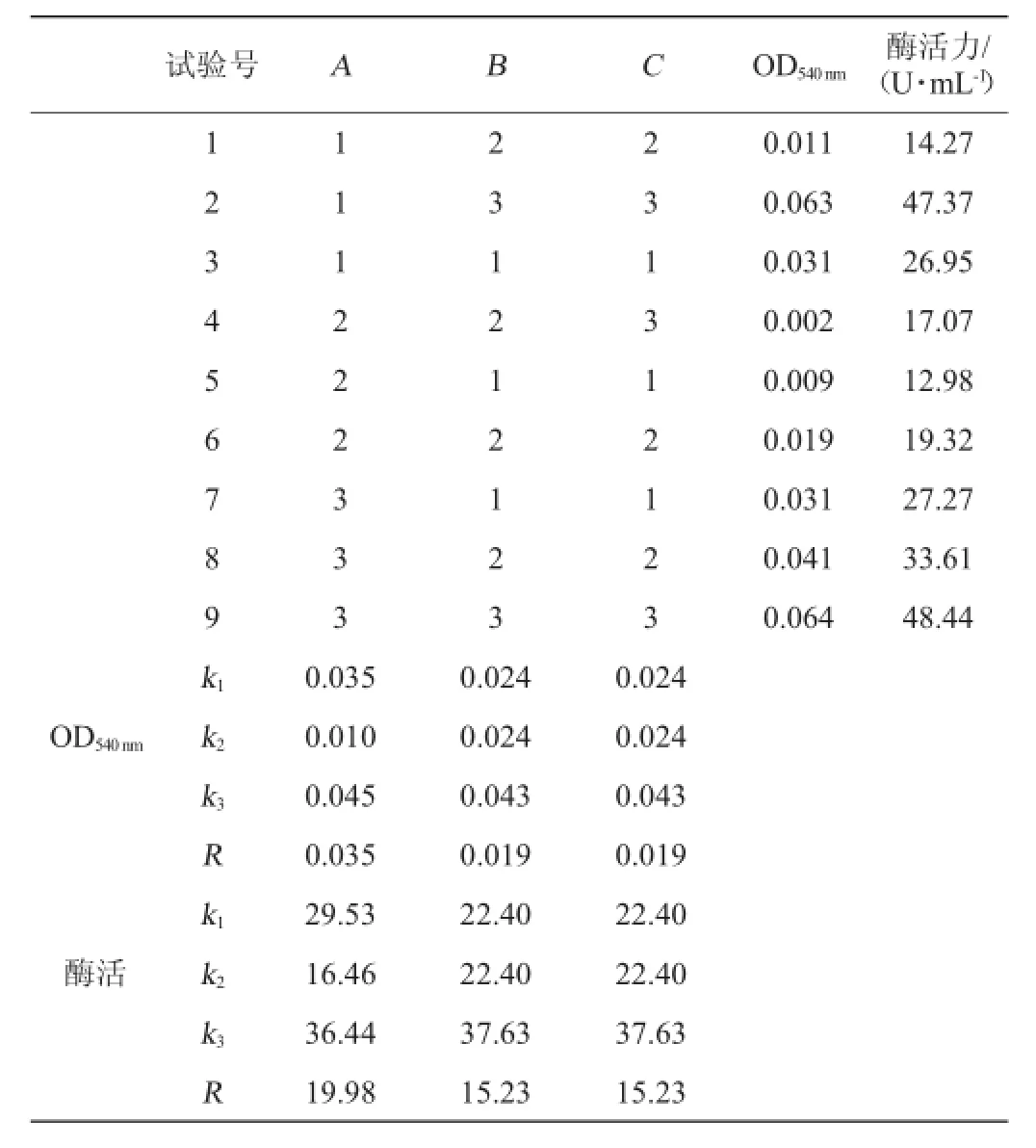
表4 培养基配方优化正交试验结果与分析Table 4 Results and analysis of orthogonalexperiments for m edium form ula optim ization
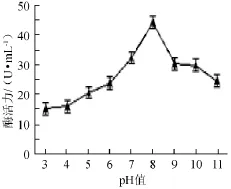
图1 初始pH值对菌株Gh-5发酵产酶的影响Fig.1 Effects of initialpH on xylanase production o f strain Gh-5
2.3.2种量对产酶菌株Gh-5发酵的影响
不同接种量对产酶菌株Gh-5发酵的影响,结果见图2。

图2 接种量对菌株Gh-5发酵产酶的影响Fig.2 Effects of inoculum on xylanase produc tion of strain Gh-5
由图2可知,产酶菌株Gh-5随接种量增加,发酵产酶酶活先升高后降低,当接种量为14%时,发酵产酶效果最好,酶活力达102.71U/m L。因此,14%是菌株Gh-5的最佳接种量。
2.3.3酵温度对产酶菌株Gh-5发酵培养的影响
不同发酵温度对产酶菌株Gh-5发酵的影响,结果见图3。
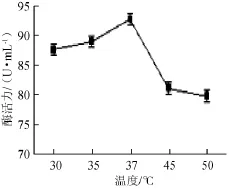
图3 发酵温度对菌株Gh-5发酵产酶的影响Fig.3 Effects of fermentation temperature on xylanase production of strain Gh-5
由图3可知,产酶菌株Gh-5在37℃培养时,发酵产酶最佳,酶活力达92.93U/m L。因此,发酵最佳温度为37℃。
2.3.4酵时间对产酶菌株Gh-5发酵培养的影响
不同发酵时间对产酶菌株Gh-5发酵的影响,结果见图4。

图4 发酵时间对菌株Gh-5发酵产酶的影响Fig.4 Effects of fermentation time on xylanase production of strain Gh-5
由图4可知,菌株Gh-5随发酵时间的延长,表现出酶活先升高后降低趋势。当发酵时间为36 h时,发酵产酶效果最佳,酶活力达107.76U/m L。因此,发酵最佳时间为36 h。
2.4学性质
2.4.1pH对木聚糖酶的影响
不同pH值对木聚糖酶活力的影响,结果见图5。
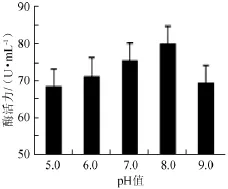
图5 pH值对木聚糖酶活力影响Fig.5 Effects of pH on xylanase activity
由图5可知,菌株Gh-5的酶活随pH值的升高呈现出先升高后降低的趋势。在pH 8.0时酶活力最高,可达85U/m L。可见,菌株Gh-5产木聚糖酶在弱酸及中性pH条件下活力较高。当pH>8.0时,木聚糖酶开始失活。
2.4.2度对木聚糖酶的影响
不同温度对木聚糖酶活力的影响,结果见图6。
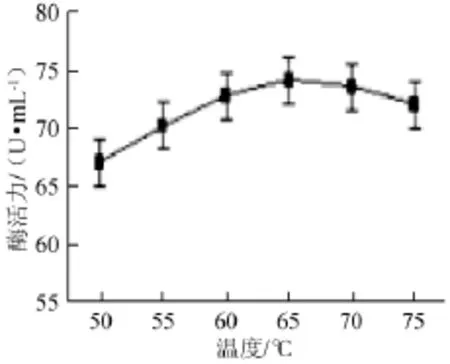
图6 温度对木聚糖酶活力的影响Fig.6 Effects of temperature on xylanase activity
由图6所示,菌株Gh-5的酶活随温度的升高呈现出先升高后降低的趋势。在55~75℃时,木聚糖酶活力相对稳定。在65℃时,木聚糖酶具有最高活力。
2.4.3属离子对木聚糖酶的影响
不同金属离子对木聚糖酶活力的影响,结果见图7。

图7 金属离子对木聚糖酶活力的影响Fig.7 Effects ofmetal ions on xylanase activity
由图7所示,金属离子对产木聚糖酶均有促进作用,其中Zn2+对木聚糖酶活力的促进作用最明显,比其他金属离子高出10%~30%。
3 结论
本研究中筛选到的菌株Gh-5,最适发酵产酶的培养基为甘露糖15 g/L,氯化铵10 g/L,ZnSO40.3 g/L,KH2PO40.5 g/L;最适发酵条件温度为37℃,pH值为8.0,接种量为14%,发酵培养生长周期为36h。木聚糖酶产生菌株Gh-5发酵优化后的酶活力为114.64 U/m L,较优化前38.02U/m L提高了201.53%。木聚糖酶的酶学性质研究结果表明,木聚糖酶酶活最适pH值为8.0;最适温度为65℃;Zn2+对木聚糖酶酶活的促进作用最好。
[1]罗玲,蔡骏,王常高,等.一株产木聚糖酶菌株的筛选鉴定及产酶条件初步优化[J].工业微生物,2015,45(1):43-49.
[2]徐君飞,张居作.微生物β-1,4-内切木聚糖酶研究进展[J].中国酿造,2014,33(5):15-17.
[3]郄卫那,张兰英,何健,等.1株用木聚糖酶产生菌的分离、鉴定、发酵、酶学性质及应用[J].江苏农业科学,2014,42(10):196-200.
[4]刘程程,刘波,蓝江林,等.产木聚糖酶芽孢杆菌的筛选及产酶条件优化[J].福建农业学报,2014,29(8):757-767.
[5]孔明哲,郑宏臣,孙君社,等.产耐高温木聚糖酶菌株的筛选及其产酶条件优化[J].中国酿造,2013,32(8):15-20.
[6]范美霞,孙迅,陶宗娅.木聚糖酶的研究进展[J].菏泽学院学报,2009,31(2):99-101.
[7]侯炳炎.饲料酶制剂的生产和应用[J].工业微生物,2015,45(1):63-64.
[8]闵兆升,郭会明,顾承真,等.木聚糖酶及其在食品工业中的应用[J].食品发酵工业,2013,39(10):170-173.
[9]卢毅弘,彭彦峰,周玉玲,等.造纸用木聚糖酶的基因工程研究进展[J].氨基酸和生物能源,2014,36(3):4-5.
[10]叶世超,薛婷,何文锦,等.木聚糖酶的应用及其研究进展[J].中国酿造,2013,32(7):8-10.
[11]付冠华,李端,周晨妍,等.木聚糖酶的研究进展及其应用[J].安徽农业科学,2011,39(35):21567-21568.
[12]滕超,范园园,王雅珍,等.高产耐热木聚糖酶嗜热真菌F1208的筛选与鉴定[J].中国食品学报,2013,13(8):231-236.
[13]周秀梅.木聚糖酶生产及酶学性质的研究[D].杭州:浙江大学硕士论文,2005.
[14]孙超.木聚糖酶产生菌的选育及其产酶条件的研究[D].西安:西北农业大学硕士论文,2013.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23874—2009饲料添加剂木聚糖酶活力的测定分光光度法[S].北京:中国标准出版社,2009.
[16]张琇,林勤.红酵母NZ-01发酵条件的优化[J].生物技术通报,2010(4):198-202.
OPtimization of medium formula and fermentation confitions of xylanse-producing strain GH-5
YANG Zirong,WANG Jing,XUMeng,ZHANG Xiu*
(SchoolofBiology Science and Engineering,Beifang University ofNationalities,Yinchuan750021,China)
The effectofmedium componentsand fermentation processon xylanase production by strainsGh-5 was studied,and the xylanase propertieswerestudied aswell.The resultsshowed that theoptimalmedium components forxylanase production wasmannose 15 g/L,NH4Cl10 g/L,Zn-SO40.3 g/L and KH2PO40.5 g/L;the optimalgrow th pH,tem perature,inoculum and fermentation culture grow th cyclewere 8.0,37℃,14%and 36 h,respectively.Xylanase activity was increased from 38.02U/m l to 114.64 U/m l,increased 201.53%.The xylanase properties study results showed that theoptimalpH and temperaturewere8.0 and 65℃,Zn2+had agood role in promoting enzymeactivity.
xylanase;isolation and screening;fermentation optim ization;enzymeproperty
TQ925
0254-5071(2016)01-0068-05
10.11882/j.issn.0254-5071.2016.01.015
2015-11-08
宁夏自然科学基金项目(NZ13080);国家民委留学人员择优资助项目;宁夏回族自治区级研究项目(QJCX-2014-027)
杨子荣(1991-),男,本科生,研究方向为微生物能源学。
张琇(1977-),男,教授,博士,研究方向为微生物学。
