拟南芥硫苷生物合成相关基因的组织和胁迫诱导表达谱的全基因组分析
2016-09-16马珊珊柯蕴倬孙丽萍李加纳
杜 海,冉 凤,刘 静,文 婧,马珊珊,柯蕴倬,孙丽萍,李加纳
(西南大学农学与生物科技学院,重庆400715)
拟南芥硫苷生物合成相关基因的组织和胁迫诱导表达谱的全基因组分析
杜 海,冉 凤,刘 静,文 婧,马珊珊,柯蕴倬,孙丽萍,李加纳
(西南大学农学与生物科技学院,重庆400715)
【目的】分析拟南芥中硫代葡萄糖苷(Glucosinolatcs,简称硫苷)生物合成相关基因在不同组织器官、不同发育时期及不同生物和非生物胁迫处理条件下的表达谱,为筛选控制硫苷合成的关键基因、解析硫苷的生物合成规律及其在植物抗逆胁迫过程中的作用奠定基础。【方法】利用AtGenExpress和PLEXdb中的10组表达谱芯片数据和2组转录组数据分析拟南芥中硫苷生物合成途径82个结构基因和调控基因的时空表达特性及其受生物和非生物胁迫的表达模式;采用Real-time PCR技术对10个硫苷合成途径的关键结构基因和调控基因的表达谱进行验证;并利用STRING v10软件分析硫苷生物合成途径相关基因的表达模式的相关性。【结果】组织表达特性分析结果表明,拟南芥硫苷生物合成相关基因在营养器官和生殖器官中的表达模式差异较大,相关基因在营养器官中具有较高的表达量,在生殖器官中的表达量则较低,表明硫苷主要在营养组织中合成;其中脂肪族硫苷合成相关基因在茎、叶等地上营养组织中的表达量较高,而吲哚族硫苷合成相关基因则在根、茎、叶等地上和地下组织中均有较高的表达,且基因在同一组织的不同发育时期的表达量通常具有差异,表明基因的表达还具有时空特异性;荧光定量PCR分析结果证明10个硫苷合成途径代表基因的表达谱与芯片数据的结果保持一致;胁迫表达分析结果表明,脂肪族和吲哚族硫苷合成相关基因的表达均受到部分生物和非生物胁迫因子的诱导表达,其中吲哚族硫苷合成相关基因更易受到丁香假单胞杆菌(Pseudomonas syringae)、甘蓝链格孢菌(Alternaria brassicicola)、桃蚜(Myzus persicae)等生物和低温(4℃)、高盐、高温(38℃)等非生物胁迫因子的诱导表达;共表达分析结果表明,脂肪族和吲哚族硫苷合成分支途径内相关调控基因与结构基因的表达模式的相关性较高。【结论】拟南芥硫苷生物合成相关基因主要在营养组织中高表达,在种子中低表达;植物中存在一个硫苷转运系统,负责将营养组织中合成的硫苷转运到种子中贮藏;硫苷合成相关基因的表达受到病原菌、虫害、高温等逆境因子的影响,其中吲哚族硫苷合成相关基因更易受到生物和非生物胁迫因子的诱导表达,说明吲哚族硫苷可能对植物抗性更为重要。
拟南芥;硫苷;表达模式;发育时期;生物胁迫;非生物胁迫;实时荧光定量PCR
0 引言
【研究意义】硫代葡萄糖苷(glucosinolatcs,简称硫苷)是一类含氮、含硫的植物次生代谢产物[1],广泛存在于食用油料作物、蔬菜和拟南芥等十字花科植物中,是该科植物产生的一类重要次生代谢产物[2-3],其降解产物具有多种生物学功能[4-5]。例如,硫苷降解产物异硫氰酸酯类(isothiocyanates,ITCs)、硫氰酸酯类(thiocyanates,TCs)、腈类(nitrilcs)、恶唑烷酮类(oxazolidinones,ODs)等具有较强的防腐和抗菌作用,可作为杀虫剂、杀菌剂、抗微生物制剂和天然的生物熏蒸消毒剂[6-7];硫苷具有芳香或刺激性气味,既可作为十字花科专食性昆虫(crucifer specialists)的引诱剂,刺激或抑制某些昆虫产卵与摄食[8],又可作为杂食性昆虫(generalist herbivores)的驱散剂[9];同时硫苷还赋予食物特殊的风味,如萝卜、甘蓝等的辛辣味[10];萝卜硫素则被证明是迄今发现的抗癌活性最强的植物活性物质,可预防前列腺癌、肺癌、食道癌等[10-11]。可见,硫苷及其降解产物对植物抗性和人类健康具有重要作用。拟南芥是重要的十字花科模式植物,相对于其他植物,具有较为完整的基因组信息和丰富的表达谱芯片数据资源。因此,在拟南芥中对硫苷的动态合成规律展开系统研究,不仅具有重要的理论研究意义,还可以为进一步在油菜、白菜等作物中开展相关研究提供重要的参考。【前人研究进展】硫苷类化合物均由β-D-硫葡萄糖基、硫化肟基团以及来源于氨基酸的侧链R基组成。通常根据侧链R基的来源将硫苷分为脂肪族硫苷、吲哚族硫苷和芳香族硫苷三大类[12]。目前硫苷生物合成途径较清楚,主要酶基因均已被证实[13]。硫苷的生物合成途径大致可以分为前体氨基酸侧链延长、核心结构合成和次级修饰3个主要阶段[14]。其中,核心结构合成过程是所有硫苷合成的共同部分。核心结构形成后再经羧基化、甲基化、葡萄糖基化等次级修饰形成不同的硫苷类化合物。硫苷侧链修饰具有重要的作用,硫苷及其降解产物的理化性质很大程度上取决于硫苷的侧链结构[15]。近年来,硫苷调控机理方面的研究也取得了一定的进展,bHLH、Dof和MYB类转录因子均被证实参与调控硫苷的生物合成[15-19]。其中,MYB类转录因子对硫苷的生物合成尤为重要[15-16,20-22]。【本研究切入点】虽然硫苷的生物合成和调控途径研究较清楚,但是对其合成规律、生物学功能仍缺乏系统的研究。鉴于硫苷的含量在不同材料和组织、不同发育时期和环境下均不同[3,23],因此,研究硫苷合成相关基因的表达模式的动态变化规律,将有助于揭示硫苷的生物合成和代谢规律、筛选控制硫苷合成或调控的关键基因。【拟解决的关键问题】本研究基于AtGenExpress[24-25]和 PLEXdb[26]中的表达谱数据,结合Real-time PCR技术,在全基因组水平对拟南芥硫苷生物合成途径主要酶基因和调控基因的时空表达特性和胁迫诱导表达谱进行了系统的研究,以解析不同硫苷组分的生物合成规律和胁迫诱导表达模式。
1 材料与方法
1.1硫苷生物合成相关基因的组织表达特性分析
本研究分析的硫苷生物合成相关基因如表 1所示。拟南芥组织表达谱芯片数据来源于AtGenExpress (http://www.weigelworld.org/resources/microarray/ AtGenExpress),共包含不同发育时期的79个组织或器官[24]。均一化的芯片数据利用Cluster v3.0软件[27]采用层级聚类法分析基因的表达谱,并用 Java TreeView软件[27]图形化基因表达谱热力图(heatmaps)。拟南芥哥伦比亚野生型(Arabidopsis thaliana ecotype Columbia-0)种子购自于 ARBC(拟南芥种质资源中心),由重庆市油菜工程研究中心实验室保存。2016 年1月进行组培室种植,培养条件为16 h光照/8 h黑暗,昼夜温度 22℃/18℃,相对湿度 70%。分别于苗期和花期取植株的根、茎、叶、花和种子等组织,液氮中速冻,-80℃保存备用。
1.2硫苷生物合成相关基因的胁迫诱导表达谱分析
拟南芥生物(病原菌和虫害)和非生物(激素和环境因子)胁迫诱导的基因芯片数据来自于AtGenExpress[25]和植物表达谱数据库(plant expression database, PLEXdb)[26]。所采用的9组芯片数据的编号分别为GSE5525(AT49)、GSE5640(AT50)、GSE5684 (AT51)、AT59、GSE6516(AT63)、GSE17193 (AT84)、GSE18960(AT90)、GSE20188(AT110)和GSE24552(AT112)。病原菌和虫害芯片数据的试验处理详见PLEXdb数据库中相关芯片数据的试验设计(http://www.plexdb.org/plex.php?database= Arabidopsis)[26,28-30];激素和环境因子胁迫诱导芯片数据的实验处理详见AtGenExpress[24-25]。所有芯片数据均为已进行标准化处理的数据。
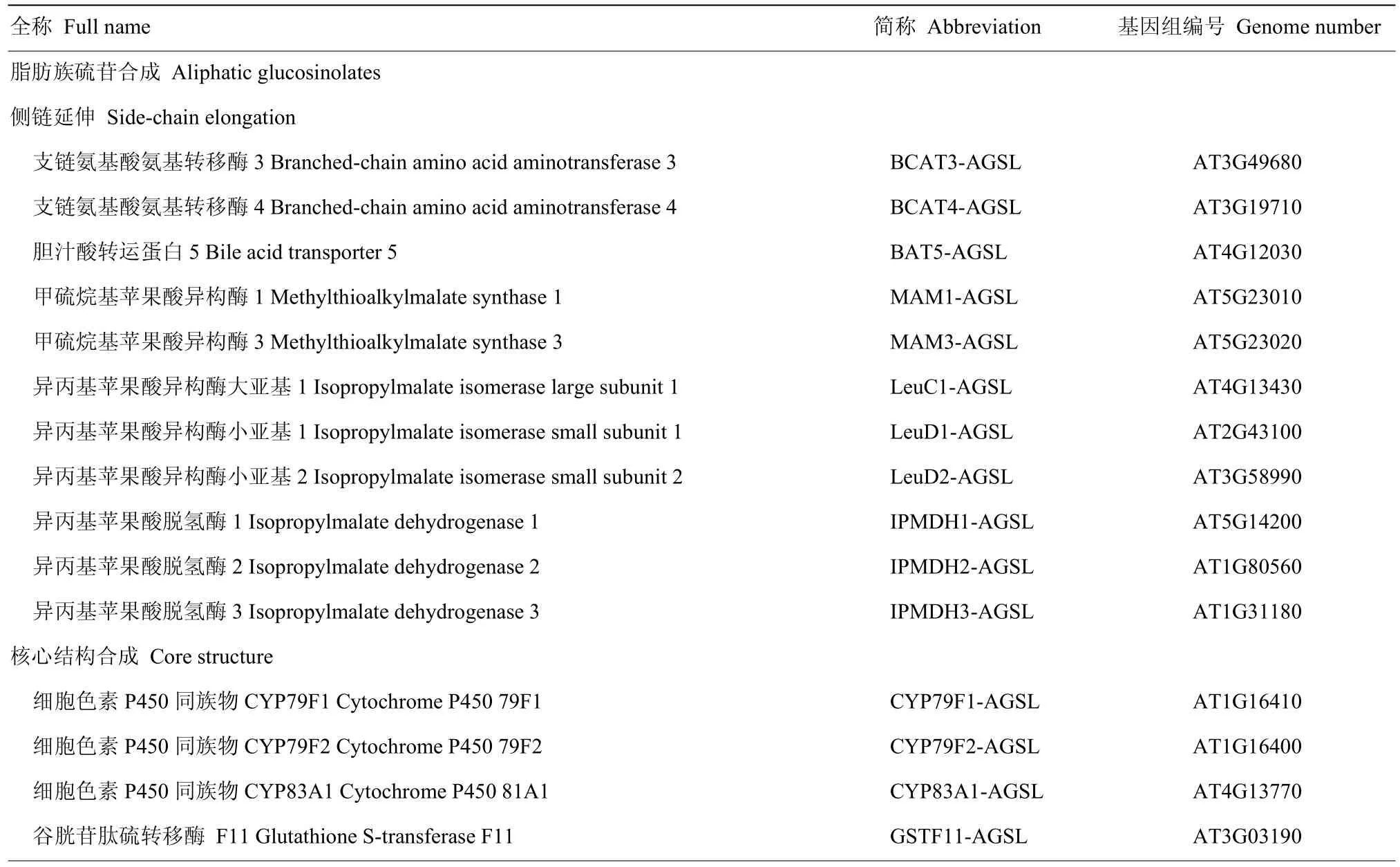
表1 拟南芥硫苷生物合成相关基因Table 1 Glucosinolate biosynthetic genes in Arabidopsis

续表1 Continued table 1
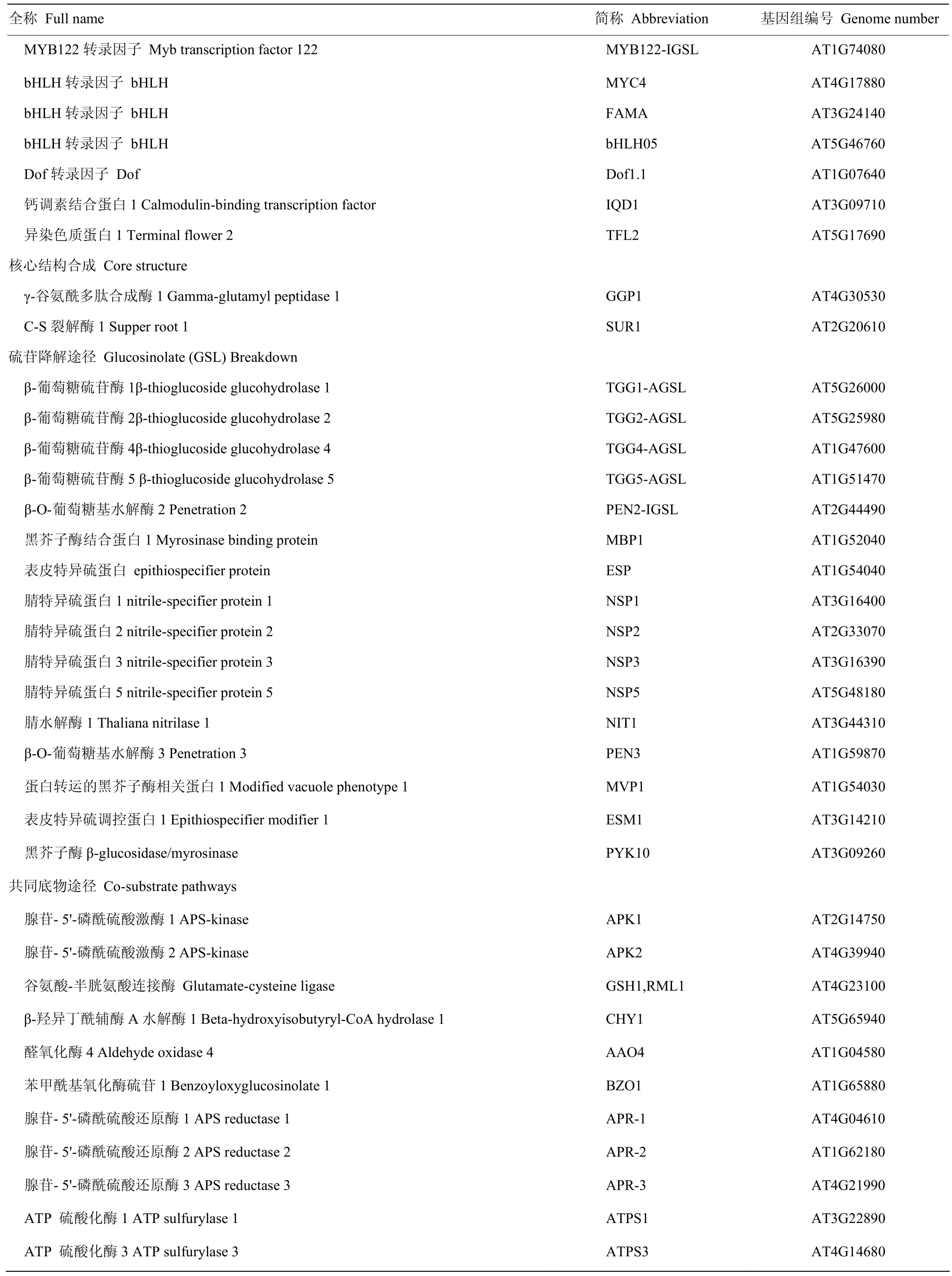
续表1 Continued table 1
根据拟南芥芯片信息,共找到78个探针,分别对应78个基因。由于高度同源,有4个探针对应2个基因(IPMDH1和IPMDH3,CYP79F1和CYP79F2),有2个基因(TSB1和NIT1)没有找到对应的探针。芯片数据用 Cluster v3.0软件进行层级聚类法分析相关基因的表达谱[27],并利用Java TreeView软件可视化相应的表达谱热力图(heatmaps)[31]。利用STRING v10 (http://string-db.org/newstring_cgi/show_input_page.pl?UserId=JnIkwsVs3Jb_&sessionId=U_KvLy4CMUs4)[32]软件分析硫苷生物合成相关基因的共表达和互作调控网络图。
1.3试剂、药品和仪器
植物RNApure超纯总RNA快速提取试剂盒购自于北京博迈德基因技术有限公司;RQ1 RNase-Free DNase购于美国 Promega公司;反转录试剂盒(PrimeScript 1st Strand cDNA Synthesis Kit)购于TaKaRa公司;实时荧光定量PCR试剂盒(SsoAdvanced Universal超混合液)、耗材和仪器(CFX96 Touch)均购于BIO-RAD公司。
1.4实时荧光定量PCR分析
按照RNApure超纯总RNA快速提取试剂盒的操作说明分别提取野生型拟南芥根、茎、叶、花、角果和成熟种子的总RNA;经DNaseⅠ(RQ1)处理去除总RNA中残留的痕量基因组DNA;根据TaKaRa公司的反转录试剂盒说明书进行第一链cDNA的合成。使用SsoAdvanced Universal Mix(SYBR Green)试剂盒和BIO-RAD公司的CFX96 Touch荧光定量PCR仪进行Real-time PCR(qPCR)扩增。以反转录获得的cDNA为模板,以拟南芥Actin 7(AT5G09810.1)为内标基因,分别用10个硫苷合成相关基因的特异引物(表2)进行qPCR扩增。采用2步法反应程序,95℃5 min;95℃ 15 s,58℃ 20 s,40个循环;绘制熔解曲线。设3次重复,取平均值,采用2-ΔΔCt法计算基因在不同样品中的相对表达量。

表2 拟南芥硫苷生物合成途径10个代表基因的qPCR引物Table 2 Primers of 10 representive genes involved in glucosinalate biosynthesis pathway in Arabidopsis
2 结果
2.1硫苷生物合成相关基因的组织表达特性
对硫苷生物合成和分解途径的70个酶基因和12个调控基因(表1)在拟南芥不同发育时期79个组织或器官中的组织表达特性分析结果表明(图 1),大部分基因在不同组织和器官中的表达模式不同,且硫苷合成相关基因在根、茎、叶等营养组织中的表达量较高,在花和种子中的表达量普遍较低,说明硫苷可能主要在营养器官中合成。其中,脂肪族硫苷合成相关基因在茎、叶等地上营养器官中的表达量明显高于根中的表达量;吲哚族硫苷合成相关基因则在根、茎和叶中有较高的表达量,推测脂肪族硫苷主要在地上营养组织中合成,而吲哚族硫苷在地下和地上营养组织中均有合成。另外,同一基因在相同组织和器官不同发育时期的表达量通常有一定的差异,说明相关基因的表达可能具有时期特异性。


图1 拟南芥硫苷代谢途径相关基因表达谱Fig. 1Ex pression analysis of glucosinolate biosy nthetic genes in Arabidopsis
脂肪族硫苷氨基酸侧链延伸基因MAM1在地上营养组织中的表达量较高,MAM3在根中的表达量较高;次级结构修饰基因FMOGSL-OX1、FMOGSL-OX3和FMOGSL-OX5在地上组织中的表达量较高,FMOGSLOX2在花中的表达量较高,FMOGSL-OX4则在根中的表达量较高。而吲哚族硫苷侧链修饰相关基因(CYP81F2、CYP81F3、CYP81F4、IGMT1和IGMT2)在根中的表达量较高。说明脂肪族硫苷的结构修饰可能在植物发育不同时期和组织中均有发生,而吲哚族硫苷的结构修饰可能主要发生在根中。
此外,脂肪族硫苷合成的调控基因 MYB28和MYB29的表达量较高,且与脂肪族硫苷合成途径酶基因的表达模式相似,而MYB76的表达量较低,说明该基因的功能可能相对较弱。同理,吲哚族硫苷合成的调控基因 MYB34和 MYB51的表达量相对较高,而MYB122的表达量则较低。其中MYB34在根和地上组织中均表达,而MYB51主要在地上组织中表达,表明MYB34调控地上和地下组织中硫苷的合成,而MYB51主要调控地上组织中硫苷的合成。在硫苷降解途径中,黑芥子酶基因TGG4在根中的表达量较高,PEN2和PEN3在大部分营养组织中的表达量较高,NSP2则在种子中的表达量较高(图 1),说明不同硫苷降解酶基因在植物防御系统中可能负责相应组织中硫苷的水解过程。
为验证芯片数据的分析结果,选择10个分别参与脂肪族和吲哚族硫苷合成(包括前体氨基酸侧链延长、核心结构合成和次级修饰3个阶段)(表1和表2)及调控的关键基因,采用qPCR法分析它们在拟南芥中的表达模式。结果表明,10个硫苷合成相关基因在营养组织中的表达量较高,在种子组织中的表达量则较低。其中,脂肪族硫苷合成相关基因MAM1、AOP2、CYP79F1、CYP83A1和MYB28主要在茎、叶或角果中优势表达,在根、花和种子中的表达量相对较低;吲哚族硫苷合成相关基因IGMT1、ASA1、CYP83B1、CYP79B2和MYB34在根、茎或叶中的表达量较高,在角果、花和种子中的表达量则相对较低(图 2)。qPCR法分析的结果与芯片数据分析的结果一致性较好,均证明脂肪族硫苷合成相关基因主要在地上营养组织中表达,而吲哚族硫苷合成相关基因在地上和地下营养组织中均有较高的表达水平。仅AOP2、ASA1 和MYB34的表达量略有差异,但是两组数据的总体表达模式仍一致。例如,AOP2在芯片数据的叶、茎和花器官中均有较高的表达量,在qPCR数据的叶和茎中也具有较高的表达量,但是在花中的表达量则相对较低(图1和图2)。这是因为两组数据的取样时期和组织不同所致,该基因在芯片数据的花中的表达量通常也较低,仅在特定时期的花器官中具有相对较高的表达量(图1)。
2.2硫苷生物合成相关基因受生物胁迫的表达谱
对硫苷生物合成相关基因在9组生物胁迫芯片数据(AT49、AT50、AT51、AT59、AT63、AT84、AT90、AT110和AT112)中的表达谱分析结果表明,硫苷生物合成途径部分酶基因的表达明显受到病原细菌、真菌和虫害的胁迫诱导(图3)。在4组病原菌胁迫数据中,硫苷合成和降解相关基因明显受到细菌性病原菌的抑制表达。其中,假单胞杆菌Pseudomonas G62 (AT112)浸染植株后,多数硫苷合成相关基因的表达受到抑制,仅有部分下游基因的表达未受影响(如MVP1、NSP2、NSP5、PEN3、BZO1、CHY1、TGG2 和GSH1)。在丁香假单胞杆菌(Pseudomonas syringae)的胁迫下,除了部分次级修饰基因(FMOGS-OX2、FMOGS-OX4、FMOGS-OX5和GS-OH),脂肪族硫苷合成相关基因的表达量较低,而吲哚族硫苷合成和降解相关基因的表达量增加(图 3)。说明脂肪族硫苷合成相关基因的表达受到该病原菌的抑制,吲哚族硫苷合成相关基因的表达受到诱导。
在真菌胁迫数据中,仅木霉菌(Trichoderma spp,AT50)能够同时诱导脂肪族和吲哚族硫苷合成相关基因上调表达,其他真菌胁迫下脂肪族和吲哚族硫苷合成相关基因的表达模式通常相反(图 3)。例如,当植株受到灰霉病菌(Botrytis cinerea)、甘蓝链格孢菌(Alternaria brassicicola)和白粉菌(Erysiphe orontii)(AT51)侵染后,多数脂肪族硫苷合成相关基因的表达受到抑制,而吲哚族硫苷合成和降解相关基因的表达受到诱导。相似地,疫霉菌(Phytophthora)侵染拟南芥叶片后,吲哚族硫苷合成相关基因的表达量迅速增加,脂肪族硫苷合成相关基因的表达量则较低。但随着浸染时间的增加,吲哚族硫苷合成相关基因的表达量随之下降,而脂肪族硫苷合成相关基因的表达量则上升。此外,发现部分脂肪族和多数吲哚族硫苷合成相关基因的表达还受到壳聚糖的诱导(AT84)。以上结果表明,吲哚族硫苷合成相关基因的表达更容易受到病原菌的诱导。
通过对多组抗虫芯片数据的分析发现,脂肪族硫苷合成和降解相关基因的表达受到菜青虫的胁迫诱导,而吲哚族硫苷合成和降解相关基因的表达明显受到西花蓟马、桃蚜(Myzus persicae,AT49)和粉虱(AT63)的胁迫诱导(图3)。说明不同硫苷组分的抗虫害作用可能不同,其中吲哚族硫苷可能对粉虱、西花蓟马和桃蚜有一定的防御作用。此外,本研究发现水杨酸(salicylic acid,SA)能够诱导吲哚硫苷合成途径大部分基因高表达(图 3),说明吲哚族硫苷在植物防御系统中的作用依赖SA信号途径。
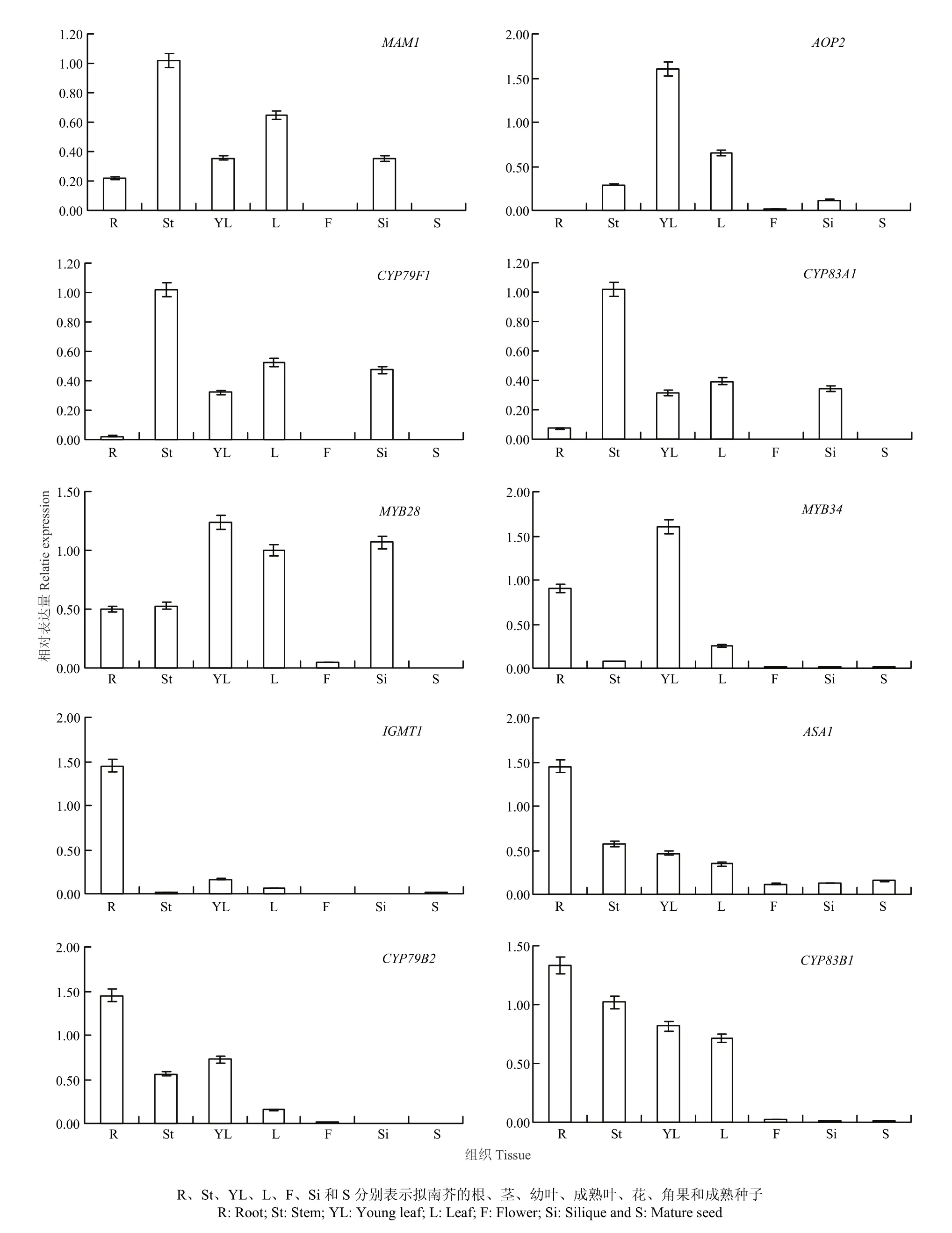
图2 硫苷合成相关基因在拟南芥中的表达模式Fig. 2 Expression patterns analyses of glucosinolate biosynthesis genes in Arabidopsis by qPCR
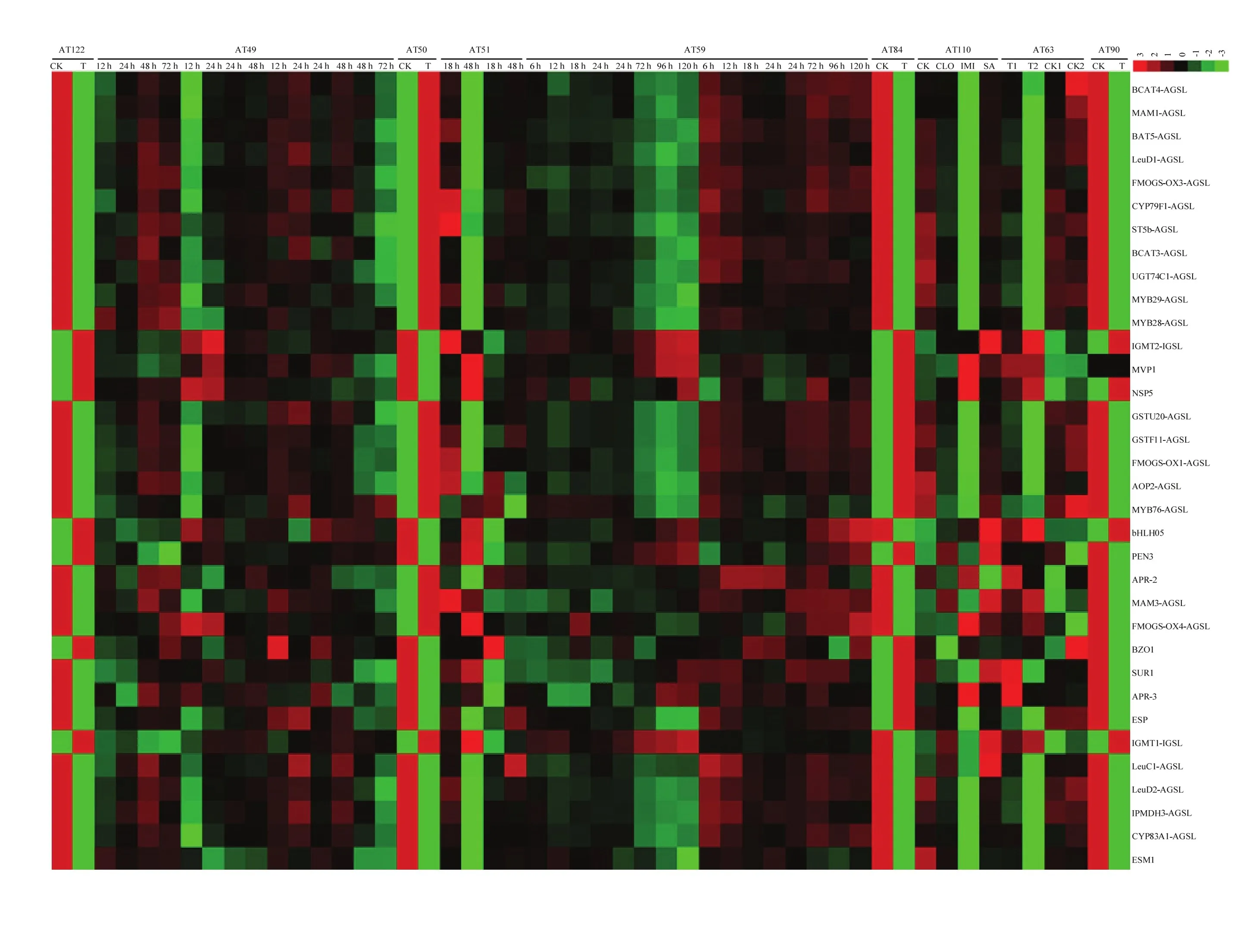
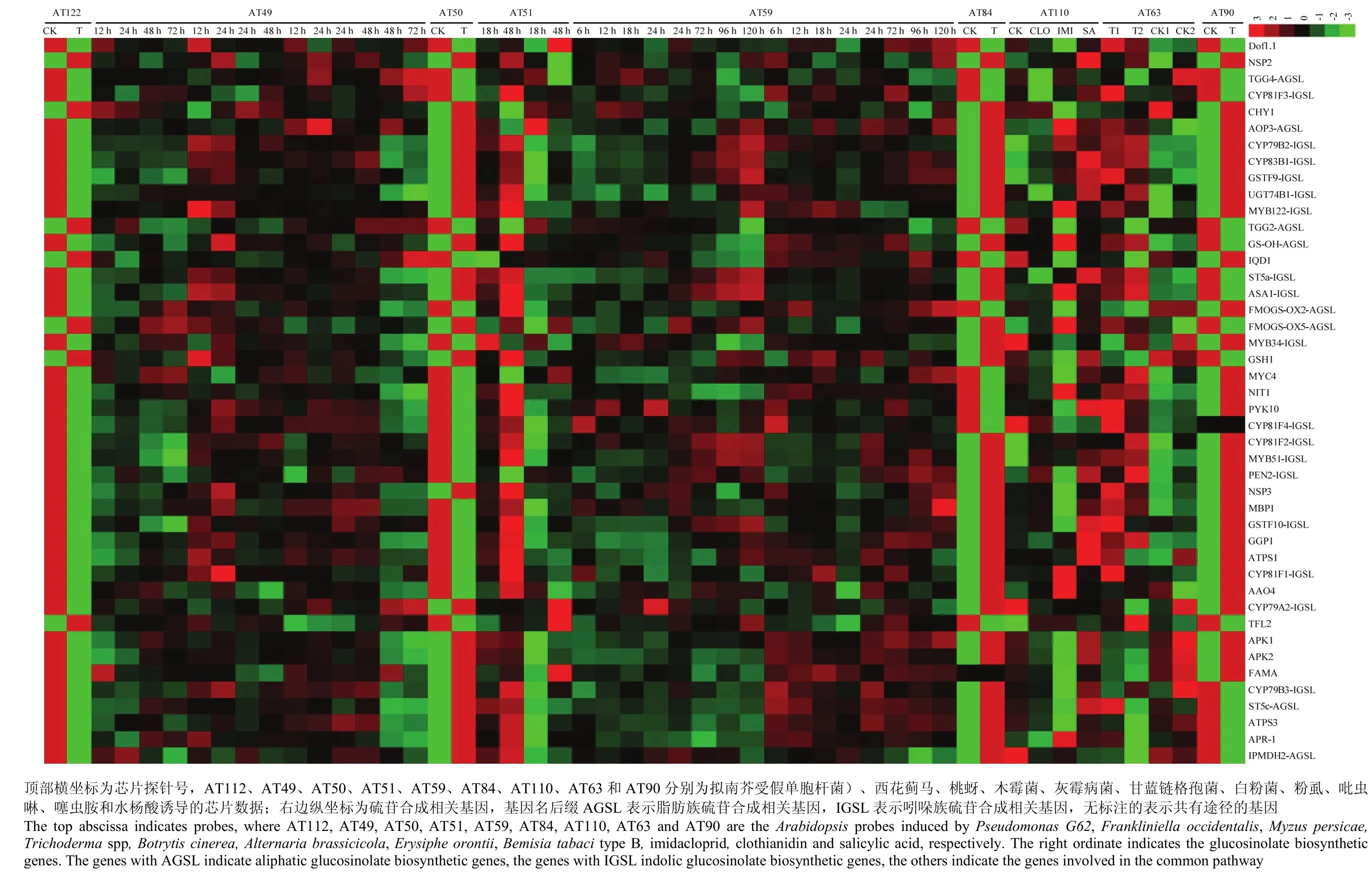
图3 拟南芥硫苷生物合成基因受病、虫害胁迫诱导的表达谱Fig. 3 The expression profiles of Arabidopsis glucosinolates biosynthesis genes induced by pathogen and insect stresses
2.3硫苷生物合成相关基因受非生物胁迫诱导的表达谱
如图4所示,脂肪族硫苷合成相关基因主要在地上组织中表达,吲哚族硫苷合成相关基因主要在根中表达,仅有少数基因在悬浮细胞中表达,说明硫苷主要在地上和地下组织中合成。而且大部分上游基因(包括吲哚族和脂肪族)在地上组织和根中的表达受到多种非生物环境因子的胁迫诱导。例如,脂肪族硫苷合成上游基因BCAT4、LeuD1、LeuD2、BAT5、ST5b、GSTF11和IPMDH3在地上组织和根中的表达均受到低温(4℃)、渗透胁迫、高盐、UV-B和高温(38℃)的抑制,但是受到干旱和伤害的诱导而上升,说明这些环境因子对脂肪族硫苷的合成有影响。同理,UGT74B1、GSTF9、CYP79B2、CYP79B3、CYP81B1等基因在地上组织中的表达量较低,但是在根中的表达量相对较高且明显受到低温、高盐、渗透胁迫和高温的抑制,证明吲哚族硫苷的合成受到这些非生物因子的胁迫诱导。
但是,次级修饰和降解相关基因没有明显受到上述非生物胁迫因子的诱导表达(图 4)。其中,脂肪族硫苷次级修饰相关基因(FMOGS-OX1和FMOGS-OX1-3)在地上组织中有较高的表达水平,而吲哚族硫苷次级修饰相关基因(CYP81F1-4、IGMT1 和IGMT1)在根中有较高的表达水平。同理,硫苷降解酶基因(TGG2、TGG4、PEN2和MBP1)和调控基因(MYB29、MYB76、MYB51、MYB122和bHLH05)在地上组织和根中也具有相对较高的表达量(图4)。以上结果进一步证明脂肪族和吲哚族硫苷可能分别在地上和地下组织中合成,并与相应的黑芥子酶基因组成一个紧密的防御体系,通过响应相关因子的胁迫信号来调控硫苷的合成以抵御植株受到的非生物逆境胁迫。
2.4硫苷生物合成相关基因受激素诱导的表达模式
如图 5所示,经过吲哚乙酸(IAA)和脱落酸(ABA)处理3 h后硫苷合成相关基因的表达量明显降低,说明它们对硫苷合成可能具有抑制作用。经过生长素极性运输抑制剂(2,4,6T、PCIB、TIBA 和NPA)处理后,大部分硫苷合成相关基因的表达量无明显变化,说明生长素在低水平时对硫苷合成没有影响,但是积累到较高浓度时则会抑制硫苷的合成。经过油菜素内酯(brassinolide,BL)、乙烯合成酶 (1-aminocycropro-pane-1-carboxylic acid,ACC)、玉米素(zeatin)、GA和茉莉酸甲酯(methyl jasmonate,MJ)处理后,脂肪族硫苷合成相关基因的表达量没有明显的变化,少数吲哚族硫苷合成相关基因的表达量增加,表明这些激素对硫苷生物合成的影响相对较低。但是经过乙烯抑制因子AgNO3处理后,部分吲哚族硫苷合成相关基因(例如 ST5a、UGT74B1、ASA1、CYP81F2、MYB51和MYB122)的表达量明显增加,表明内源性乙烯可能对吲哚族硫苷的合成具有调控作用。GA和BR抑制因子对硫苷合成相关基因的表达没有明显的影响,并且GA和BR信号通路关键突变体gal-3、gal-5和det2-1中硫苷合成相关基因的表达量也无明显变化(图 5),说明这两种激素对硫苷的生物合成没有影响。
此外,大多数脂肪族硫苷合成相关基因在植株缺硫24 h后表达量明显降低,而吲哚族硫苷合成相关基因的表达量无明显的变化,说明硫对脂肪族硫苷的生物合成具有重要的作用(图 5)。还发现部分硫苷合成相关基因(例如CYP79B2、MYB51和TGG2)在22℃时的表达水平比 4℃时高,说明温度对硫苷的生物合成也有影响(图5)。
2.5硫苷生物合成途径的互作调控网络
脂肪族和吲哚族硫苷代谢支路内相关基因的表达模式相关性较高(图6)。MYB28转录因子基因的表达模式与 CYP79F1、CYP79F2、FMOG-OX3和UGT74C1酶基因的表达模式相关性较高,说明它们可能是 MYB28调控的下游靶基因。同理,MYB29与FMOG-OX1和AOP2的表达模式也非常相似,说明它们可能为MYB29的共调控基因。以上结果进一步证明MYB转录因子对硫苷生物合成具有重要的调控作用,且存在共调控机制。
3 讨论
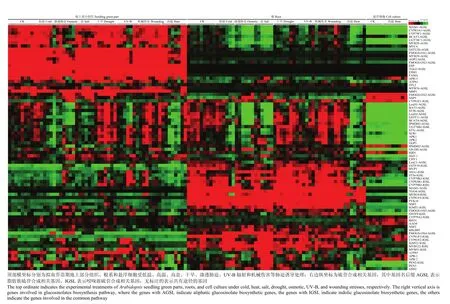
图4 硫苷生物合成相关基因受非生物胁迫诱导的表达情况Fig. 4 Expression patterns of Arabidopsis glucosinolate genes under abiotic stresses

图5 硫苷生物合成相关基因受激素诱导的表达情况Fig. 5 Expression analysis of Arabidopsis glucosinolate biosynthetic genes under hormone inductions
硫苷广泛分布于十字花科植物的不同组织中,同一植物不同组织、不同生育期硫苷的组分和含量差异很大,具有动态变化的特征。通常,种子中硫苷的含量明显高于其他组织和器官。例如,甘蓝型油菜种子中硫苷的含量高达180 µmol·g-1,而叶片中硫苷的含量一般只有10—20 µmol·g-1[33]。但是种子自身合成硫苷的量却较少,说明植物体内存在一个将“源”组织和器官中合成的硫苷运输到“库”(种子)中的转运系统。该转运系统最近已经得到试验证实[34-36]。本研究基于大量芯片数据,系统分析了硫苷合成、降解、调控等82个相关基因在拟南芥79个不同发育时期和组织中的时空表达特性(图 1)。结果显示硫苷合成相关基因在营养器官中高表达,在贮藏器官中低表达,证实了植物体内确实存在一个硫苷的转运系统,负责将营养组织中合成的硫苷转运到种子组织中积累。此外,硫苷代谢途径中同源基因的表达模式相似,但有一定的差别,说明同源基因间存在部分功能冗余。
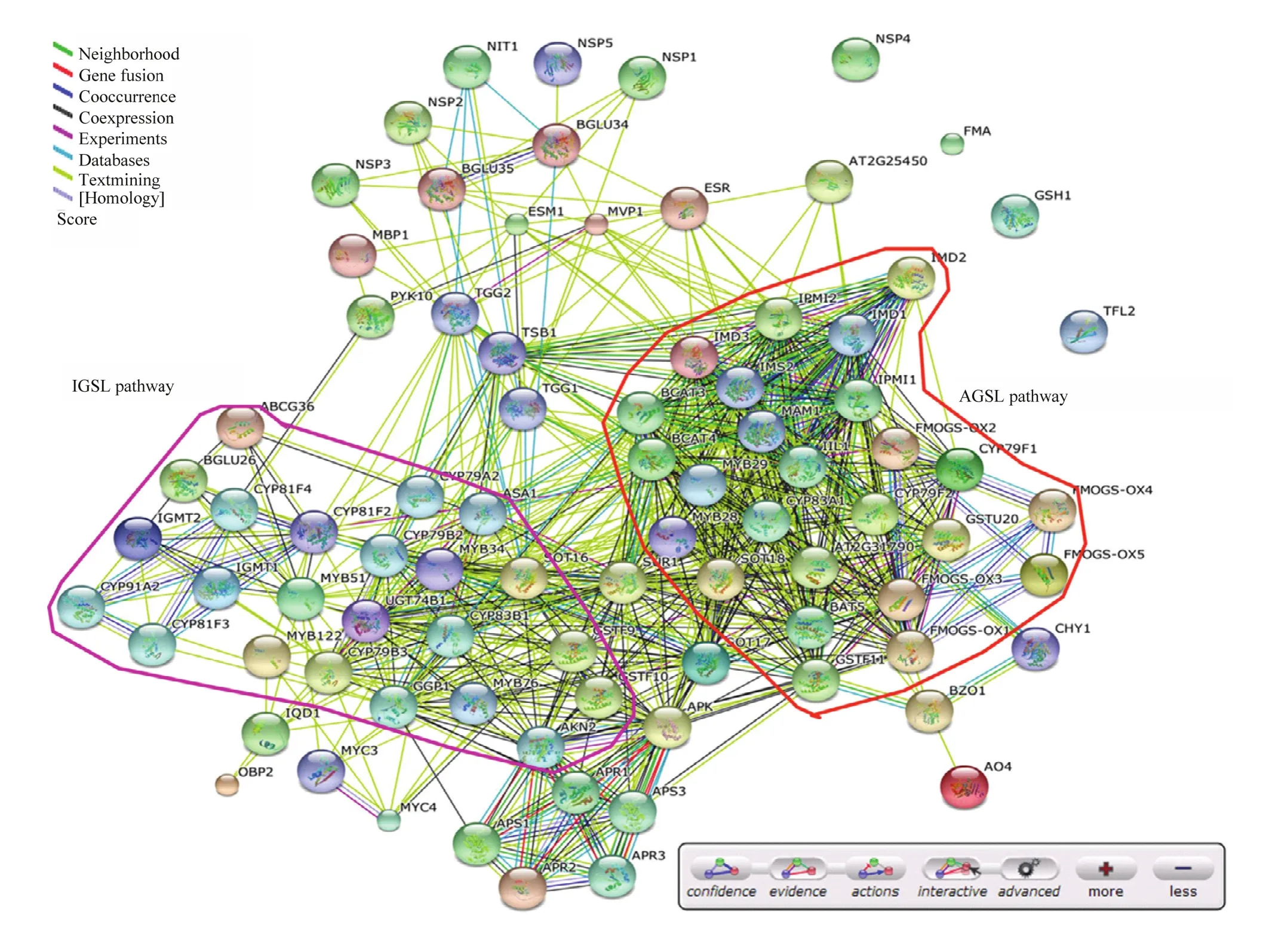
图6 拟南芥硫苷生物合成途径相关基因的共表达网络Fig. 6 The connection network of Arabidopsis glucosinolate biosynthesis genes
前人研究证明,R2R3-MYB类转录因子对吲哚族和脂肪族硫苷的生物合成具有重要的调控作用[14-16]。在拟南芥中有6个2R-MYB基因参与调控硫苷的生物合成(MYB28、MYB29、MYB34、MYB51、MYB76和 MYB122)。其中,MYB28、MYB29和MYB67调控脂肪族硫苷的生物合成,MYB28为主效基因[37-38];而MYB34、MYB51和MYB122调控吲哚族硫苷的生物合成,MYB34为主效基因[16,39]。本研究表达谱分析结果表明,脂肪族硫苷合成的MYB调控基因和酶基因主要在地上部分营养组织中表达,而吲哚族硫苷合成的MYB调控基因和酶基因在地下和地上部分营养组织中均有表达(图1)。共表达分析结果表明,MYB调控基因与硫苷合成途径酶基因的表达模式相关性较高(图6)。例如,MYB28与CYP79F1、FMOG-OX3、UGT74C1和CYP79F1酶基因的表达模式相关性较高,说明它们可能是 MYB28调控的下游靶基因。其中,CYP79F1和CYP79F2已经被证明是MYB28的靶基因[15],证明本研究结果的准确性。以上结果表明,调控基因和结构基因共同组成了一个复杂而精细的代谢调控网络,实现对硫苷生物合成的精细调控。
硫苷作为十字花科植物特有的一类次生代谢产物,其降解产物具有多种生化活性,对植物的防御系统和动物的健康均非常重要[2-7]。在生产中,硫苷及其降解产物具有双重作用。例如在油菜生产中,一方面硫苷的降解产物是菜籽饼粕中主要的抗营养因子,严重影响其作为动物饲料的食用安全性和适口性,限制了菜籽饼粕蛋白质资源的开发利用,同时也不利于油菜作为饲草或油-菜兼用的开发应用。另一方面,硫苷又对油菜的抗性和营养保健功能有重要作用,具有较强的防腐和抗菌作用,可作为杀虫剂、杀菌剂、抗微生物制剂和天然的生物熏蒸消毒剂等[40-42]。在植物的防御体系中完整的硫苷并不具有生物学活性,介导植物与昆虫互作的主要是经黑芥子酶水解的硫苷降解物,二者构成了熟知的“芥子油弹(mustard oil bomb)”,在植物防御系统中起重要作用[43]。本研究通过分析拟南芥中硫苷合成相关基因在不同组织和时期、不同生物和非生物胁迫下的表达特性,发现大多数情况下硫苷降解和合成相关基因的表达模式相似(图1),它们共同组成了一个紧密的生物防御体系,以抵御植株可能受到的逆境胁迫。硫苷降解相关基因在不同组织和时期、不同生物和非生物胁迫下的表达谱存在明显的差异,表明降解酶基因受不同胁迫因子的诱导,进而产生相应的硫苷降解产物以抵御各种逆境胁迫。其中,吲哚族硫苷合成相关基因更易受病、虫害的胁迫诱导表达(图 3),推测该类物质是拟南芥中主要的化学防御物质,对其防御系统有重要的作用。另外,本研究还发现,部分基因的表达受到生物和非生物胁迫因子的共同诱导,例如脂肪族硫苷合成相关基因BCAT4、LeuD1、BAT5和吲哚族硫苷合成相关基因UGT74B1、CYP79B2、CYP81B1等同时受到生物和非生物的胁迫诱导表达(图3和图4)。
基因的表达模式对推断基因功能、基因间互作等具有重要的作用。虽然因为转录后修饰等机制,导致基因的转录水平与其蛋白水平可能不完全一致,但是表达谱是基因表达为相应蛋白、行使其生物学功能的重要前提,可以为揭示基因的时空表达规律和功能提供重要的线索。本研究结果为进一步在蛋白水平揭示硫苷的合成和积累规律,并在具有重要农艺性状的十字花科作物中开展相关研究提供了重要的参考。
4 结论
对拟南芥硫苷生物合成途径 82个结构基因和调控基因的组织和生物及非生物胁迫诱导的表达谱进行系统的分析表明,硫苷合成相关基因主要在营养组织中高表达、在生殖器官中低表达。吲哚族硫苷生物合成相关基因的表达容易受到病原菌、虫害、高温等逆境胁迫的影响,并且硫苷合成途径相关基因的表达模式具有较高的相关性。
References
[1] FAHEY J W, ZHANG Y, TALALAY P. Broccoli sprouts: An exceptionally rich source of inducers of enzymes that protect against chemical carcinogens. Proceedings of the National Academy of Sciences of the United States America, 1997, 94: 10367-10372.
[2] FAHEY J W, ZALCMANN A T, TALALAY P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry, 2001, 56: 5-51.
[3] YAN X F, CHEN S X. Regulation of plant glucosinolate metabolism. Planta, 2007, 226: 1343-1352.
[4] KLIEBENSTEIN D J, KROYMANN J, MITCHELL-OLDS T. The glucosinolate-myrosinase system in an ecological and evolutionary context. Current Opinion in Plant Biology, 2005, 8: 264-271.
[5] NATELLA F, MALDINI M, LEONI G, SCACCINI C. Glucosinolates redox activities: Can they act as antioxidants? Food Chemistry, 2014,149: 226-232.
[6] STOTZ H U, SAWADA Y, SHIMADA Y, HIRAI M Y, SASAKI E,KRISCHKE M, BROWN P D, SAITO K, KAMIYA Y. Role of camalexin, indole glucosinolates, and side chain modification of glucosinolate-derived isothiocyanates in defense of Arabidopsis against Sclerotinia sclerotiorum. The Plant Journal, 2011, 67: 81-93.
[7] WINDE I, WITTSTOCK U. Insect herbivore counteradaptations to the plant glucosinolate-myrosinase system. Phytochemistry, 2011, 72:1566-1575.
[8] ROHR F, ULRICHS C, SCHREINER M, ZRENNER R, MEWIS I. Responses of Arabidopsis thaliana plant lines differing in hydroxylation of aliphatic glucosinolate side chains to feeding of a generalist and specialist caterpillar. Plant Physiology and Biochemistry, 2012, 55:52-59.
[9] SANTOLAMAZZA-CARBONE S, VELASCO P, SOENGAS P,CARTEA M E. Bottom-up and top-down herbivore regulation mediated by glucosinolates in Brassica oleracea var. acephala. Oecologia, 2014, 174: 893-907.
[10] PRAKASH D, GUPTA C. Glucosinolates: The phytochemicals of nutraceutical importance. Journal of Complementary&Integrative Medicine, 2012, 9: 1553-3840.
[11] DINKOVA-KOSTOVA A T, KOSTOV R V. Glucosinolates and isothiocyanates in health and disease. Trends in Molecular Medicine,2012, 18: 337-347.
[12] WITTSTOCK U, HALKIER B A. Glucosinolate research in the Arabidopsis era. Trends in Plant Science, 2002, 7: 263-270.
[13] SØNDERBY I E, GEUFLORES F, HALKIER B A. Biosynthesis of glucosinolates-gene discovery and beyond. Trends in Plant Science,2010, 15: 283-290.
[14] BUROW M, HALKIER B A, KLIEBENSTEIN D. Regulatory networks of glucosinolates shape Arabidopsis thaliana fitness.Current Opinion in Plant Biology, 2010, 13: 347-352.
[15] SØNDERBY I E, BUROW M, ROWE H C, KLIEBENSTEIN D J,HALKIER B A. A complex interplay of three R2R3-MYB transcription factors determines the profile of aliphatic glucosinolates in Arabidopsis. Plant Physiology, 2010, 153: 348-363.
2.1 身体动作的呈现形式丰富成套动作层次感 动作轨迹,即指在做动作时,身体或身体某部分所移动的路线。包括:轨迹形状(直线、曲线、弧线等)、轨迹方向(前后、左右、上下等6个基本方向及各种旋转与环绕等)和轨迹幅度(长度、角度)[2]。运动员的运动轨迹与方向的多变将直接在视觉上留给裁判和观众第一印象,其必须以变化多样且完整的方式利用整个地面区域,并创造出不同的模式[3]。
[16] GIGOLASHVILI T, BERGER B, MOCK H P, MÜLLER C,WEISSHAAR B, FLÜGGE U I. The transcription factor HIG1/ MYB51 regulates indolic glucosinolate biosynthesis in Arabidopsis thaliana. The Plant Journal, 2007, 50: 886-901.
[17] SCHWEIZER F, FERNÁNDEZ-CALVO P, ZANDER M,DIEZ-DIAZ M, FONSECA S, GLAUSER G, LEWSEY M G, ECKER J R, SOLANO R, REYMOND P. Arabidopsis basic helix-loop-helix transcription factors MYC2, MYC3, and MYC4 regulate glucosinolate biosynthesis, insect performance, and feeding behavior. The Plant Cell,2013, 25: 3117-3132.
[18] FRERIGMANN H, BERGER B, GIGOLASHVILI T. bHLH05 is an interaction partner of MYB51 and a novel regulator of glucosinolate biosynthesis in Arabidopsis. Plant Physiology, 2014, 166: 349-369.
[19] SKIRYCZ A, REICHELT M, BUROW M, BIRKEMEYER C,ROLCIK J, KOPKA J, ZANOR M I, GERSHENZON J, STRNAD M,SZOPA J, MUELLER-ROEBER B, WITT I. DOF transcription factor AtDof1.1 (OBP2) is part of a regulatory network controlling glucosinolate biosynthesis in Arabidopsis. The Plant Journal, 2006,47: 10-24.
[20] GIGOLASHVILI T, ENGQVIST M, YATUSEVICH R, MÜLLER C,FLÜGGE U I. HAG2/MYB76 and HAG3/MYB29 exert a specific and coordinated control on the regulation of aliphatic glucosinolate biosynthesis in Arabidopsis thaliana. New Phytologist, 2008, 177:627-642.
[21] LI Y, SAWADA Y, HIRAI A, SATO M, KUWAHARA A, YAN X, HIRAI M Y. Novel insights into the function of Arabidopsis R2R3-MYB transcription factors regulating aliphatic glucosinolate biosynthesis. Plant &Cell Physiology, 2013, 54: 1335-1344.
[22] FRERIGMANN H, GIGOLASHVILI T. MYB34, MYB51 and MYB122 distinctly regulate indolic glucosinolate biosynthesis in Arabidopsis thaliana. Molecular Plant, 2014, 7: 814-828.
[23] PETERSEN B L, CHEN S, HANSEN C H, OLSEN C E, HALKIER B A. Composition and content of glucosinolates in developing Arabidopsis thaliana. Planta, 2002, 214: 562-571.
[25] GODA H, SASAKI E, AKIYAMA K, MARUYAMA-NAKASHITA A, NAKABAYASHI K, LI W, OGAWA M, YAMAUCHI Y,PRESTON J, AOKI K, KIBA T, TAKATSUTO S, FUJIOKA S,ASAMI T, NAKANO T, KATO H, MIZUNO T, SAKAKIBARA H,YAMAGUCHI S, NAMBARA E, KAMIYA Y, TAKAHASHI H,HIRAI M Y, SAKURAI T, SHINOZAKI K, SAITO K, YOSHIDA S,SHIMADA Y. The AtGenExpress hormone and chemical treatment data set: Experimental design, data evaluation, model data analysis and data access.The Plant Journal, 2008, 55(3): 526-542.
[26] DASH S, VAN HEMERT J, HONG L, WISE R P, DICKERSON J A. PLEXdb: Gene expression resources for plants and plant pathogens. Nucleic Acids Research, 2012, 40: 1194-1201.
[27] DE HOON M J, IMOTO S, NOLAN J, MIYANO S. Open source clustering software. Bioinformatics, 2004, 20: 1453-1454.
[28] DE VOS M, VAN OOSTEN V R, VAN POECKE R M, VAN PELT J A, POZO M J, MUELLER M J, BUCHALA A J, MÉTRAUX J P,VAN LOON L C, DICKE M, PIETERSE C M. Signal signature and transcriptome changes of Arabidopsis during pathogen and insect attack. Molecular Plant-Microbe Interactions, 2005, 18(9): 923-937.
[29] KEMPEMA L A, CUI X, HOLZER F M, WALLING L L. Arabidopsis transcriptome changes in response to phloem-feeding silverleaf whitefly nymphs. Similarities and distinctions in responses to aphids. Plant Physiology, 2007, 143(2): 849-865.
[30] FORD K A, CASIDA J E, CHANDRAN D, GULEVICH A G,OKRENT R A, DURKIN K A, SARPONG R, BUNNELLE E M,WILDERMUTH M C. Neonicotinoid insecticides induce salicylateassociated plant defense responses. Proceedings of the National Academy of Sciences the United States America, 2010, 107(41):17527-17532.
[31] SALDANHA A J. Java Treeview--extensible visualization of microarray data. Bioinformatics, 2004, 20: 3246-3248.
[32] SZKLARCZYK D, FRANCESCHINI A, WYDER S, FORSLUND K,HELLER D, HUERTA-CEPAS J, SIMONOVIC M, ROTH A,SANTOS A, TSAFOU K P, KUHN M, BORK P, JENSEN L J, VON MERING C. STRING v10: Protein-protein interaction networks,integrated over the tree of life. Nucleic Acids Research, 2015, 43:D447-452.
[33] PETERSEN B L, CHEN S, HANSEN C H, OLSEN C E, HALKIER B A. Composition and content of glucosinolates in developing Arabidopsis thaliana. Planta, 2002, 214: 562-571.
[34] NOUR-ELDIN H H, ANDERSEN T G, BUROW M, MADSEN S R,JØRGENSEN M E, OLSEN C E, DREYER I, HEDRICH R,GEIGER D, HALKIER B A. NRT/PTR transporters are essential for translocation of glucosinolate defence compounds to seeds. Nature,2012, 488(7412): 531-534.
[35] ANDERSEN T G, NOUR-ELDIN H H, FULLER V L, OLSEN C E,BUROW M, HALKIER B A. Integration of biosynthesis and long-distance transport establish organ-specific glucosinolate profiles in vegetative Arabidopsis. The Plant Cell, 2013, 25(8): 3133-3145.
[36] LÉRAN S, VARALA K, BOYER J C, CHIURAZZI M, CRAWFORD N, DANIEL-VEDELE F, DAVID L, DICKSTEIN R, FERNANDEZ E, FORDE B, GASSMANN W, GEIGER D, GOJON A, GONG J M,HALKIER B A, HARRIS J M, HEDRICH R, LIMAMI A M,RENTSCH D, SEO M, TSAY Y F, ZHANG M, CORUZZI G,LACOMBE B. A unified nomenclature of NITRATE TRANSPORTER 1/PEPTIDE TRANSPORTER family members in plants. Trends in Plant Science, 2014, 19(1): 5-9.
[37] GIGOLASHVILI T, YATUSEVICH R, BERGER B, MÜLLER C,FLÜGGE U I. The R2R3-MYB transcription factor HAG1/MYB28 is a regulator of methionine-derived glucosinolate biosynthesis in Arabidopsis thaliana. The Plant Journal, 2007, 51: 247-261.
[38] GIGOLASHVILI T, ENGQVIST M, YATUSEVICH R, MÜLLER C,FLÜGGE U I. HAG2/MYB76 and HAG3/MYB29 exert a specific and coordinated control on the regulation of aliphatic glucosinolate biosynthesis in Arabidopsis thaliana. New Phytology, 2008, 177:627-642.
[39] FRERIGMANN H, GIGOLASHVILI T. MYB34, MYB51 and MYB122 distinctly regulate indolic glucosinolate biosynthesis in Arabidopsis thaliana. Molecular Plant, 2014, 7: 814-828.
[40] 文碧玲, 李培武, 李航森, 赵力, 余萍, 邹俊清, 张文, 丁小霞, 杨湄, 汪雪芳, 吴渝. 油菜吲哚硫苷降解产物对S180小鼠抗肿瘤作用的实验研究. 中草药, 2002, 33: 331-333. WEN B L, LI P W, LI H S, ZHAO L, YU P, ZOU J Q, ZHANG W,DING X X, YANG M, WANG X F, WU Y. Studies on antitumor effect of INDL-GLN in rape on mice transplanted S180cell. Chinese Traditional and Herbal Drugs, 2002, 33: 331-333. (in Chinese)
[41] LI Y, KIDDLE G, BENNETT R N, WALLSGROVE R M. Local and systemic changes in glucosinolates in Chinese and European cultivars of oilseed rape (Brassica napus L.) after inoculation with Sclerotinia sclerotiorun (stem rot). Annals of Applied Biology, 1999, 134: 45-58.
[42] 宋志荣, 官春云. 甘蓝型油菜硫苷特性与对菌核病抗性关系. 湖南农业大学学报(自然科学版), 2008, 34: 462-465. SONG Z R, GUAN C Y. Relationship between glucosinolate characteristics and resistance to Sclerotinia sclerotiorum in Brassica napus L.. Journal of Hunan Agricultural University (Natural Science),2008, 34: 462-465. (in Chinese)
[43] WITTSTOCK U, BUROW M. Glucosinolate breakdown in Arabidopsis:Mechanism, regulation and biological significance. Arabidopsis Book,2010, 8: e0134.
(责任编辑 李莉)
Genome-Wide Expression Analysis of Glucosinolate Biosynthetic Genes in Arabidopsis Across Diverse
Tissues and Stresses Induction
DU Hai, RAN Feng, LIU Jing, WEN Jing, MA Shan-shan, KE Yun-zhuo, SUN Li-ping, LI Jia-na
(College of Agronomy and Biotechnology, Southwest University, Chongqing 400715)
【Objective】The aim of this study is to analyze the expression profiles of Arabidopsis glucosinolate biosynthetic genes in different tissues at different developmental stages and under various stress treatments, so as to facilitate the identification ofthe key genes involved in controlling glucosinolate biosynthesis and provide valuable information for exploring the metabolic mechanism of glucosinolate biosynthesis as well as their functions in plant defenses. 【Method】 The dynamic expression profiles of 82 glucosinolate biosynthetic structural genes and regulating genes across a wide range of developmental stages and biotic and abiotic stresses were examined, based on ten expression microarray data and two RNA-Seq data in PLEXdb and AtGenExpress database. The expression patterns of ten key structural genes and regulating genes involved in glucosinolate biosynthesis pathway were further confirmed by Real-time PCR method. The correlation of the expression patterns of glucosinolate biosynthesis related genes was analyzed by STRING v10 software. 【Result】 The expressions of candidate genes between vegetative and reproductive organs were significantly different, with the majority of the candidate genes have higher expression levels in vegetative organs and lower expression levels in reproductive organs, indicating glucosinolates were mainly synthesized in vegetative tissues. The aliphatic glucosinolate biosynthesis genes were preferential expressed in shoot, such as stems and leaves, while indolic glucosinolate related genes were highly expressed in both of root and shoot, such as roots, stems and leaves. Moreover, the expressions of genes in a given tissue at different developmental stages were generally distinct, implying a temporal and spatial expression pattern. Real-time PCR analyses revealed that the expression profiles of the ten representive glucosinolate biosynthetic genes kept consistent with the results of microarray data assay. Furthermore, the expressions of aliphatic and indolic glucosinolate biosynthesis genes were tend to be induced by many bio- and abio-stresses, whereas indolic glucosinolate biosynthesis related genes were obviously induced by bio- and abio-stresses, such as Pseudomonas syringae, Alternaria brassicicola, Myzus persicae, low temperature (4℃), salt and high temperature (38℃). In addition, co-expression analysis revealed that the expressions of regulating genes were highly correlated to those of metabolic genes in aliphatic or indolic glucosinolate biosynthesis pathway. 【Conclusion】 The glucosinolates biosynthesis genes were preferentially expressed in vegetative tissues, as compared to seed tissues. There is a transport system that is responsible for transporting glucosinolates that were synthesized in vegetative tissues to seed tissues. The expressions of indolic glucosinolate biosynthesis genes tend to be induced by bio- and abio-stresses, indicating indolic glucosinolates are more important for Arabidopsis defense.
Arabidopsis thaliana; glucosinolates; expression patterns; development stage; biotic stresses; abiotic stresses; realtime PCR
2016-03-09;接受日期:2016-05-20
国家自然科学基金(31471528)、国家“973”项目(2015CB150201)、国家博士后基金面上项目(2014M552297)、中央高校基本科研业务费专项资金(SWU113104,XDJK2014B035和2362015xk05)、国家级大学生创新创业训练计划(201510635026,201610635019)
联系方式:杜海,Tel:1822348008;E-mail:haidu81@aliyun.com。通信作者李加纳,Tel:13509496702;E-mail:ljn1950@swu.edu.cn
