鲍曼不动杆菌临床分离株外排泵分布水平与碳氢酶烯类抗生素耐药研究*
2016-09-16李卓成张彦鹏吴伟清李延武丁芳林
李卓成,张彦鹏,吴伟清,李延武,丁芳林
(广东省深圳市第二人民医院检验科 518000)
鲍曼不动杆菌临床分离株外排泵分布水平与碳氢酶烯类抗生素耐药研究*
李卓成,张彦鹏,吴伟清,李延武,丁芳林
(广东省深圳市第二人民医院检验科518000)
目的研究鲍曼不动杆菌临床分离株中外排泵分布水平与碳氢酶烯类抗生素耐药相关情况。方法选择2015~2016年度深圳地区临床分离的182株鲍曼不动杆菌,同时进行外排泵抑制试验和肉汤稀释法药敏试验,并对结果按照药敏和外排泵表型两种因素分组进行统计学分析。结果鲍曼不动杆菌182株临床分离株中,外排泵表型阳性54株(29.7%);结合碳氢酶烯类抗生素药敏分组统计,阳性组中耐药和敏感分别为31.9%和13.9%,差异有统计学意义(χ2=4.46,P<0.05)。结论鲍曼不动杆菌外排泵耐药机制在临床分离株的碳氢酶烯类抗生素耐药中起作用。
鲍曼不动杆菌;外排泵;耐药
鲍曼不动杆菌是一类重要的革兰染色阴性的非发酵医院内感染病原菌,常引起医院内免疫功能低下患者严重的呼吸机相关性肺炎、手术伤口部位感染、泌尿道感染、血流感染及继发性脑膜炎等[1]。随着近年来广谱抗生素普遍使用等原因,临床上鲍曼不动杆菌的多重耐药株和泛耐药株在世界范围内不断涌现[2]。碳青霉烯类抗生素是目前临床治疗鲍曼不动杆菌感染最有效的抗菌药物之一[3]。常见的有亚胺培南(IPM)和美罗培南(MEO)等,能够抵抗大多数超广谱β-内酰胺酶(ESBL)和AmpC的水解。近年来,耐碳青霉烯类抗生素的鲍曼不动杆菌耐药比例也逐年增高,而其耐药一旦突破碳青霉烯类,人类将面临无药可选的窘境[4]。鲍曼不动杆菌针对碳氢酶烯类抗生素的耐药机制主要有4类:(1)表达碳氢酶烯酶。主要是Ambler分类中的D类酶,即苯唑西林酶(OXA),包括OXA-23、OXA-24、OXA-51和OXA-58[5]。(2)产生构象改变的青霉素结合蛋白降低碳氢酶烯类抗生素的结合量。(3)下调外膜通道蛋白的表达或缺如,如Car类、OPM类,从而减少抗生素进入细菌[5]。(4)多种外排泵基因的过量表达,将进入细菌的抗生素主动排出。鲍曼不动杆菌的外排泵主要有5大家族,其中最重要的为RND家族,包括均由3部分构成的AdeABC、AdeFGH和AdeIJK等外排泵[6]。细菌外排泵对药物的外排作用是主动耗能过程,其能力源于质子的浓度梯度,而羰基氰氯苯腙(carbonyl cyanide-m-chlorophenyl hydrazone,CCCP)可以抑制质子转运的解偶联剂,通过破坏质子浓度梯度,抑制主动外排系统的外排作用[7]。本研究拟使用CCCP作为泵抑制剂,研究鲍曼不动杆菌临床分离株外排泵的分布水平,并分析外排泵表型与碳氢酶烯类抗生素耐药的相关性。
1 资料与方法
1.1菌株来源2015~2016年分离自深圳市第二人民医院的182株鲍曼不动杆菌临床分离株。细菌分离培养按《全国临床检验操作规程进行》进行[8],所有菌株均经过鉴定,剔除分离自同一患者相同部位标本的重复菌株。
1.2仪器与试剂全自动微生物分析仪(VITEK-2 COMPACT)购自法国生物梅里埃公司;泵抑制剂CCCP来源于Sigma公司;MH平板和MH肉汤来源于郑州贝瑞特公司,无菌聚苯乙烯96孔板来源于美国CORNING公司;IPM标准品来源于中国药品生物制品检定研究院,IPM溶剂选择pH8.0的磷酸盐缓冲液(PBS),浓度为1 280 μg/mL,分装后贮存于-70 ℃保存备用;恒温振荡培养箱为太仓实验设备厂生产。
1.3质控菌株鲍曼不动杆菌ATCC17978,大肠埃希菌ATCC25922,金黄色葡萄球菌ATCC25923。质控菌株源于卫生部临床检验中心。
1.4鲍曼不动杆菌外排泵抑制实验复苏冻存于-70 ℃超低温冰箱的菌株,接种于MH平板37 ℃培养10~16 h后,选择鲍曼不动杆菌典型单菌落接种于MH肉汤培养基;37 ℃ 180 r/min恒温振荡过夜培养16~18 h后,配置菌液浓度0.5个麦氏单位,用MH肉汤1∶1 000稀释后每孔中100 μL接种以下2种96孔板。(1)泵抑制实验板:各孔含终浓度10 μg/mL的CCCP,且每行第1~12孔从左到右含终浓度为128、64、32、16、8、4、2、1、0.5、0.25、0.125、0 μg/mL的IPM,每行最后1孔均为仅含相同浓度CCCP的MH肉汤做生长对照孔;(2)最小抑菌浓度(MIC)测定板:不含CCCP,且每行各孔从左到右含终浓度为128、64、32、16、8、4、2、1、0.5、0.25、0.125、0 μg/mL的IPM;将各96孔板置于37 ℃普通空气孵箱中,孵育16~20 h判断结果[9]。
1.5结果判断各菌株MIC结果判读按2010 版美国临床实验室标准化委员会(CLSI) 标准进行,且96孔板相应最后一列生长对照孔内细菌明显生长外排泵抑制实验才成立[9]。如微量肉汤稀释法测定各菌株MIC值出现跳孔现象,则选择抑制细菌生长的较高药物浓度为其MIC值。如出现多处跳孔,则需重复试验进行测定。各菌株外排泵阳性表型的判断标准:存在泵抑制剂CCCP时的菌株MIC测定结果比不存在CCCP的MIC值下降4倍及以上。
1.6统计学处理采用SPSS16.0软件进行数据处理,使用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1鲍曼不动杆菌临床分离株的科室分布鲍曼不动杆菌临床分离株共计182株,其中重症监护室(ICU)病区分离株最多,共78株(42.8%);呼吸内科和神经外科的分离株也均超过10%(分别为15.3%和13.4%)。见表1。
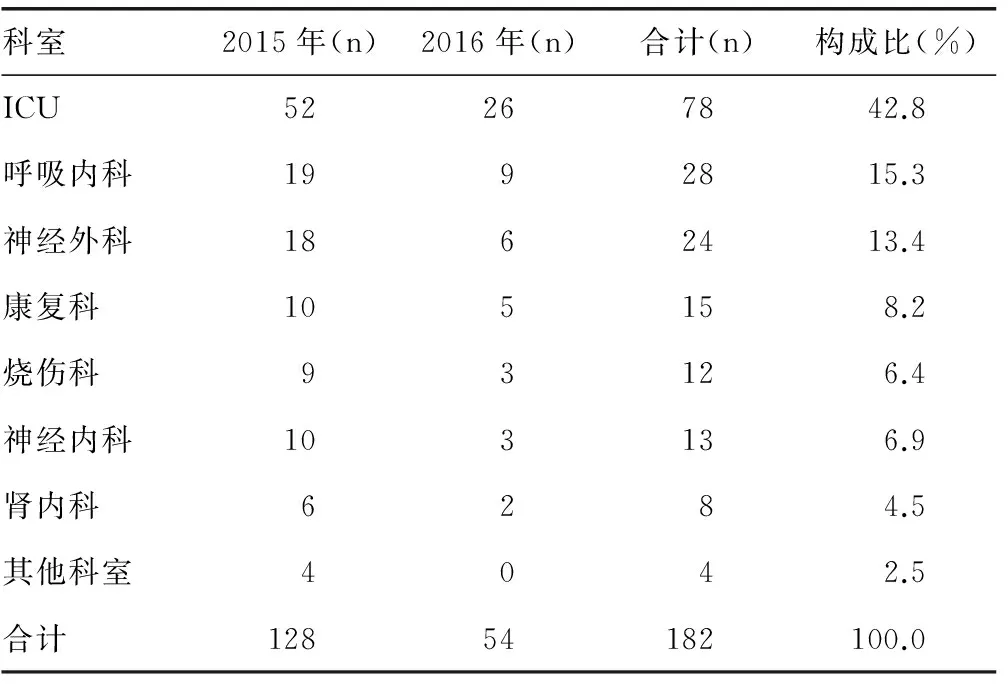
表1 182株鲍曼不动杆菌的科室分布
2.2鲍曼不动杆菌外排泵抑制实验结果将鲍曼不动杆菌临床分离株按标本类型可分为痰液(48.2%)、肺泡灌洗液(8.9%)、分泌物(10.7%)、尿液(14.3%)、血液(7.1%)和其他(10.7%)。182株鲍曼不动杆菌中,根据肉汤稀释法测定各菌株MIC结果,其中IPM敏感(S)36株(19.8%),中介(I)31株(17.0%),耐药(R)116株(63.7%)。182株鲍曼不动杆菌中外排泵表型阳性54株(29.7%),外排泵阴性表型128株(70.3%)。阳性组中S与R比较差异有统计学意义(χ2=4.46,P<0.05)。见表2。

表2 182株鲍曼不动杆菌外排泵表型与耐药表型分布
3 讨 论
鲍曼不动杆菌为条件致病的革兰阴性非发酵菌。临床分离株多源于ICU病房、呼吸科、神经外科、康复科等病区的痰液、肺泡灌洗液、分泌物等组织标本。该菌可在住院患者及医院环境中定植,且抗逆性强,是医院感染最常见的致病菌[10]。长期广谱抗生素的使用对菌株产生持续的抗生素选择压力,造成该菌耐药性逐年提高,多重耐药和泛耐药鲍曼不动杆菌不断产生[11]。全国耐药监测网监测数据(2014年)显示该菌对于青霉素类、头孢菌素类、碳青霉烯类、喹诺酮类、氨基糖苷类抗生素的耐药水平均超过60%[12];鲍曼不动杆菌多重耐药,甚至泛耐药菌株的出现,成为医院感染控制和临床治疗的重大威胁,被喻为革兰阴性菌中的“耐甲氧西林金黄色葡萄球菌(MRSA)”[7]。本研究所用的182株鲍曼不动杆菌对碳氢酶烯类抗生素IPM耐药率为63.7%,且有17%为中介,对其敏感的菌株仅占19.8%,菌株耐药控制的境况不容乐观。
药物外排泵机制是鲍曼不动杆菌重要的耐药机制,迄今为止已发现20余种外排泵[12],可以大致分为5大外排泵家族,其中最重要的为RND家族,包括均由3个蛋白质部分构成的AdeABC、AdeFGH和AdeIJK等外排泵[13]。这些外排泵多为能量依赖型外排泵,利用质子或Na+离子偶联交换提供动力,能够将多种抗生素、金属离子、表面活性剂和多种消毒剂排出细胞外[14]。2013年西班牙学者 Rumbo等[4]研究了鲍曼不动杆菌5大外排泵家族近20种外排泵在临床菌株中的大致分布情况,以及外排泵机制对于菌株耐药水平影响;有研究发现主动外排泵机制是细菌抵御外界抗生素压力等不良环境和因素的重要手段,成为细菌获得性多重耐药的重要原因[7,15]。
本研究中,临床分离的182株鲍曼不动杆菌中,约有54株(29.7%)有外排泵机制,阳性组中S与R比较差异有统计学意义(χ2=4.46,P<0.05)。提示鲍曼不动杆菌主动外排泵的耐药机制在本研究临床分离株对碳青霉烯类抗生素的耐药机制中起作用,通过抑制外排泵的对碳氢酶烯类抗生素主动泵出,提高了菌体内抗生素有效水平从而降低了MIC值。可以认为,较低的毒副作用和较高外排抑制活性,成为开发前景良好的外排泵抑制剂类新型抗生素的必要条件。
[1]王辉,郭萍,孙宏莉,等.碳青霉烯类耐药的不动杆菌分子流行病学及其泛耐药的分子机制[J].中国检验医学杂志,2006,29(12):1066-1073.
[2]Jia W,Li C,Zhang H,et al.Prevalence of Genes of OXA-23 Carbapenemase and AdeABC Efflux Pump Associated with Multidrug Resistance of Acinetobacter baumannii Isolates in the ICU of a Comprehensive Hospital of Northwestern China[J].Int J Environ Res Public Health,2015,12(8):10079-10092.
[3]朱德妹,汪复,胡付品,等.2010年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2011,11(5):321-329.
[4]Rumbo C,Gate E,López M,et al.Contribution of efflux pumps,porins,and beta-lactamases to multidrug resistance in clinical isolates of Acinetobacter baumannii[J].Antimicrob Agents Chemother,2013,57(11):5247-5257.
[5]沈继录,朱德妹,吴卫红,等.革兰阴性杆菌碳青霉烯酶产生与细菌耐药性关系的研究[J].中华检验医学杂志,2008,31(4):408-414.
[6]侯天文,尹晓琳,李玮,等.多重耐药鲍曼不动杆菌相关耐药基因检测分析[J].中华微生物学和免疫学杂志,2007,27(4):379-383.
[7]Yoon EJ,Courvalin P,Grillot-Courvalin C.RND-type efflux pumps in multidrug-resistant clinical isolates of Acinetobacter baumannii:major role for AdeABC overexpression and AdeRS mutations[J].Antimicrob Agents Chemother,2013,57(7):2989-2995.
[8]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006.
[9]Richmond GE,Chua KL,Piddock LJ.Efflux in Acinetobacter baumannii can be determined by measuring accumulation of H33342 (bis-benzamide)[J].J Antimicrob Chemother,2013,68(7):1594-1600.
[10]王辉,刘颖梅,陈民钧,等.鲍曼不动杆菌对碳青霉烯类耐药机制的研究[J].中国医学科学院学报,2003,25(5):567-571.
[11]Hornsey M,Loman N,Warcham DW,et al.Whole-genome comparison of two Acinetobacter baumannii isolates from a single patient,where resistance developed during tigecycline therapy[J].J Antimicrob Chemother,2011,66(7):1499-1503.
[12]Coldham NG,Webber M,Woodward MJ,et al.A 96-well plate fluorescence assay for assessment of cellular permeability and active efflux in Salmonella enterica serovar Typhimurium and Escherichia coli[J].J Antimicrob Chemother,2010,65(8):1655-1663.
[13]Tiwari V,Tiwari M.Quantitative proteomics to study carbapenem resistance in Acinetobacter baumannii[J].Front Microbiol,2014,5:512.
[14]Hornsey M,Ellington MJ,Doumith M,et al.AdeABC-mediated efflux and tigecycline MICs for epidemic clones of Acinetobacter baumannii[J].J Antimicrob Chemother,2010,65(8):1589-1593.
[15]Seifert H,Dolzani L,Bressan R,et al.Standardization and interlaboratory reproducibility assessment of pulsed-field gel electrophoresis-generated fingerprints of Acinetobacter baumannii[J].J Clin Microbiol,2005,43(9):4328-4335.
Study on the distribution of efflux pump and the antibiotic resistance of carbapenems in clinical isolates of Acinetobacter Bauman*
Li Zhuocheng,Zhang Yanpeng,Wu Weiqing,Li Yanwu ,Ding Fanglin
(Department of Clinical Laboratory,the Second People′s Hospital of Shenzhen City,Shenzhen,Guangdong 518000,China)
ObjectiveTo study the distribution of efflux pump and the antibiotic resistance of carbapenems in clinical isolates of 182 strains of Bauman Acinetobacter,and to understand the correlation between distribution of efflux pump and the drug resistance of hydrocarbon.MethodsTotally 182 clinical isolates of Acinetobacter Baumannii were selected to detect the efffux phenotype,which were separated between 2015 to 2016 isolated from Shenzhen district,Guangdong province.Efflux pump inhibition test and broth dilution method drug sensitivity test were used.According to the results of the drug sensitivity and the phenotype of efflux pump,Acinetobacter Baumannii were divided into groups(carbapenems resistance group,carbapenems sensitive group,efflux pump positive group and efflux pump negative group),then the results were made statistically analysis.ResultsIn all the 182 isolates,there were 54 strains with positive efflux pump phenotype,and the positive rate was 29.7%.And the efflux phenotype positive rate was 31.9% in carbapenems resistance group,comparing to 13.9% positive rate in carbapenems sensitive group(χ2=4.46,P<0.05).ConclusionThe efflux pumps paly an important role in the resistant mechanism of Acinetobacter Baumannii clinical isolates to carbapenems.
acinetobacter baumannii;efflux pump;resistance
深圳市科技创新委员会“知识创新计划”项目(JCYJ20140414170821183)。作者简介:李卓成(1959-),主任技师,硕士,主要从事临床微生物与免疫研究。
论著·临床研究10.3969/j.issn.1671-8348.2016.22.012
R378
A
1671-8348(2016)22-3057-03
2016-02-21
2016-04-09)
