桑椹渣去糖工艺研究
2016-09-16程水明林朝霞陈亨坚周国钰
程水明,林朝霞,陈亨坚,曾 霞,周国钰
(广东石油化工学院 果蔬加工与贮藏工程技术开发中心,广东 茂名 525000)
桑椹渣去糖工艺研究
程水明,林朝霞,陈亨坚,曾霞,周国钰
(广东石油化工学院 果蔬加工与贮藏工程技术开发中心,广东 茂名 525000)
以桑椹酿酒后果渣为原料,使用糖化酶对桑椹果渣进行去糖,通过单因素及正交试验进行桑椹果渣中不溶性膳食纤维提取前去糖工艺条件优化。结果表明,去糖最佳工艺条件为糖化酶2 g/kg、酶解时间90 min、酶解温度63℃、pH值为4。
桑椹果渣;糖化酶;去糖工艺
桑椹(Fructus mori)为桑科(Moraceae)植物桑(Morus alba)的干燥果穗,又名桑实、桑栆、黑椹、乌椹等,为多年生桑科落叶乔木桑树的成熟果穗。桑椹含有19种氨基酸,氨基酸含量比核果类高4.0~6.5倍,含有丰富的矿物质,其中钙含量为橙、草莓的1.5~3.0倍,为葡萄、杏的4~5倍[1]。桑椹营养丰富,既是食品又是药品,含有多种功能成分,如多糖、多酚、白藜芦醇等[2],是一种较好的农产品资源,为加工桑椹果汁、桑椹酒[3]、桑椹果醋[4]、桑椹红茶[5]等的良好原料。它能滋阴补血,生津润燥,用于肝肾阴虚,眩晕耳鸣,心悸失眠,须发早白,津伤口渴,内热消渴,肠燥便秘[6]。桑椹柔软含水量高,不易贮藏或运输,极易腐烂。目前桑椹利用主要集中在果汁与酿酒方面,尤其是桑椹加工旺季,渣皮堆积如山,经微生物分解极易腐烂,酸臭难闻,严重污染环境[7]。桑椹渣的处理成为困扰众多生产厂家的一大难题。桑椹渣中含有丰富的膳食纤维,不溶性膳食纤维是植物细胞壁的组成成分,包括纤维素、半纤维素、木质素、壳聚糖和植物蜡等[8]。其具有独特的生理功能,如摄入适量的不溶性膳食纤维,能增加饱腹感,减少食物的总摄入量,治疗肥胖症[9];不溶性膳食纤维具有较高的持水力和溶胀性,能增加粪便的体积并使之变得柔软,加速小肠蠕动,起到促进排便的作用,从而预防便秘和肠道疾病[10-11]。从桑椹渣中提取膳食纤维不仅可以提高桑椹深加工产品的附加值,延长产业链,而且能变废为宝,解决环境污染问题,具有良好的经济效益和社会效益,从中提取不溶性膳食纤维是废弃物资源综合利用的有效措施[12-13]。目前关于桑椹多糖的药理作用以及提取工艺的研究已有大量报道,但提取方法一般为浸提法和回流提取法,其工艺复杂,耗时较长[14-15]。多糖(polysaccharides)是存在于自然界的醛糖和(或)酮糖通过糖苷键连接在一起的聚合物,是生物体内除蛋白质和核酸以外的又一类重要的信息分子[16]。近年来,酶法作为一种提取生物活性成分的新技术的报道日益增多[17],其方法高效简单,国内外对桑椹果渣中不溶性膳食纤维研究很少。本研究主要探讨桑椹果渣制备不溶性膳食纤维前去糖工艺,并测定去糖效果,旨在对桑椹废弃资源及副产品加工提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1原材料
桑椹:由广东省粤西蚕桑实验基地提供,品种为“大十”,果实酿酒后果渣经晒干后粉碎备用。
1.1.2主要试剂
糖化酶(100 U/mg):吉生物科技有限公司:氢氧化钠、结晶酚、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):上海润捷化学试剂有限公司;浓盐酸:广州市东红化工厂;酒石酸钾钠、无水亚硫酸钠:天津市大茂化学试剂厂。所有试剂均为分析纯。
1.2仪器与设备
HH-4数显恒温水浴锅、80-2电动离心机:常州澳华仪器有限公司;V-5000紫外分光光度计:上海元析仪器有限公司;D2F-6050型真空干燥箱:上海博讯实业有限公司医疗设备厂;FA2104电子天平:上海度平仪器仪表有限公司:DF-15粉碎机:浙江温岭市林大机械有限公司;雷磁PHS-3C pH计:上海仪电科学仪器股份有限公司。
1.3试验方法
1.3.1桑椹果渣中糖的去除
取10 g酿酒后桑椹渣于250 mL的锥形瓶中,加纯化水100 mL,糖化酶0.03 g,将锥形瓶置于60℃中水浴60 min,100℃热水灭酶5 min,冷却,过滤,滤渣备用。
1.3.2单因素试验
以糖化酶用量、酶作用时间、酶作用温度、酶作用pH值为单因素试验影响因素,以溶液中单糖含量的变化为指标,考察各因素对桑椹果渣中糖去除效果的影响。
1.3.3酶解条件优化正交试验
在单因素试验基础上,确定酶作用时间、糖化酶用量、酶作用pH值、酶作用温度作4因素3水平正交试验,以溶液中单糖含量的变化为评价指标,探讨桑椹果渣中糖去除效果的最佳工艺条件。正交试验因素与水平见表1。

表1 酶解条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for enzymolysis conditions optimization
1.3.4糖化酶去糖效果测定[18-20]
(1)待测液准备
取10 mL糖化酶处理后滤液于离心管,3 000 r/min离心15 min,吸上清0.5 mL于试管中,加1.5 mL 3,5-二硝基水杨酸和1.5 mL蒸馏水,振荡摇匀,沸水浴5 min,冷却至室温;从管中取出1 mL溶液加到含19 mL蒸馏水试管中,振荡摇匀后置沸水中5 min,冷却至室温,备用。
(2)对照液制备
取2 mL蒸馏水加入管中,加1.5 mL 3,5-二硝基水杨酸,振荡混匀,沸水浴5 min,冷至室温,备用。
(3)待测液糖含量测定[21]
取对照液于比色皿中,在540 nm波长下用紫外分光光度计测定待测液的吸光度值,依据溶液中单糖含量与溶液吸光度值呈正比关系,亦即溶液中单糖含量越高,测得溶液吸光值越大,也就说明桑椹渣中所含糖类物质通过酶解而进入溶液中,溶液吸光度值越高,反映去糖的效果越好。
2 结果与分析
2.1糖化酶用量对去糖效果影响
取10 g桑椹渣于250 mL锥形瓶,加纯化水100 mL,pH值为4,分别加入0、1 g/kg、2 g/kg、3 g/kg、4 g/kg、5g/kg糖化酶,置60℃水浴60 min,100℃水浴灭酶5 min,冷却,离心,测定波长540 nm处吸光度值,结果见图1。
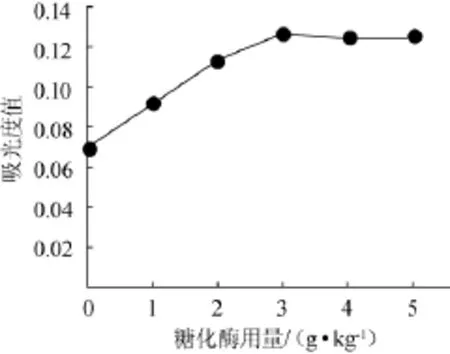
图1 糖化酶用量对桑椹果渣去糖效果的影响Fig.1 Effect of saccharifying enzyme addition on the de-sugaringprocess from mulberry pomace
由图1可知,去糖效果在糖化酶用量为0~3 g/kg,随糖化酶用量增加而提高,在用量3g/kg时去糖效果达到最大值0.127;糖化酶用量在3~5 g/kg,随酶量增加,去糖效果基本保持不变。因此,确定最佳糖化酶用量为3 g/kg果渣。
2.2酶作用时间对去糖效果影响
取10g桑椹渣于250mL锥形瓶,加纯化水100 mL,糖化酶量为0.03 g,pH值为4,置60℃水浴加热30 min、60 min、90 min、120 min、150 min,100℃水浴灭酶5 min,冷却,离心,测定波长540 nm处吸光度值,结果见图2。
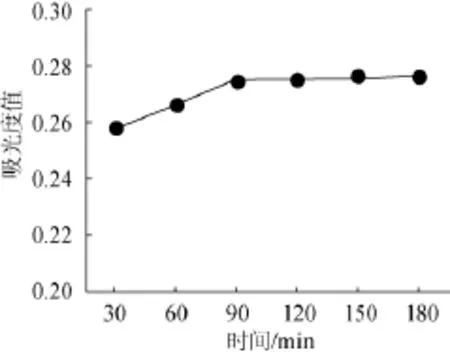
图2 糖化酶作用时间对桑椹果渣中糖去除效果的影响Fig.2 Effect of enzymatic hydrolysis time on the de-sugaring process from mulberry pomace
由图2可知,糖化酶作用时间在30~90 min,随时间增加糖去除效果提高,并在作用90 min时达最大值0.275;糖化酶作用时间在90~150 min,随着酶作用时间增加而吸光度值基本保持不变,故将酶作用时间确定为90 min。
2.3糖化酶作用pH值对去糖效果影响
取10g桑椹渣于250mL锥形瓶,加纯化水100 mL,糖化酶量0.03 g,调pH值分别为2、3、4、5、6,置60℃水浴90 min,100℃水浴灭酶5 min,冷却,离心,测定波长540 nm处吸光度值,结果见图3。
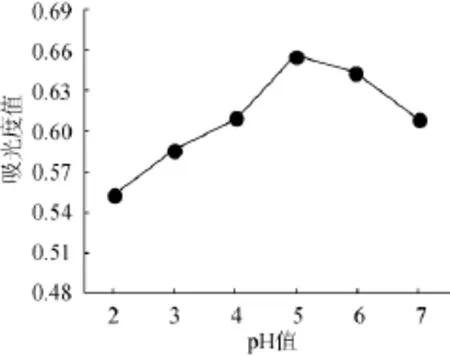
图3 糖化酶作用的pH值对桑椹果渣中去糖效果的影响Fig.3 Effect of enzymatic hydrolysis pH on the de-sugaring process from mulberry pomace
由图3可知,去糖效果在酶作用pH值为2~5,随pH值升高而增加,并在pH值5时吸光度值达最大值0.647,pH值为5~6,随pH值升高去糖效果而下降。因此确定糖化酶作用的最佳pH值为5。
2.4酶作用温度对去糖效果影响
取10 g桑椹渣于250 mL锥形瓶,加纯化水100 mL,糖化酶量为0.03 g,pH值为5,将锥形瓶分别置于54℃、57℃、60℃、63℃、66℃水浴90 min,100℃水浴行灭酶5 min,冷却,离心,测定波长540 nm处吸光度值,结果见图4。
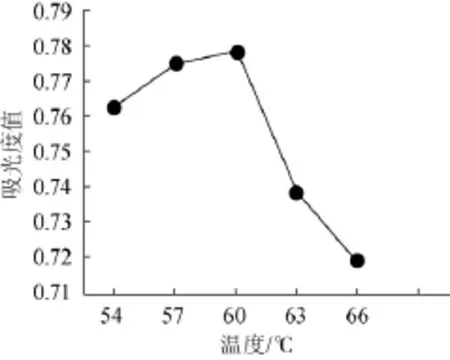
图4 糖化酶作用温度对桑椹果渣中去糖效果的影响Fig.4 Effect of enzymatic hydrolysis temperature on the de-sugaring process from mulberry pomace
由图4可知,去糖效果在糖化酶作用温度为54~60℃间随温度的升高而增加,并在酶作用温度为60℃时吸光度值达最大0.778;酶作用温度为60~66℃,随温度升高,酶活性受到抑制而急剧下降。故确定最佳糖化酶作用温度为60℃。
2.5酶解条件优化正交试验结果
结合单因素试验结果,以溶液中单糖含量的变化为指标,对糖化酶用量、酶作用时间、酶作用pH值、酶作用温度进行4因素3水平正交设计试验,正交试验结果与分析见表2。
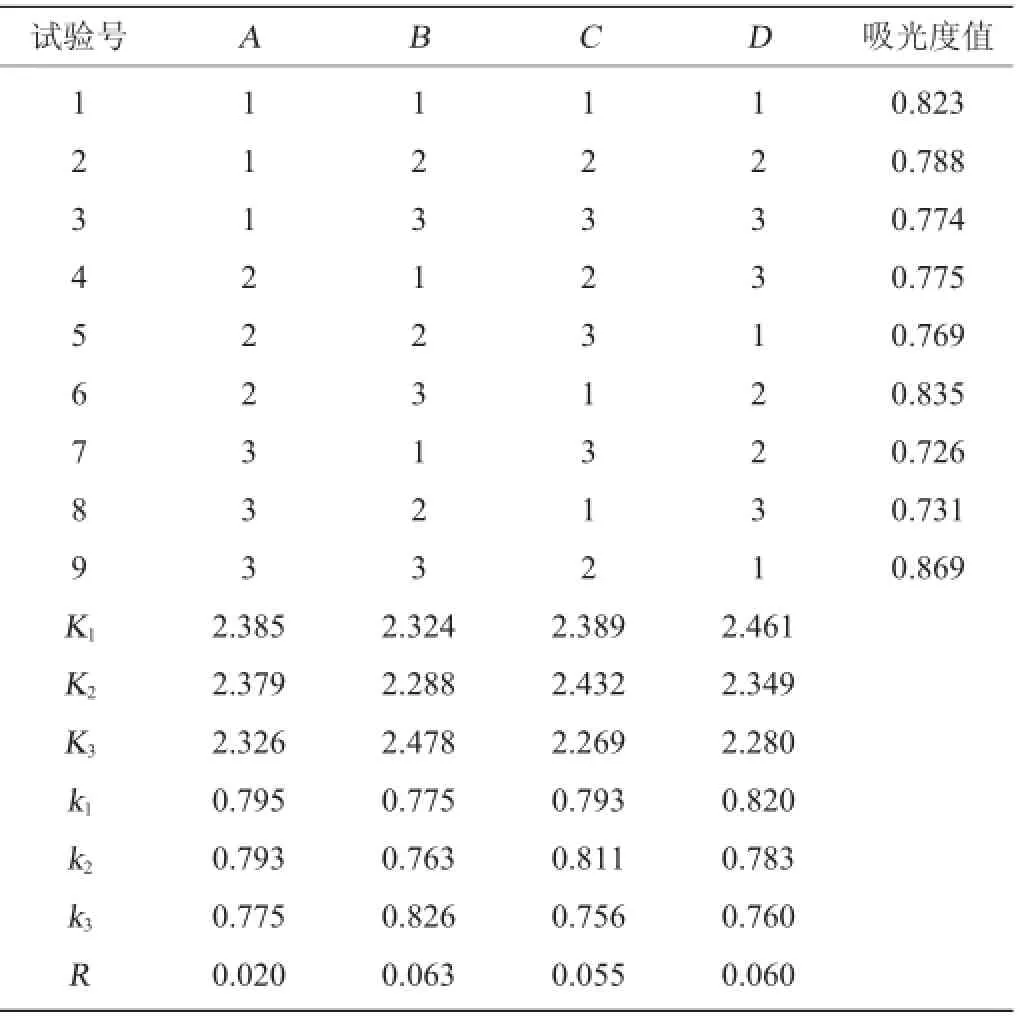
表2 酶解条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for enzymolysis conditions optimization
由表3可知,4个因素对糖化酶去糖效果影响大小为:B>D>C>A,即酶作用温度的影响最大,其次是酶作用pH值,再次是酶作用时间,最后是酶用量。根据分析结果得出的最优酶解条件组合为A1B3C2D1,即糖化酶酶量2 g/kg,酶作用时间90 min,酶作用温度63℃,酶作用pH值4。在此最佳酶解条件下进行验证试验,吸光度值为0.843,去糖效果最好。
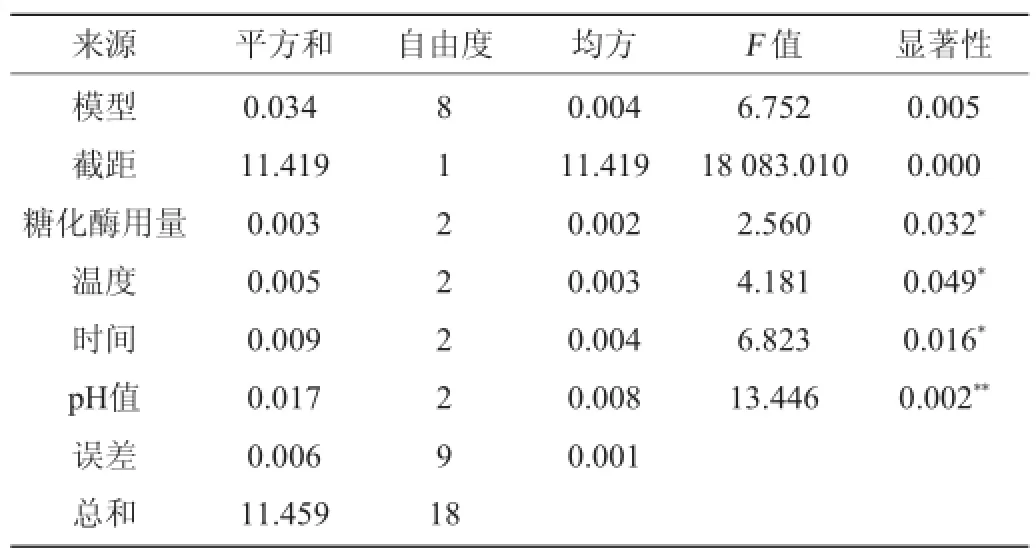
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表3可知,pH值对结果影响极显著(P<0.01),酶作用温度、酶作用时间及酶用量对结果影响显著(P<0.05)。
3 结论
本试验旨在优化桑椹多糖的酶去除工艺,用糖化酶对酿酒后桑椹渣进行去糖工艺研究,降低桑椹不溶性膳食纤维的黏度,用蒸馏水为提取剂,以桑椹多糖得率为考察指标,采用正交设计法,得出糖化酶去糖提取最佳工艺条件为酶作用温度63℃,酶作用pH值为4,酶作用时间90 min,酶用量2 g/kg果渣。
本试验采用以蒸馏水为提取剂进行提取,提取效率高,极大地缩短了提取周期,起到简化工艺流程,节省成本,减少杂质的作用,具有合理、经济、可行的优点,为桑椹多糖的去除方法及其工业化提供了新手段。
[1]吴祖芳,翁佩芳.桑椹的营养组分与功能特性分析[J].中国食品学报,2005,5(3):102-107.
[2]李良,邱庆峰,任运宏,等.桑椹葡萄复合果汁饮料的研制[J].食品工业,2012,33(2):84-85.
[3]程云燕,苏艳华,黄树文,等.广西干型桑椹酒的研制[J].广西职业技术学院学报,2010,3(3):1-3.
[4]梁贵秋,吴婧婧,李全,等.桑椹果醋发酵工艺的优化[J].食品与发酵科技,2012,48(4):46-48.
[5]陈明明,葛丹丹,马泉来,等.桑椹红茶饮料制作工艺的研究[J].保鲜与加工,2012,12(5):28-30,34.
[6]国家药典委员会.中国药典2010年版一部[S].北京:中国医药科技出版社,2010.
[7]DONNO D,CERUTTI A K,PRGOMET I,et al.Foodomics for mulberry fruit(Morusspp.):Analytical fingerprint as antioxidants'and health properties'determination tool[J].Food Res Int,2015,69(2):179-188.
[8]李学伟,朱新贵,刘滢,等.黄豆酱油渣油脂和膳食纤维的制备研究[J].中国酿造,2013,32(10):109-112.
[9]吴洪斌,王永刚,郑刚,等.膳食纤维生理功能研究进展[J].中国酿造,2012,31(3):13-16.
[10]XU C H,SHAMEY R,HINKS D.Activated peroxide bleaching of regenerated bamboo fiber using a butyrolactam-based cationic bleach activator[J].Cellulose,2010,17(2):339-347.
[11]孙颖,朱科学,钱海峰.小麦麸膳食纤维脱色工艺的研究[J].食品工业科技,2008,29(6):242-244.
[12]陶永霞,周建中,武运,等.枣渣不溶性膳食纤维脱色工艺研究[J].食品工业科技,2010,31(8):212-214.
[13]惠贤民.大孔吸附树脂纯化桑椹多糖的工艺研究[J].安徽农业科学,2009,37(6):2572-2573.
[14]张玲玲,黄兮,邱绍兵,等.微波辅助提取桑椹多糖的工艺研究[J].山东化工,2012,41(12):9-12,15.
[15]BAI X L,YUE T L,YUAN Y H,et al.Optimization of microwave-assisted extraction of polyphenols from apple pomace using response surface methodology and HPLC analysis[J].J Sep Sci,2010,33(23):3751-3758.
[16]陶遵威,郑夺,邸明,等.植物多糖的研究进展[J].药物评价研究,2010,33(2):148-152.
[17]李颖,李庆典.桑椹多糖抗氧化作用的研究[J].中国酿造,2010,29(4):59-61.
[18]董丽辉,范三微,黄贝贝,等.酶法提取亮菌多糖的研究[J].中国酿造,2012,31(4):51-54.
[19]钟方晓,任海华,李岩.多糖含量测定方法比较[J].时珍国医国药,2007,18(8):1916-1917.
[20]刘玉玲,纪国力.桑椹中多糖的提取及含量测定[J].中国医药科学,2012,2(18):109-110.
[21]李月娟,吴霞明,王君,等.食品分析及安全检测关键技术研究[J].中国酿造,2012,31(12):13-17.
Study on de-sugaring process from mulberry pomace
CHENG Shuiming,LIN Zhaoxia,CHEN Hengjian,ZENG Xia,ZHOU Guoyu
(Technology Development Center of Fruit and Vegetable Processing and Storage Engineering,Guangdong University of Petrochemical Technology,Maoming 525000,China)
Using mulberry pomance from mulberry wine production as raw material,the de-sugar process conditions of mulberry fruit pomace before insoluble dietary fiber extraction were optimized by single factor and orthogonal tests.Results showed that the optimal extraction conditions for de-sugar process was as follows:glucoamylase addition 2 g/kg,saccharification time 90 min,temperature 63℃and pH 4.
mulberry pomace;saccharifying enzyme;de-sugar process
TS202.3
0254-5071(2016)03-0129-04
10.11882/j.issn.0254-5071.2016.03.029
2016-01-12
广东省创新强校计划项目(643085);广东高校果蔬加工与贮藏工程技术开发中心开放基金(2015A001)
程水明(1966-),男,教授,博士,研究方向为微生物学与食品生物技术。
