海洋胶红酵母菌CD-008产超氧化物歧化酶发酵条件优化及酶分离纯化
2016-09-16金连豆李晓艳王晓辉迟乃玉张庆芳张旭姣
金连豆,李晓艳*,王晓辉,迟乃玉,张庆芳,张旭姣,王 强
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
海洋胶红酵母菌CD-008产超氧化物歧化酶发酵条件优化及酶分离纯化
金连豆1,2,李晓艳1,2*,王晓辉1,2,迟乃玉1,2,张庆芳1,2,张旭姣1,2,王强1,2
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
在单因素试验基础上,结合Plackett-Burman、Box-Behnken设计及响应面分析法进行回归分析以确定海洋胶红酵母菌Rhodotorulasp.CD-008产超氧化物歧化酶最佳发酵条件,并通过盐析、超滤离心、Sephadex G-100凝胶过滤层析研究了酶的分离纯化条件。结果表明,pH、转速、温度对酶活力有显著影响,最优发酵条件为pH 5.34、转速150 r/min、温度21.40℃,优化后发酵液酶活力达到6 430.52 U/g湿菌体,比优化前提高了1.53倍。粗酶液经65%饱和度的硫酸铵盐析、超滤离心、Sephadex G-100凝胶过滤层析后获得的SOD比酶活达到419.90 U/mg,纯化倍数为9.60倍,蛋白回收率为8.2%。SDS-PAGE凝胶电泳显示,纯化后的SOD的分子质量约为37.5 ku。
海洋胶红酵母菌CD-008;超氧化物歧化酶;发酵条件;分离纯化
超氧化物歧化酶(superoxide dismutase,SOD)是一类广泛存在于生物体内的酸性金属酶,能够专一地去除破坏体内新陈代谢的超氧阴离子,被称为“人体垃圾的清道夫”[1]。超氧化物歧化酶不仅在体内氧化与抗氧化平衡过程中起到重要作用,在肿瘤的检测研究中也得到应用,如SOD mRNA的表达含量可以作为判定乳腺浸润性导管癌治愈的指标[2];在疾病的治疗、辐射的防护过程中,SOD还可以清除体内多余的超氧阴离子自由基(O2-·),进而保护NO活性,调节血管中血压,从而保持血管血流畅通[3],以及在提高植物抗逆性等方面研究已经达到较高的水平,姚冉等[4]已成功克隆得到可以提高烟草对盐胁迫耐受性的SOD基因。目前,SOD作为抗氧化剂也成功地进军到医药、食品、化妆品等各大行业中,成为学者们争相研究的热门酶类之一[5]。
自1997年从牛血中提取到SOD,引起交叉感染后,欧盟法令规定,禁止从动物中提取SOD,因此,SOD的大部分来源便转移到植物,但植物提取SOD工艺极为复杂,而微生物发酵法的兴起则大大拓展了SOD来源,既方便又快捷。迄今为止,人们已经成功从细菌、霉菌、放线菌、酵母菌等微生物体内分离得到了SOD,根据所含金属辅基的不同,SOD可分为主要存在于真核细胞质中的Cu/Zn-SOD;原核及真核细胞基质中的Mn-SOD;原核细胞、真核藻类和高等植物中的Fe-SOD以及近来从灰色链霉菌(Streptomyces griseus)及天蓝色链霉菌(Streptomyces coelicolor)中的Ni-SOD[6]、朱秀敏等[7-8]在牛肝中发现了Co-SOD和一种存在于细胞外体液的SOD(EC-SOD)。张博润等[9]经培养条件优化后,成功选育出SOD产量可达2 075 U/g湿菌体的酵母菌ZDF48,迟乃玉等[10]也运用理化条件复合诱变,选育出SOD产量达到9100U/g湿菌体的乳酸菌Sn-898,邢德明等[11]通过优化培养基条件,培育出SOD含量高达4 206 U/g的乳酸菌SD06S,郑洲等[12]也分离出四株产SOD南极嗜冷菌(Marinomonassp.)NJ062、NJ379、NJ522和NJ548。
微生物生产工业上应用的SOD菌株产酶量不高,可以通过优化菌株产酶条件来提高产酶量。所以,研究菌株产酶条件就显得极为重要。本研究采用Plackett-Burman(P-B)法设计试验,结合Box-Behnken(B-B)设计和响应面法(response surface methodology,RSM)以及运用软件Design-Expert对海洋胶红酵母菌(Rhodotorulasp.)CD-008产超氧化物歧化酶的发酵条件进行优化,以提高产酶量,并通过盐析、超滤离心、Sephadex G-100凝胶过滤层析对SOD酶进行分离纯化,为以后工业生产酶制剂奠定了科学基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株
海洋胶红酵母菌(Rhodotorulasp.)CD-008分离自渤海海泥(123°371′E,39°6972′N)于辽宁省海洋微生物工程技术研究中心保藏。
1.1.2培养基
固体活化培养基:麦芽糖2.0%,酵母膏0.5%,蛋白胨1.0%,琼脂2.0%,陈海水配制,pH自然。
液体发酵培养基:麦芽糖2.0%,酵母膏0.5%,CuSO40.08 mmol/L,由陈海水配制,pH自然。
1.1.3试剂
邻苯三酚:上海展云化工有限公司;硫酸铵:天津市科密欧化学试剂有限公司;葡聚糖凝胶G-100:沈阳市联邦试剂厂;十二烷基硫酸钠(sodium dodecyl sulfate,SDS):上海双龙化学品厂;丙烯酰胺:云超化工有限公司。以上试剂均为分析纯。
1.2仪器与设备
HZP-250全温振荡培养箱:上海精宏实验设备有限公司;5417 R低温冷冻离心机:德国Eppendorf公司;SCIENTZ-ⅡD超声波细胞粉碎机:宁波新芝生物科技有限公司;UV-2102C紫外可见分光光度计:龙尼柯仪器有限公司;DYY-6C电泳仪:北京市六一仪器厂。
1.3方法
1.3.1菌种活化
在无菌条件下,将海洋胶红酵母保藏菌种转接到固体活化培养基中,22℃恒温培养1~2 d,活化2次。
1.3.2粗酶液的制备
将活化好的菌株接种到液体发酵培养基中,于22℃、150r/min发酵30h。发酵菌液于4℃、4000r/min离心30min,得到湿菌体,用超纯水将菌体水洗2次,4℃、4 000 r/min离心30 min。将离心得到的湿菌体用磷酸缓冲液(pH7.8)溶解。于480 W超声波冰浴下破碎30 min(破碎5 s,间隔5 s)。破碎后,4℃、10 000 r/min离心10 min,弃沉淀,留上清,即为粗酶液。
1.3.3SOD酶活力检测
SOD酶活力的检测采用邻苯三酚自氧化法[13-14]。以1mL反应液于25℃,每分钟抑制邻苯三酚自氧化速度50%的用酶量定义为一个SOD酶活力单位(U/g湿菌体)。
1.3.4单因素试验
为确定各种环境因素对酶活力的影响,分别以转速(100 r/min、120 r/min、140 r/min、160 r/min、180 r/min)、装液量(70mL/250mL、80mL/250mL、90mL/250mL、100mL/ 250 mL、110 mL/250 mL)、接种量(1%、2%、3%、4%、5%)、温度(18℃、20℃、22℃、24℃、26℃)、pH(4.5、5.5、6.5、7.5、8.5)作为唯一变量,进行单因素筛选试验,将最高酶活力设定为100%,其余用相对值表示。考察其对SOD相对酶活的影响。
1.3.5发酵条件优化
(1)Plackett-Burman试验设计
在前期单因素试验的基础上,选择5个因素进行12次试验(N=12),用Design-Expert软件进行试验设计,根据结果对其进行显著性分析。试验中每个因素根据单因素试验结果设定2个水平,Plackett-Burman试验设计因素与水平如表1所示。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments
(2)最陡爬坡试验
根据Plackett-Burman试验得出的显著因素效应大小设定其步长,进行最陡爬坡试验,找出酶活最高响应值的区域。
(3)Box-Behnken设计及响应面分析
根据Plackett-Burman试验确定影响酶活的主要3个因素,最陡爬坡试验获得因素响应区域的中心点,采用Design-Expert软件进行Box-Behnken设计,3因素3水平响应面的分析试验因素与水平见表2。

表2 Box-Behnken试验因素与水平Table 2 Factors and levels of Box-Behnken experiments
1.3.6SOD酶分离纯化
将海洋胶红酵母CD-008SOD粗酶液经饱和度65%的硫酸铵4℃盐析12 h后,用0.05 mol/L的磷酸缓冲液(pH 7.8)溶解沉淀蛋白,测定酶活,计算蛋白回收率;溶解后蛋白经过预处理的(截留分子质量10 ku)超滤管超滤,4℃,4000r/min离心30min,移液枪小心取出浓缩液,溶于(pH7.8)0.05 mol/L的磷酸缓冲液,测定酶活,计算蛋白回收率;取2 mL超滤后SOD酶液加入预先用pH 7.8 0.05 mol/L的磷酸缓冲液平衡过的Sephadex G-100凝胶过滤层析柱(1.6 cm× 100 cm),调节洗脱速度及蛋白自动收集器,每管收集2 mL,收集含SOD酶各管,测定其酶活力,合并含酶活力各管。
1.3.7检测方法
(1)蛋白质含量的测定
采用考马斯亮蓝法[15],绘制蛋白标准曲线方程为y= 0.009 2x+0.020 4(R2=0.994 6),结合蛋白标准曲线方程测定蛋白质含量。
(2)SOD分子质量的测定
按照LAEMMLI U K等[16]的方法采用质量分数为8%的分离胶和5%的浓缩胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodiumdodecylsulfatepolyacrylamidegelelectrophoresis,SDS-PAGE),电泳结束凝胶用考马斯亮蓝染色30 min后脱色,确定收集酶活洗脱液中蛋白条带,以预染蛋白MarkerThermo26616为对照,考察并计算SOD的分子质量。
2 结果与分析
2.1单因素试验结果
考察转速、装液量、接种量、温度和pH值对SOD相对酶活的影响,结果如图1所示。

图1 转速(a)、装液量(b)、接种量(c)、温度(d)、pH(e)对SOD相对酶活的影响Fig.1 Effects of rotate speed(a),liquid volume(b),inoculum(c),temperature(d),pH(e)on SOD relative enzyme activity
由图1可知,SOD相对酶活随着转速、装液量、接种量、温度和pH值的增加均呈先升高后降低的趋势。SOD相对酶活分别在转速140 r/min、装液量90 mL/250 mL、接种量3%、温度22℃、pH 5.5时到达最大值,因此以此最适发酵条件进行下一步研究。
2.2发酵条件优化试验设计和分析
2.2.1Plackett-Burman试验设计
根据单因素试验选取对菌株SOD相对酶活力具有显著影响的5个因素,以菌株Rhodotorulasp.CD-008粗酶液的SOD酶活力(Y)作为响应值,选取N=12,进行P-B设计,分别计算各因素的效应,并对其进行显著性评价,结果见表3。
由表3的分析结果可知,A、B、C、D、E各因素的效应值分别为-414.3、263.8、-448.4、-370.1、521.0,由P值的大小可知,各因素对SOD酶活力影响重要性排序为E>C=A>D>B,即pH>转速=温度>装液量>接种量,综合考虑选取pH、转速和温度作为下一步响应面设计的主要影响因素。其余因素选值根据各自效应值的正负及大小来确定,正效应取其较大值,负效应取其较小值。

表3 Plackett-Burman试验显著性分析Table 3 Significance analysis of Plackett-Burman experiments
2.2.2最陡爬坡试验
根据Plackett-Burman试验结果选取3个重要因子,即pH、转速和温度来设计显著因素的最陡爬坡路径及步长,最陡爬坡试验设计及结果见表4。由表4可知,随着3个显著因素的变化,菌株发酵粗酶液的酶活力在pH 5.5、转速140 r/min和温度22℃出现最高值,故选择此条件作为响应面的设计中心。

表4 最陡爬坡试验设计及结果Table 4 Design and results of the steepest ascent path experiments
2.2.3Box-Behnken设计及结果
根据最陡爬坡试验确定影响菌株Rhodotorulasp. CD-008产酶的显著因素及各自的取值,进行Box-Behnken试验设计,Box-Behnken试验设计与结果见表5,回归模型方差分析见表6。
运用Design-Expert8.6.0.1软件对表5中的数据进行回归分析,得到SOD酶活力(Y)和发酵条件的二次回归模型方程如下:

由表6可知,除X1X3项外,X1X3和对SOD酶活力具有显著影响(P<0.05),其他项对SOD酶活力均具有极其显著影响(P<0.001),说明转速与pH和温度交互项对酶活有显著性影响,而pH与温度交互项对酶活没有显著性影响。回归模型的决定系数R2=0.9974,校正决定系数说明该模型只有0.72%的变异不能由该模型解释,因此,该模型的拟合性较好。模型P值(<0.000 1)远远<0.001,说明该模型是极其显著的,失拟项数值为0.097 3>0.05说明失拟不显著,模型稳定,设计可靠,可用于菌株Rhodotorula sp.CD-008酶活的分析与预测。通过回归模型方程构建pH、转速和温度对菌株Rhodotorulasp.CD-008产SOD酶活力影响的响应曲面和等高线结果见图2。

表5 Box-Behnken试验设计与结果Table 5 Design and results of the Box-Behnken experiments

表6 回归方程的方差分析Tabble 6 Variance analysis of regression equation
由图2可以较直观地看出曲面图为椭圆形或马鞍形,说明3因素两两之间的交互作用对酶活的影响情况[17-18],根据Design-Expert软件进行分析,可得其最佳发酵条件为pH 5.34、转速150 r/min、温度21.37℃。初始发酵条件下粗酶液的酶活力为4 189.58 U/g湿菌体,在此条件下,粗酶液的酶活力为6 430.52 U/g湿菌体,是优化前酶活的1.53倍。并且优化后粗酶液酶活力的测定值与预测值6 348.66 U/g湿菌体非常接近,说明模型的设计是合理有效的。

图2 pH、转速与温度交互作用对SOD酶活力影响的响应曲面和等高线Fig.2 Response surface plots and contour line of effects of interaction between pH,rotate speed and temperature on SOD enzyme activity
2.3SOD分离纯化结果
2.3.1SOD分离纯化结果
经65%硫酸铵盐析、超滤离心和SephadexG-100凝胶过滤层析后,SOD的纯化结果见表7。由表7可知,Rhodotorulasp. CD-008 SOD酶发酵粗酶液经盐析、超滤离心和层析后,SOD的比酶活达到419.90 U/mg,蛋白回收率为8.2%,纯化倍数为9.60。

表7 Rhodotorulasp.CD-008 SOD的纯化结果Table 7 Purification results ofRhodotorulasp.CD-008 SOD
2.3.2SOD分子质量的测定结果
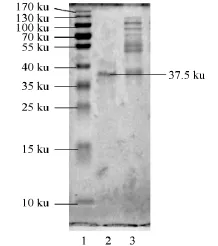
图3 SOD的SDS-PAGE电泳图Fig.3 SDS-PAGE electrophoretogram of SOD
提纯后的SOD SDS-PAGE凝胶电泳图谱见图3。由图3可知,SDS-PAGE凝胶电泳显示纯化后的SOD酶为单一条带,分子质量约为37.5 ku,据何献君等[19]研究报道,Cu/Zn SOD的分子质量在32~65 ku之间,推断该SOD类型可能为Cu/Zn SOD。
3 结论
本研究采用Box-Behnken试验设计,对Rhodotorulasp. CD-008产超氧化物歧化酶的发酵条件进行了优化,经软件Design-Expert分析,结果表明,最优发酵条件为pH 5.34、转速150 r/min、温度21.40℃,在此最优条件下,SOD酶活力为6 430.52 U/g湿菌体比优化前提高了1.53倍。孙怡等[20]筛选出两株产SOD乳酸菌菌株L-7、L-9,经优化后SOD酶活分别达到3 361.2U/g和3 389.7 U/g;丁琳等[21-22]分别选育出高产SOD的枯草芽孢杆菌,酶活达2 186 U/g湿菌体、3 439.3 U/g湿菌体,据文献报道,真核生物中的SOD含量远远高于原核生物的SOD含量[23-24],而本研究优化胶红酵母CD-008产SOD发酵条件后,酶活达6 430.52 U/g湿菌体,也验证了这一说法。
Rhodotorulasp.CD-008发酵粗酶液经过饱和度65%硫酸铵盐析、超滤离心、SephadexG-100凝胶过滤层析等纯化步骤,得到的SOD比酶活达到419.90 U/mg,纯化倍数为9.60倍,蛋白回收率为8.2%。SDS-PAGE凝胶电泳显示纯化后的SOD为单一条带,分子质量约为37.5 ku,推断可能为Cu/Zn SOD。本研究中,对胶红酵母Rhodotorulasp. CD-008进行发酵条件优化,为SOD的生产增添了新的途径,对于抗癌、抗炎药物的合成,食品添加,化妆品添加等各行业的应用,均具有广泛而深远的意义。同时也为该菌超氧化物歧化酶的酶学性质,分子水平诱变以及工业深层发酵、基因序列、氨基酸序列等进一步深入研究奠定基础。
[1]MCCORD J M,FRIDOVICH I.Superoxide dismutase an enzymic function for erythrocuprein(hemocuprein)[J].J Biol Chem,1969.244(22):6049-6055.
[2]张默函,周宪春,李良昌,等.锰超氧化物歧化酶在乳腺浸润性导管癌中的表达及临床意义[J].临床与实验病理学杂志,2012,28(9):956-958,962.
[3]KIM Y,KIM B H,LEE H,et al.Regulation of skin inflammation and angiogenesis by EC-SOD via HIF-1α and NF-κB pathways[J].Free Radical Biol Med,2011,51(11):1985-1995.
[4]姚冉,李轶女,张志芳,等.Cu/Zn-SOD基因植物表达载体的构建及其在烟草中的表达[J].生物技术通报,2012(11):78-82.
[5]岳爱国,刘纲勇.SOD在食品和化妆品行业中的应用研究进展[J].广东化工,2014,41(19):117-118.
[6]YOUN H,KIM E J,ROE J H,et al.A novel nickel-containing superoxide dismutase fromStreptomycessp.[J].Biochem J,1996,(318):889-896.
[7]朱秀敏.超氧化物歧化酶的生理活性[J].当代医学,2011,17(15):26-27.
[8]MARKLUND S L,BJELLE A E,LMQVIST L G,et al.Superoxide dismutase isoenzymes of the synovial fluid in rheumatoid arthritis and in reactive arthritides[J].Ann Rheum Dis,1986,10(45):847-851.
[9]张博润,黄英,田宇清,等.酵母SOD高产工程菌培养优化条件研究[J].微生物学通报,1994,21(4):210-213.
[10]迟乃玉,刘英昊,张庆芳,等.SOD高产菌株乳酸菌的选育及其产酶条件的研究[J].微生物学通报,2001,28(6):22-25.
[11]邢德明,李新华,袁慎亮,等.产SOD乳酸菌SD06S菌株培养基条件的优化[J].食品工业,2014(5):43-46.
[12]郑洲,缪锦来.产低温超氧化物歧化酶南极菌株的筛选、鉴定及其部分酶学性质[J].极地研究,2007,19(4):255-263.
[13]IVANKA P B,MIROSLAVA A,ELKA E.A novel,thermostable manganese-containing superoxide dismutase fromBacillus licheniformis[J]. Biotechnol Lett,2010(32):1893-1896.
[14]KIM I,LEE K S,CHOI Y S,et al.Cloning and characterization of the Cu,Zn superoxide dismutase(SOD1)cDNA from the mole cricket,Gryllotalpa orientalis[J].Biotechnol Lett,2005,27(8):589-595.
[15]HADDAD N I A,YUAN Q S.Purification and some properties of Cu,Zn superoxide dismutase fromRadix lethospermiseed,kind of Chinese traditional medicine[J].J Chromatogr B,2005,818(2):123-131.
[16]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(15):680-685.
[17]胡青平,张红,周冰,等.响应面法优化光合细菌PSB-B的生长条件[J].食品工业科技,2013,34(15):1-7.
[18]申乃坤,王青艳,陆雁,等.响应面法优化耐高温酵母生产高浓度乙醇[J].生物工程学报,2010,26(1):42-47.
[19]何献君,梁晓冬,吕晓峰,等.超氧化物歧化酶应用研究状态[J].中国医药指南,2010,8(15):37-39.
[20]孙怡,蒋冬花,徐晓波.高产SOD乳酸菌的筛选和培养条件的优化[J].浙江师范大学学报(自然科学版),2009,32(2):212-215.
[21]丁琳,孟玲,刘宁,等.枯草杆菌超氧化物歧化酶制备的最佳工艺条件研究[J].沈阳化工学院学报,2007,21(2):105-108
[22]陈晓琳,唐欣昀,周隆义,等.枯草杆菌SOD高产菌株的诱变选育及产酶条件研究[J].激光生物报,2005,14(3):173-176.
[23]石磊,杨秀艳,赵丽华.超氧化物歧化酶在微生物中的含量及分布情况[J].齐齐哈尔医学院学报,2005,26(7):794.
[24 SHENG Y W,ABREU I A,CABELLI DE,et al.Superoxide dismutases and super oxide reductases[J].Cheml Rev,2014(114):3854-3918.
Optimization of fermentation conditions of SOD-producingRhodotorulasp. CD-008 and separation and purification of the SOD
JIN Liandou1,2,LI Xiaoyan1,2*,WANG Xiaohui1,2,CHI Naiyu1,2,ZHANG Qingfang1,2,ZHANG Xujiao1,2,WANG Qiang1,2
(1.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China;2.Liaoning Marine Microbial Engineering and Technology Center,Dalian 116622,China)
On the basis of single factor experiments,the optimum fermentation conditions of SOD-producingRhodotorulasp.CD-008 were determined by Plackett-Burman,Box-Behnken design and response surface analysis,and the separation and purification conditions of SOD were research by salting out,ultrafiltration centrifugation and Sephadex G-100 gel filtration chromatography.Results indicated that pH,rotate speed and temperature had a significant effect on enzyme activity.The optimum fermentation conditions was pH 5.34,rotate speed 150 r/min and temperature 21.40℃. Under the conditions,the enzyme activity in fermentation liquor was 6 430.52 U/g fresh cells,which was 1.53 times higher than that before optimization.The crude enzyme liquid was purified by ammonium sulfate with degree of saturation 65%,ultrafiltration centrifugation and Sephadex G-100 gel filtration chromatography,specific enzyme activity of SOD obtained was 419.90 U/mg,purification fold was 9.60 and protein recovery rate was 8.2%.SDS-PAGE electrophoresis showed that molecular weight of SOD purified was about 37.5 ku.
Rhodotorulasp.CD-008;superoxide dismutase;fermentation conditions;separation and purification
Q936
0254-5071(2016)03-0017-06
10.11882/j.issn.0254-5071.2016.03.005
2015-12-27
国家高技术研究发展计划(863计划)项目(2014AA093512)
金连豆(1991-),女,硕士研究生,研究方向为微生物与酶工程。
李晓艳(1972-),女,讲师,硕士,研究方向为微生物工程应用技术开发。
