海洋真菌BH0531对黄瓜促生长作用的研究
2016-09-16申佩娟刘晓霞孟庆恒孙建华
蔡 爽,申佩娟,刘晓霞,黄 敏,冯 欣,孟庆恒*,孙建华
(1.天津师范大学生命科学学院,天津300387;2.天津市动植物抗性重点实验室,天津300387)
海洋真菌BH0531对黄瓜促生长作用的研究
蔡爽1,申佩娟1,刘晓霞1,黄敏1,冯欣1,孟庆恒2*,孙建华2
(1.天津师范大学生命科学学院,天津300387;2.天津市动植物抗性重点实验室,天津300387)
通过室内盆栽试验研究了海洋枝顶孢霉(Acremoniumsp.)BH0531次生代谢产物对黄瓜根结线虫病的防治效果及对黄瓜植株生长的促进作用。实验以根结线虫(Meloidogyne incognita)侵染后的黄瓜为材料,在土壤中加入质量浓度为5 mg/mL、10 mg/mL、20 mg/mL、40 mg/mL菌株BH0531发酵液40 mL,用等体积清水作为对照,测定黄瓜的株高、茎粗、叶片的可溶性蛋白及可溶性糖含量、叶绿素含量和根系活力。结果表明,在试验浓度范围内施入发酵液,对根结线虫病的防效最高达72.7%,同时施入发酵液显著增加叶片可溶性糖和叶绿素含量,提高黄瓜的根系活力。因此,海洋枝顶孢霉BH0531的代谢物不仅对黄瓜根结线虫病有显著的控制效果,而且对黄瓜生长有一定的促进作用。
枝顶孢霉;次生代谢产物;黄瓜;根结线虫;防控效果
根结线虫(Meloidogyne incognita)是一种内源固着性寄生线虫,因其分布广泛、寄主多样、感染性强和危害隐蔽难发现等特点,成为目前危害世界农业生产的主要病原物之一[1-2]。每年仅对世界上重要的经济作物造成的损失就高达数百亿美元[3-4]。目前生产实践中常使用的杀线剂大多都是高度的化学农药,毒性高,会对人类的身体健康和生态环境造成危害,不利于农业生产的可持续发展[5-6]。随着生物技术的进步,借助生物方法防治根结线虫越来越受重视,尤其是利用真菌代谢产物来控制根结线虫病成为研究的重要方向[7]。
目前,已报道有超过700余种的真菌具有杀线虫活性,其中已分离得到有杀线虫活性的代谢产物多达230余种[8]。海洋枝顶孢霉(Acremoniumsp.)BH0531是已被证实的具有很好杀根结线虫效果的海洋真菌,其代谢物有含氮糖类和含氮糖类衍生物,该类物质分子质量小,易溶于水,有较好的耐热性,与大多数土壤环境相符的pH适应范围[9]。研究表明,菌株BH0531产生的活性代谢物对松材线虫和根结线虫在离体条件下均具有较高的杀线活性,线虫致死率可达到97.85%[10]。在此基础上,本研究以根结线虫和黄瓜为材料,用不同质量浓度的海洋枝顶孢霉BH0531发酵液分别处理未感染根结线虫的黄瓜和感染根结线虫的黄瓜,测定黄瓜植株的生长指标和部分生理指标,探究发酵液对黄瓜生长的影响和对根结线虫的防治效果,为今后海洋枝顶孢霉BH0531在实践上的应用提供参考依据。
1 材料与方法
1.1材料与试剂
1.1.1菌种和材料
海洋枝顶孢霉(Acremoniumsp.)BH0531,菌种保藏号:CGMCC-5445,天津师范大学生命科学学院微生物实验室提供;根结线虫:采自感染根结线虫病的大棚;供试黄瓜品种(新津春四号):购自天津市黄瓜研究所。
1.1.2培养基
保藏培养基:采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮土豆200 g/L,葡萄糖20 g/L,琼脂15g/L,pH自然,121℃灭菌20min。
发酵培养基:去皮土豆200 g/L(浸汁),葡萄糖20 g/L,pH自然,121℃灭菌20min。
1.1.3化学试剂
葡萄糖、蔗糖、蒽酮(分析纯):天津市化学试剂一厂;无水乙醇(分析纯)、牛血清蛋白:天津市化学试剂二厂;琼脂、Na2S2O4(分析纯):天津市化学试剂三厂;石英砂、碳酸钙、乙酸乙酯(分析纯):天津市科威有限公司;考马斯亮蓝G-250(分析纯):天津市光复精细化工研究所;红四氮唑(triphenyl tetrazoliumchloride,TTC)(分析纯)、琥珀酸(分析纯):上海华东师范大学化工厂;次氯酸钠:天津市风船化学试剂科技有限公司。
1.2仪器与设备
YXQG02型电热式灭菌锅:山东新华医疗器械厂;Micro200R离心机:广州市华粤行仪器有限公司;SW-CJ-1F超净工作台:苏州净化设备有限公司;SPX-250B-Z生化培养箱、G2X-9140MBE数显鼓风干燥箱:上海博讯实业有限公司医疗设备厂;线虫标准筛:浙江上虞市公路仪器厂;SP-Max2300酶标仪:上海闪普生物科技有限公司;UV-1750紫外分光光度计:日本岛津有限公司。
1.3试验方法
1.3.1发酵液的制备
菌种活化:将保藏的海洋枝顶孢霉菌种接入斜面培养基,26℃静置培养6~7 d。
种子液的制备:取新培养的菌株斜面,加入无菌水洗下孢子,制备成106个/mL的孢子悬液。
发酵液的制备:以2%接种量将孢子悬液接入装有100mL液体发酵培养基的500 mL三角瓶中。26℃、120 r/min培养4 d。将培养好的菌液1 000 r/min离心去菌体,再经孔径为0.22 μm微孔滤膜真空抽滤,滤液即为发酵液[11]。
1.3.2根结线虫2龄幼虫(J2)的制备
采集大棚染病黄瓜根系,洗净泥土,剪成1~2 cm的根段,加入1%体积比的次氯酸钠溶液,用粉碎机粉碎。分别过60目、250目、500目分样筛,收集500目分样筛节流物,即为根结线虫的虫卵粗提物。将40 mL虫卵粗提物倒入100 mL离心管中,在离心管下层注入40 mL 40%的蔗糖溶液,使其分为两层,3500r/min离心5min,水层和蔗糖溶液层中间的白色悬浮物就是虫卵,用移液器吸出,用蒸馏水冲掉蔗糖溶液,得到纯净的虫卵。将虫卵放入25℃培养箱中培养,待虫卵孵化,采用贝尔曼漏斗法获取2龄幼虫,配制成1 000条/mL备用。
1.3.3试验设计及黄瓜幼苗处理
黄瓜种子经55℃热浸10min后,在30℃温水中浸泡6h,再用吸水纸和锡箔包好,置于30℃环境中催芽24 h。待其发芽后,点种到育苗穴中,于30℃光照培养箱中继续培养。待其长出第二片真叶后,移栽到花盆中,所用土壤配比为大田土∶泥炭土∶沙子=4∶4∶1,121℃湿热灭菌2 h,共计30盆,每盆1株,分为A、B两组,每组15盆。待黄瓜长出3片真叶时,A组15盆接入根结线虫,接种方法:根周围打5个孔(12.5 mm×20 mm),注入根结线虫(J2)悬液,接种量为每盆2 000条以上。另外B组15盆注入清水为不加根结线虫组。随后,A组和B组的前12盆,每盆分别加入40mL不同质量浓度(对应干物质含量分别为5mg/mL(1/2倍原液)、10mg/mL(原液)、20 mg/mL(2倍原液)、40 mg/mL(4倍原液)的BH0531菌株发酵滤液,A组和B组的后3盆分别加入40 mL清水作对照。
1.3.4植株生长指标及根结指数的测定
生长指标的测定[12]:移栽50 d后取样,测定黄瓜的株高、茎粗;统计结果。
病情指数的测定:黄瓜处理50 d时检测根结数,拔出植株根系,统计根结数。具体分级如下:0级,整个根系没有根结;1级,根系轻微感染,根结数10个以下,根结百分率小于10%;2级,根系明显,根结数10~50个,根结百分率11%~25%;3级,根结百分率26%~50%;4级,根结百分率51%~75%;5级,根结百分率75%~100%。病情指数及防治效果的计算参考文献[13],其计算公式如下:

1.3.5植株生理指标的测定
黄瓜叶片蛋白质含量测定采用考马斯亮蓝法:移栽50 d后,称取黄瓜叶片0.5 g放入匀浆器,加入2 mL pH 7.8,0.1 mol/L的磷酸缓冲液,冰浴研磨,移入离心管,然后分别用1 mL提取液洗涤匀浆器3次,并入离心管,共5 mL,放置0.5 h以充分提取,在4 000 r/min离心20 min,弃沉淀上清液为蛋白粗提液。吸取粗提液1.0 mL,放入试管,加入5 mL 0.1 g/L考马斯亮蓝G-250溶液,充分混合,放置2 min后在波长595nm处比色,测定吸光度值,绘制牛血清蛋白标准曲线,按照标准曲线回归方程计算样品中蛋白质含量[14]。
黄瓜叶片可溶性糖含量测定采用硫酸-蒽酮比色法:称取黄瓜叶片0.5 g,置于研钵中,加入2 mL蒸馏水研磨,然后转入20mL刻度试管中,用10mL蒸馏水分次洗涤研钵,并加入试管中。置沸水浴中10 min,冷却后过滤,滤液收集于50 mL容量瓶中,用蒸馏水定容至刻度,摇匀备用。用移液管吸取1 mL提取液于20 mL试管中,加1 mL水和0.5 mL蒽酮试剂。再缓慢加入5 mL浓H2SO4,盖上试管塞后摇匀,再置沸水浴中煮10 min。冷却至室温后,在波长620 nm处比色,记录吸光度值。绘制葡萄糖标准曲线,按照标准曲线回归方程计算样品中可溶性糖含量[15]。
黄瓜叶片叶绿素含量测定采用分光光度法:移栽50 d后,称取叶片0.2 g,分别放入研钵中,加少量石英砂和碳酸钙及体积分数为95%乙醇3 mL,研成均浆,再加体积分数为95%乙醇10 mL,继续研磨后并入试管,静置5 min。用滤纸过滤到25 mL棕色容量瓶中。吸取体积分数为95%乙醇,将叶绿素全部冲入容量瓶中。最后用体积分数为95%乙醇定容至25 mL,摇匀。在波长663 nm和645 nm处测定吸光度值[14]。
黄瓜根系活力测定采用分光光度法:称取幼苗根样品0.5 g放入小培养皿,加入质量分数为0.4%的TTC溶液和pH 7.0,0.1mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)(1∶1)混合液10 mL,把根充分浸没在溶液内,在37℃条件下下暗处恒温振荡1 h,然后加入1 mol/L硫酸2 mL,以停止反应。把根取出,吸干水分后与乙酸乙酯3 mL和少量石英砂一起研磨,以提出深红色三苯甲簪(triphenylformazan,TTF)。把红色提取液移入试管,用1 mL乙酸乙酯洗涤残渣2次,并入试管,在波长485 nm处比色,以空白做参比测定吸光度值,按照标准曲线回归方程计算样品中红四氮唑还原量,计算出红四氮唑还原强度,来表示根系中脱氢酶的活性即为根系活力[14]。
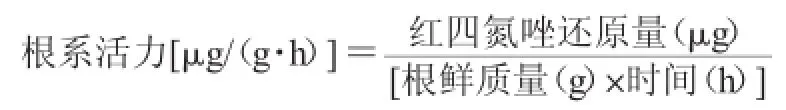
1.3.6数据统计与分析
试验测定数据应用SPSS17.0进行显著性差异分析和Origen8.0软件进行作图分析。
2 结果与分析
2.1BH0531菌株不同浓度发酵液对黄瓜病情指数的影响
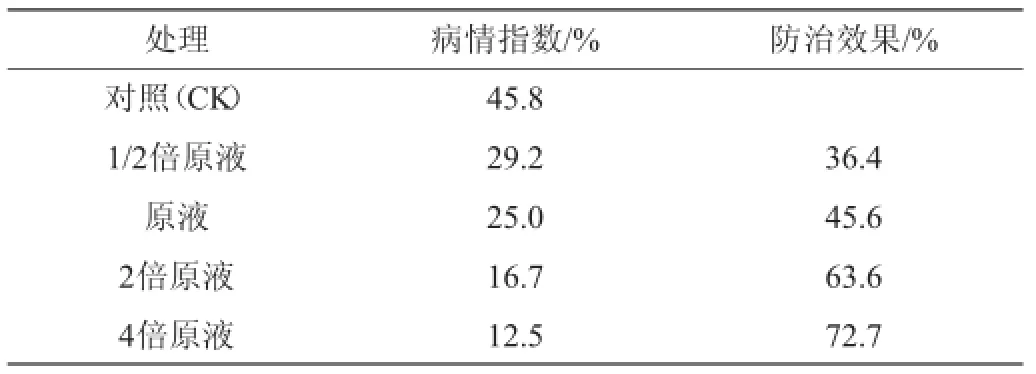
表1 发酵液对黄瓜根结线虫的防治效果Table 1 Control efficacy of fermentation broth on cucumber root-knot nematodes
测定不同浓度BH0531菌株发酵滤液对感染根结线虫病的黄瓜病情指数的影响,结果如表1所示。由表1可知,以注入清水的植株为对照(CK),实验组经不同浓度发酵液处理后,黄瓜根结线虫病的病情指数均有所降低:相比对照组45.8%的病情指数,添加原液一倍稀释液、原液、2倍原液和4倍原液的各实验组病情指数分别为29.2%、25.0%、16.7%和12.5%。结果表明,BH0531菌株发酵滤液对黄瓜根结线虫具有明显的防治效果,且浓度越高防治效果越高,本研究中防治效果最高达72.7%。
2.2发酵液对黄瓜生长指标的影响
发酵滤液对黄瓜生长指标的影响如图1所示。由图1a可知,对照组中感染根结线虫的黄瓜株高(7.18 cm)仅为正常黄瓜株高(17.47 cm)的60%,说明根结线虫对黄瓜的株高有明显的抑制作用。黄瓜受到根结线虫危害时,根系组织的正常分化及水分和养料的运输受阻,使黄瓜株高降低、根冠比增加、植株叶片瘦小皱缩、干旱时易萎蔫枯死[16]。而发酵滤液不仅可有效对抗线虫对株高的影响,对株高还有明显的促进作用,尤其是在接线虫组。接入线虫组中,施入原液一倍稀释液、原液、2倍原液和4倍原液的株高分别是对照组中感染线虫黄瓜株高的2.3倍、1.6倍、3.4倍和4.3倍,且不同浓度之间株高存在显著差异(P<0.05)。
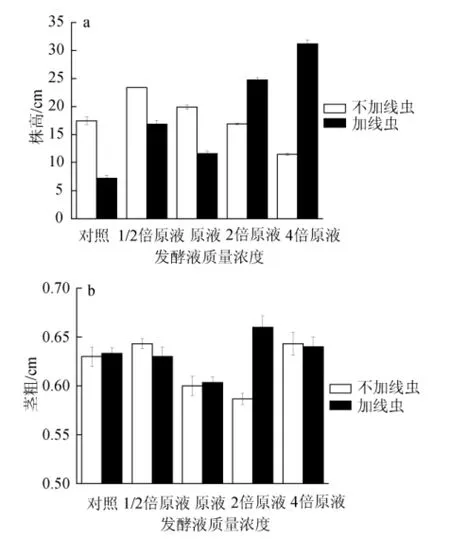
图1 发酵液对黄瓜生长株高(a)及茎粗(b)的影响Fig.1 Effect of fermentation broth on plant height(a)and stem diameter(b)of cucumber growth
施入不同浓度发酵滤液,黄瓜茎粗测定结果见图1b。由图1b可知,无论是不接线虫组还是接线虫组,施入不同浓度发酵滤液对黄瓜茎粗的影响没有发现具有统计学意义的变化。另外,测定结果中茎粗最小值是0.59 cm,最大值为0.66 cm,不同浓度处理黄瓜的茎粗之间差异不显著(P>0.05)。因此,可以判断无论感染线虫与否,施入发酵滤液对黄瓜茎粗都没有影响。
2.3发酵液对黄瓜幼苗叶片可溶性蛋白及可溶性糖含量的影响
不同浓度发酵液对黄瓜叶片可溶性蛋白及可溶性糖含量的影响结果见图2。由图2a可知,未受根结线虫感染的实验组,与对照相比,施用发酵液后叶片可溶性蛋白含量分别增加7.78%、15.57%、14.72%、20.17%,差异显著(P<0.05),因可溶性蛋白含量的增加有利于植株的生长,所以上述数据同时证明发酵液对黄瓜植株的生长有促进作用,且高浓度时效果更佳。在清水对照组中,未受根结线虫感染的黄瓜叶片的可溶性蛋白含量比受根结线虫感染的黄瓜高12.45%。对于感染根结线虫的黄瓜施入发酵液后,植株叶片内可溶性蛋白含量增加,且发酵液浓度越高,增加效果越明显,说明施加发酵液可以减弱或消除根结线虫对黄瓜叶片可溶性蛋白质含量的影响,进而促进黄瓜的生长。
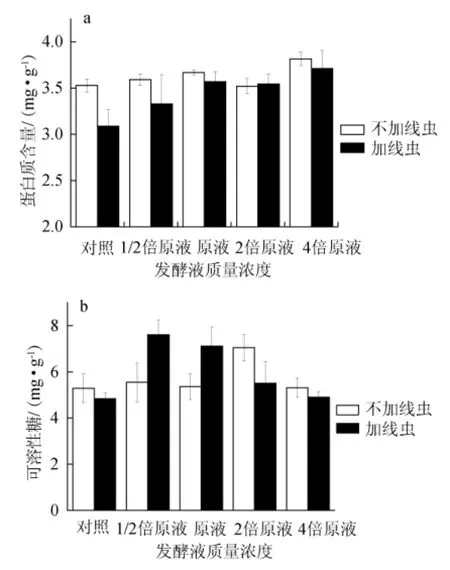
图2 发酵液对黄瓜叶片中可溶性蛋白质(a)及可溶性糖(b)的影响Fig.2 Effect of fermentation broth on soluble protein(a)and sugar(b)of cucumber leaf
由图2b可知,不接线虫组黄瓜叶片可溶性糖含量分别为5.28 mg/g、5.55 mg/g、5.36 mg/g、7.04 mg/g、5.31 mg/g。施入不同质量浓度发酵液其含量分别增加5.03%、1.47%、33.29%、0.46%,其中施入2倍原液时,可溶性糖增加幅度最大。接线虫组的可溶性糖含量分别为4.84mg/g、7.60mg/g、7.11 mg/g、5.51 mg/g、4.90 mg/g,施入发酵液其含量依次增加56.96%、46.87%、13.80%、1.25%,其中施入1/2原液和原液时,增加效果最明显,组内差异显著(P<0.05)。上述结果表明低浓度发酵液对可溶性糖含量有明显促进作用,说明发酵滤液在一定浓度范围内对黄瓜叶片可溶性糖含量有增加的作用,超过这个范围其对叶片可溶性糖含量无明显影响(P>0.05)。
2.4发酵液对黄瓜幼苗叶片叶绿素含量的影响
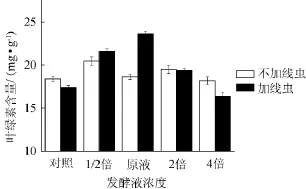
图3 发酵液对黄瓜叶片叶绿素含量的影响Fig.3 Effect of fermentation broth on chlorophyll content of cucumber leaf
由图3可知,不接线虫组和接线虫组植株叶绿素含量没有明显差别,且方差分析差异不显著。接线虫组加入原液时,叶绿素含量比对照组的18.03 mg/g增加了31.10%,其他处理组变化均在10%以内,且方差分析结果显示差异显著(P<0.05)。这一结果与可溶性糖含量的测定结果显示出一致性,表明其对糖含量的影响与叶绿素含量的多少有关。叶绿素在光合作用中起决定性的作用,叶绿素含量多有利于光合作用的进行,因此叶片中可溶性糖含量也就增多,反之则含量较少。
2.5发酵液对黄瓜植株根系活力的影响
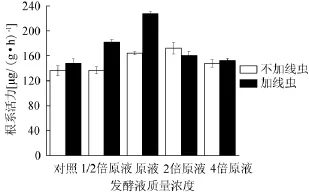
图4 发酵液对黄瓜植株根系活力的影响Fig.4 Effect of fermentation broth on cucumber root activity
发酵液对黄瓜植株根系活力的影响如图4所示。由图4可知,不接线虫组黄瓜根系活力分别为136.39 μg/(g·h)、136.72 μg/(g·h)、164.61 μg/(g·h)、172.30 μg/(g·h)和148.00 μg/(g·h),加发酵液后分别比对照增加0.25%、20.69%、26.34%和8.51%,其中施用原液和2倍原液时,根系活力明显提高。接线虫组黄瓜植株根系活力分别为148.48 μg/(g·h)、182.13 μg/(g·h)、227.43 μg/(g·h)、160.30 μg/(g·h)和152.42 μg/(g·h),加发酵液后比对照依次增加22.66%、53.17%、7.96%和2.65%,其中施用1/2倍原液和原液组黄瓜根系活力明显增强(P<0.05)。上述结果表明,施入适宜浓度的发酵滤液提高黄瓜根系活力。
3 结论
相对于陆生性真菌丰硕的研究成果,海洋真菌具有开发新型生物活性代谢产物的巨大潜力,从海洋生物中寻找新型生物活性物质和高效菌株已成为近年来关注的热点。杀线虫海洋枝顶孢霉(Acremniumsp.)BH0531即是一株海洋来源的具有明确杀线效果的丝状真菌[9]。该菌所产生的活性代谢物对根结线虫在离体条件下具有较高的杀线活性[17]。但在栽培和侵染条件下对根结线虫的防治情况如何,以及对植株生长及生理指标有何影响,对于该菌的进一步应用研究具有重要的实践参考意义。
研究结果证实:BH0531菌株在栽培和侵染条件下对根结线虫有明确的防效,在试验浓度范围内最高可达72.7%,表明该菌具有潜在的开发价值。同时,对黄瓜株高、茎粗、幼苗叶片主要可溶性物质、叶绿素和根系活力等的测定结果显示,BH0531菌株的次级代谢产物对黄瓜的生长有明显的促进作用。黄瓜受到根结线虫危害时,根系组织的正常分化及水分和养料的运输受阻,使黄瓜生长受到严重影响,而施入BH0531菌株发酵液能有效缓解这种抑制作用。相比对照,当施入1/2倍原液浓度时,黄瓜株高、幼苗叶片可溶性糖含量及根系活力分别增加130%、56.96%和22.66%,全面促进黄瓜的生长。但是,至于该菌的次级代谢物通过何种机制来影响这些生理指标,进而实现杀线虫作用和对黄瓜植株的促生长作用还有待进一步广泛深入地研究。
[1]ZHAO H,PENG D L,ZHU J L.Reviews on the root-knot nematodes[J]. Plant Prot,2003,29(6):6-9.
[2]BIRD D M,KALOSHIAN I.Are roots special?Nematodes have their say[J].Physiol Mol Plant P,2003,62(3):115-123.
[3]刘维志.植物线虫志[M].北京:中国农业出版社,2003.
[4]BARKER K R,TOWNSHEND J L,BIRD G W,et al.Method for evaluating pesticides for control of plant pathogens[M].New York:Amer Phytopathological Society,1986.
[5]段玉玺.植物线虫病害防治[M].北京:中国农业科学技术出版社,2002.
[6]刘杏忠,张克勤,李天飞.植物寄生线虫生物防治[M].北京:中国科学技术出版社,2004.
[7]陈增齐,段玉玺,陈立杰,等.球抱白僵菌Snf907发酵液对番茄根结线虫病的控病效果及防御酶活性影响[J].农药,2009,48(4):304-310.
[8]张颖,李国红,张克勤.食线虫真菌资源研究概况[J].菌物学报,2011,30(6):836-845.
[9]MENG Q H,SHI X X.Isolation of anAcremniumsp.from a screening of 52 seawater fungal isolates and preliminary characterization of its growth conditions and nematicidal activity[J].Biotechnol Lett,2012,34(10):1847-1850.
[10]杜海霞,蒙春蕾,王勇勇,等.海洋枝顶孢霉BH0531代谢物对松材线虫形态和酶活的影响[J].中国酿造,2014,33(6):23-26.
[11]史晓讯,马丹,孟庆恒,等.3株渤海丝状真菌代谢物杀线活性研究初报[J].中国线虫学研究(第三卷),2010(3):9-14.
[12]中华人民共和国农业部.NY/T 1857.8—2010黄瓜主要病害抗病性鉴定技术规程第8部分:黄瓜抗南方根结线虫病鉴定技术规程[S].北京:中国农业出版社,2010.
[13]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[14]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨大学出版社,2004.
[15]邹琦.植物生理生化实验指导[M].北京:中国农业出版社,1995.
[16]许华,阮维斌,肖建莉,等.接种根结线虫对盆栽黄瓜植株若干生理特性的影响[J].植物生理学通讯,2007,43(3):543-544.
[17]蒙春蕾,王勇勇,黄敏,等.不同氮源对海洋真菌BH0531发酵液杀线虫活性的影响[J].江苏农业科学,2015(5):121-123.
Effect of marine-derivedAcremoniumsp.BH0531 on cucumber growth promotion
CAI Shuang1,SHEN Peijuan1,LIU Xiaoxia1,HUANG Min1,FENG Xin1,MENG Qingheng2*,SUN Jianhua2
(1.College of Life Science,Tianjin Normal University,Tianjin 300387,China;2.Tianjin Key Laboratory of Animal and Plant Resistance,Tianjin 300387,China)
The effect of marine-derivedAcremoniumsp.BH0531 secondary metabolites on control efficiency of root-knot nematodes infected cucumber and acceleration of cucumber by indoor pot experiments were studied.Each pot was treated with 40 ml strain BH0531fermentation broth in different concentration of 5 mg/ml,10 mg/ml,20 mg/ml and 40 mg/ml.Using the same volume water as control,the height,stem diameter of the plants were measured.Contents of soluble protein,soluble saccharide and chlorophyll in leaves,as well as the root activity were determined.As suggested,within the dosages tested,the control efficacy of root-knot nematodes achieved up to 72.7%.Compared to the control,groups with fermentation broth addition have distinct increase in soluble saccharide and chlorophyll contents,and broth addition also improved the root activity of cucumber.In conclusion,the metabolites of a marine-derivedAcremoniumsp.BH0531,had remarkable effect on root knot nematode control in cucumber and cucumber growth promotion.
Acremoniumsp.;secondary metabolite;cucumber;root-knot nematode;control effect
Q939.9
0254-5071(2016)03-0027-05
10.11882/j.issn.0254-5071.2016.03.007
2016-01-04
国家自然科学基金资助项目(31272019);天津市自然基金联合项目(15JCYBJC51400)
蔡爽(1989-),女,硕士研究生,研究方向为应用微生物。
孟庆恒(1963-),男,副教授,硕士,研究方向为应用微生物。
