双酶法水解橡子淀粉工艺研究
2016-09-16郝秋娟赵士豪马同锁曹芳彦
郝秋娟,赵士豪*,李 娜,马同锁,李 敬,曹芳彦,孙 震
(河北经贸大学 生物科学与工程学院,河北 石家庄 050061)
双酶法水解橡子淀粉工艺研究
郝秋娟,赵士豪*,李娜,马同锁,李敬,曹芳彦,孙震
(河北经贸大学 生物科学与工程学院,河北 石家庄 050061)
为掌握中温α-淀粉酶和糖化酶联合水解橡子淀粉的工艺条件,该研究在单因素试验的基础上,运用正交试验设计方法对橡子中的淀粉水解工艺进行了研究和优化。结果表明,橡子淀粉最佳液化工艺条件为中温α-淀粉酶添加量30 U/g,液化温度70℃,CaCl2添加量0.3%,液化pH 7.5,液化时间120 min,葡萄糖当量(DE)值为27.79%;最佳糖化工艺条件为糖化酶添加量300 U/g,糖化温度50℃,糖化pH 4.5,糖化时间120 min,DE值为48.13%。
橡子淀粉;水解;中温α-淀粉酶;糖化酶
橡子(acorn),学名栗茧、蒙古栎,泛指除大量栽培板栗以外的壳斗科植物种子的总称[1]。橡子仁营养丰富,含淀粉、单宁、蛋白质、脂肪、多种氨基酸、维生素等[2]。韩伟等[3-9]对橡子淀粉性质及其加工特性进行了研究,发现可利用橡子仁提取淀粉,酿酒[10]、制作豆腐[11]、粉丝、保健品,也可作为饲料等。目前采用双酶法对米糠淀粉[12]、荞麦淀粉[13]、小麦芽淀粉[14]、玉米粉[15]等水解工艺研究较多,但利用双酶法对橡子淀粉水解工艺研究较少。本研究以橡子粉为原料,采用单因素试验确定了中温淀粉酶添加量、液化pH、液化温度、液化时间、CaCl2添加量以及糖化酶添加量、糖化pH、糖化温度、糖化时间,进而采用正交试验确定了橡子淀粉最佳液化工艺和最佳糖化工艺,为以橡子粉为原料采用液体发酵制备燃料乙醇提供了理论依据,为燃料乙醇的制备提供新的原料。
1 材料与方法
1.1材料与试剂
橡子:采自河南信阳;中温α-淀粉酶(3 700 U/g)、糖化酶(100 000 U/g):北京奥博星生物技术有限责任公司;硫酸铜、氢氧化钠、酒石酸钾钠、葡萄糖、次甲基蓝、盐酸等均为分析纯:天津市永大化学试剂开发公司。
1.2仪器与设备
ISO 9001电子天平:上海舜宇恒平科学仪器有限公司;HH-6数显恒温水浴锅:江苏省金坛市荣华仪器制造有限公司;DGX-9143B-1电热鼓风干燥箱:上海福马实验设备有限公司。
1.3试验方法
1.3.1液化工艺条件的确定
(1)单因素试验
取一定量橡子粉按照料液比1∶5(g∶mL),100℃煮沸30 min;冷却至70℃,分别添加适量中温α-淀粉酶、CaCl2,控制适宜用pH值和液化时间,灭酶(100℃、5min),离心(3 000 r/min、15 min),取上清液测定葡萄糖当量(dextrose equivalent,DE)值,以确定最佳液化工艺条件。
(2)液化工艺优化正交试验
根据单因素试验的结果,以DE值作为考察指标,进一步设计L9(34)正交试验,以确定最佳液化工艺条件。正交试验因素与水平见表1。
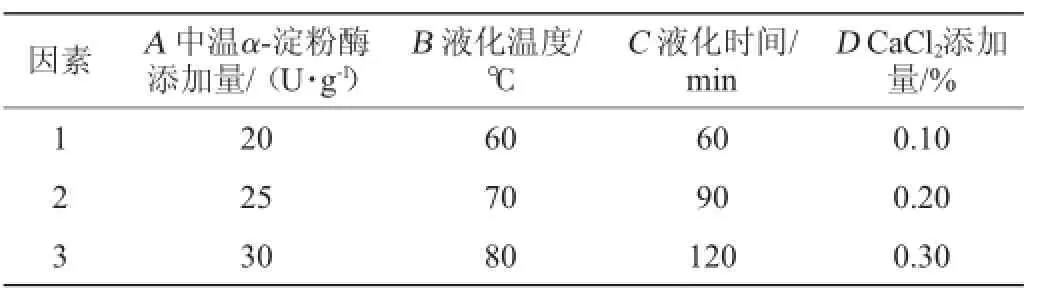
表1 液化工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for liquefaction technology optimization
1.3.2糖化工艺条件的确定
(1)单因素试验
分别取一定量的橡子粉液化醪液,添加适量糖化酶,控制适宜的糖化pH、糖化温度和糖化时间,测定DE值以确定最佳糖化工艺条件。
(2)糖化工艺优化正交试验
根据单因素试验的结果,以DE值作为考察指标,进一步设计L9(33)正交试验,以确定最佳糖化工艺条件。正交试验因素与水平见表2。

表2 糖化工艺优化正交试验因素与水平Table 2 Factors and levels of orthogonal tests for saccharification technology optimization
1.3.3检测分析方法[16]
干物质含量测定采用阿贝折光仪测定,还原糖含量测定采用费林试剂法。DE值计算公式如下:

2 结果与分析
2.1液化条件的确定
2.1.1中温α-淀粉酶添加量的确定
取一定量橡子粉按照料液比1∶5(g∶mL),100℃煮沸30 min;冷却至70℃,分别添加0、10 U/g、20 U/g、30 U/g、40 U/g、50 U/g中温α-淀粉酶,控制pH 7.0,加入CaCl20.3%,液化60 min,灭酶(100℃、5min),离心(3 000 r/min、15 min)取上清液测定DE值,以确定最佳中温α-淀粉酶添加量,结果如图1所示。
由图1可知,随着中温α-淀粉酶的添加量逐渐增大,DE值也逐渐增大。当中温α-淀粉酶添加量>25 U/g时,再进一步增加中温α-淀粉酶量,DE值增加趋势变缓。在一定范围内,酶添加量越大,DE值越高,同时增加生产成本。综合考虑,选择中温α-淀粉酶的添加量为25 U/g。
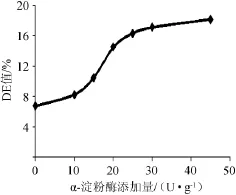
图1 α-淀粉酶添加量对橡子粉液化的影响Fig.1 Effects of α-amylase addition on acorn starch liquefaction
2.1.2液化温度的确定
液化温度分别为50℃、60℃、70℃、80℃,其他条件不变测定DE值,以确定最佳液化温度,结果如图2所示。
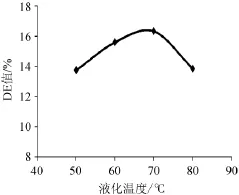
图2 液化温度对橡子淀粉液化的影响Fig.2 Effects of liquefaction temperature on acorn starch liquefaction
由图2可知,随着液化温度的升高,DE值也逐渐增大,当温度达70℃时DE值达到最大值,为16.32%。再继续增加温度,DE开始下降,说明该中温α-淀粉酶以橡子粉为底物时,其最适液化温度为70℃。
2.1.3液化时间的确定
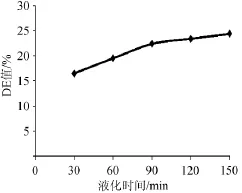
图3 液化时间对橡子淀粉液化的影响Fig.3 Effects of liquefaction time on acorn starch liquefaction
液化时间分别为30 min、60 min、90 min、120 min、150 min,其他条件不变,测定DE值,以确定最佳液化时间,结果如图3所示。
由图3可知,随着液化时间的增加,DE值也逐渐增大,当液化时间>90 min时,DE值增长过缓,综合考虑生产成本,选择液化时间90 min。
2.1.4液化pH的确定
分别控制液化pH 4.5、5.5、6.5、7.5、8.5,其他条件不变,测定DE值,以确定最佳液化pH,结果如图4所示。
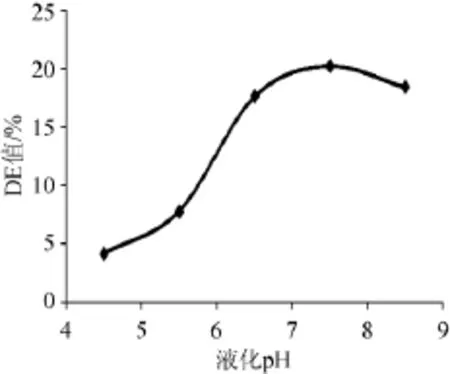
图4 pH对橡子淀粉液化的影响Fig.4 Effects of pH on acorn starch liquefaction
由图4可知,随着pH的升高,DE值也逐渐增大,但是pH 7.5时,DE值达到最大值,为20.21%。pH继续升高,DE开始下降,故选取液化pH值为7.5。
2.1.5CaCl2添加量的确定
分别添加CaCl20、0.1%、0.2%、0.3%、0.4%、0.5%,其他条件不变,测定DE值,以确定最佳液化CaCl2添加量,结果如图5所示。
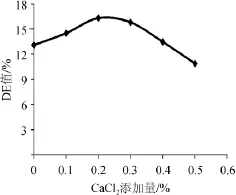
图5 CaCl2添加量对橡子淀粉液化的影响Fig.5 Effects of CaCl2addition on acorn starch liquefaction
由图5可知,随着CaCl2添加量的增加,DE值逐渐增大,当其添加量为0.2%时达到最大值,为16.32%。之后随着CaCl2添加量的增加,转化率开始呈现明显的下降趋势。这一结果与文献报道[17-19],Ca2+对中温α-淀粉酶的稳定性有保护作用相一致。故选择CaCl2添加量为0.2%。
2.1.6液化工艺优化正交试验
根据液化阶段的单因素试验结果,进一步设计L9(34)正交试验,以确定最佳液化条件。正交试验结果与分析见表3。
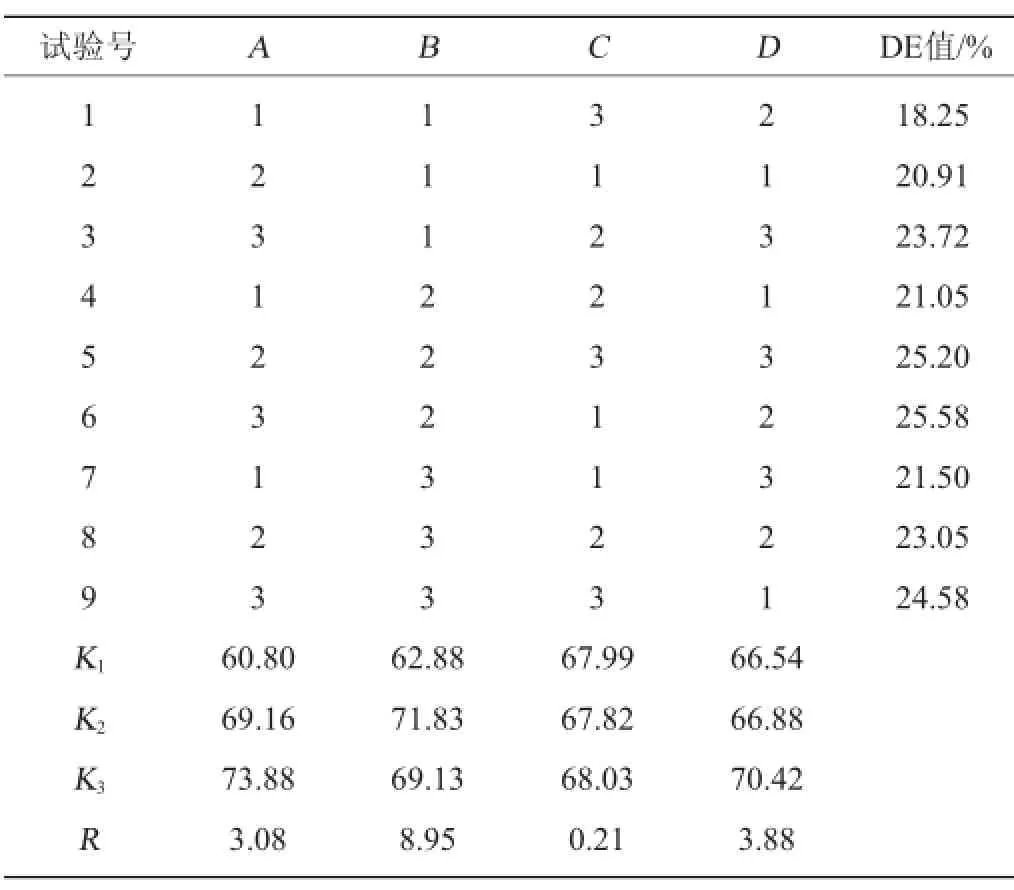
表3 液化工艺优化正交试验结果与分析Table 3 Results and analysis of orthogonal tests for liquefaction technology optimization
由表3可知,在橡子淀粉液化试验中,对于DE值影响大小顺序依次B>D>A>C,即液化温度>CaCl2添加量>中温α-淀粉酶添加量>液化时间,最佳液化工艺条件组合为A3B2C3D3。在此最佳液化工艺条件下进行验证试验,结果表明,采用最佳工艺中温α-淀粉酶添加量30 U/g、CaCl2添加量0.3%,液化温度70℃条件下酶解120 min,测定DE值为27.79%。
2.2糖化工艺条件的确定
2.2.1糖化酶添加量的确定
分别取一定量的橡子粉液化醪液,pH 4.5,分别添加糖化酶100 U/g、200 U/g、300 U/g、400 U/g、500 U/g,60℃酶解120 min,测定DE值以确定最佳糖化酶添加量,结果如图6所示。
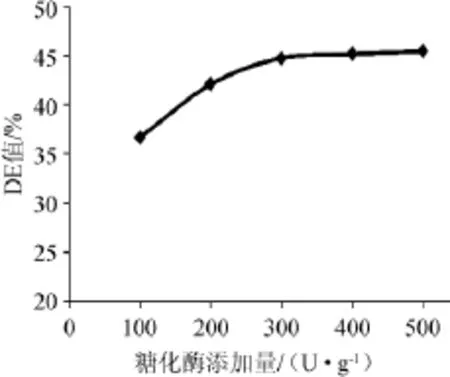
图6 糖化酶添加量对橡子淀粉糖化的影响Fig.6 Effects of glucoamylase addition on acorn starch saccharification
由图6可知,随着糖化酶的添加量逐渐增大,DE值也逐渐增大,当糖化酶添加量>300 U/g时,再增加糖化酶用量,DE值增加过缓。综合考虑生产成本,选择糖化酶添加量为300 U/g。
2.2.2糖化温度的确定
其他条件不变,分别于温度40℃、50℃、60℃、70℃、80℃条件下糖化,测定DE值以确定最佳糖化温度,结果如图7所示。
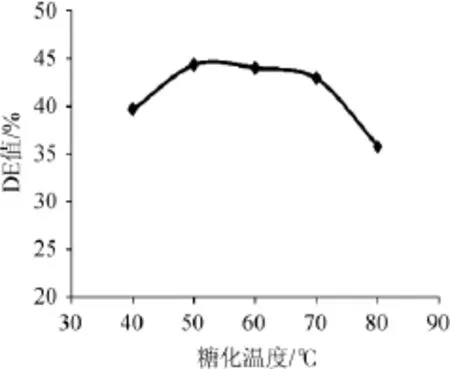
图7 糖化温度对橡子淀粉糖化的影响Fig.7 Effects of temperature on acorn starch saccharification
由图7可知,随着糖化温度的逐渐升高,DE值呈现先上升后下降的趋势,并且在50℃处出现最高值,为44.3%,温度高于60℃DE呈下降趋势。故选择糖化温度为50℃。
2.2.3糖化时间的确定
其他条件不变,糖化时间分别为30min、60min、90 min、120 min、150 min,测定DE值以确定最佳糖化时间,结果如图8所示。
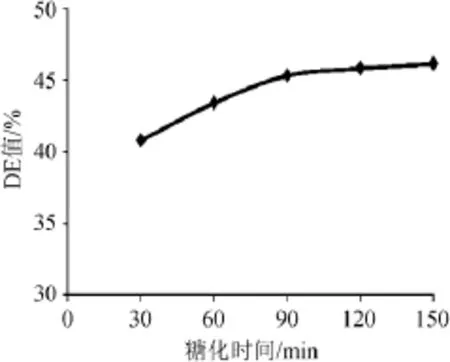
图8 糖化时间对橡子淀粉糖化的影响Fig.8 Effects of time on acorn starch saccharification
由图8可知,随着反应时间的逐渐加长,DE值也逐渐增大,当反应时间到达90 min时,DE值增加趋势变缓,时间过长会降低生产效率,故选择糖化时间为90 min。
2.2.4糖化pH值的确定
其他条件不变,分别控制pH 3.5、4.0、4.5、5.0、5.5,测定DE值以确定最佳糖化pH,结果如图9所示。
由图9可知,随着pH逐渐增大,DE值呈现是先增后减,当pH在4.0~4.5时,DE值达最大,为45.8%,再继续增大pH,DE值呈下降趋势。综合考虑选择糖化pH 4.5。
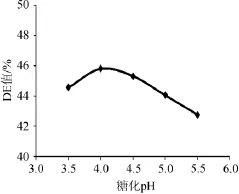
图9 pH对橡子淀粉糖化的影响Fig.9 Effects of pH on acorn starch saccharification
2.2.5糖化工艺优化正交试验
根据糖化阶段的单因素试验的结果,进一步设计L9(33)正交试验,以确定最佳液化条件。正交试验结果与分析见表4。
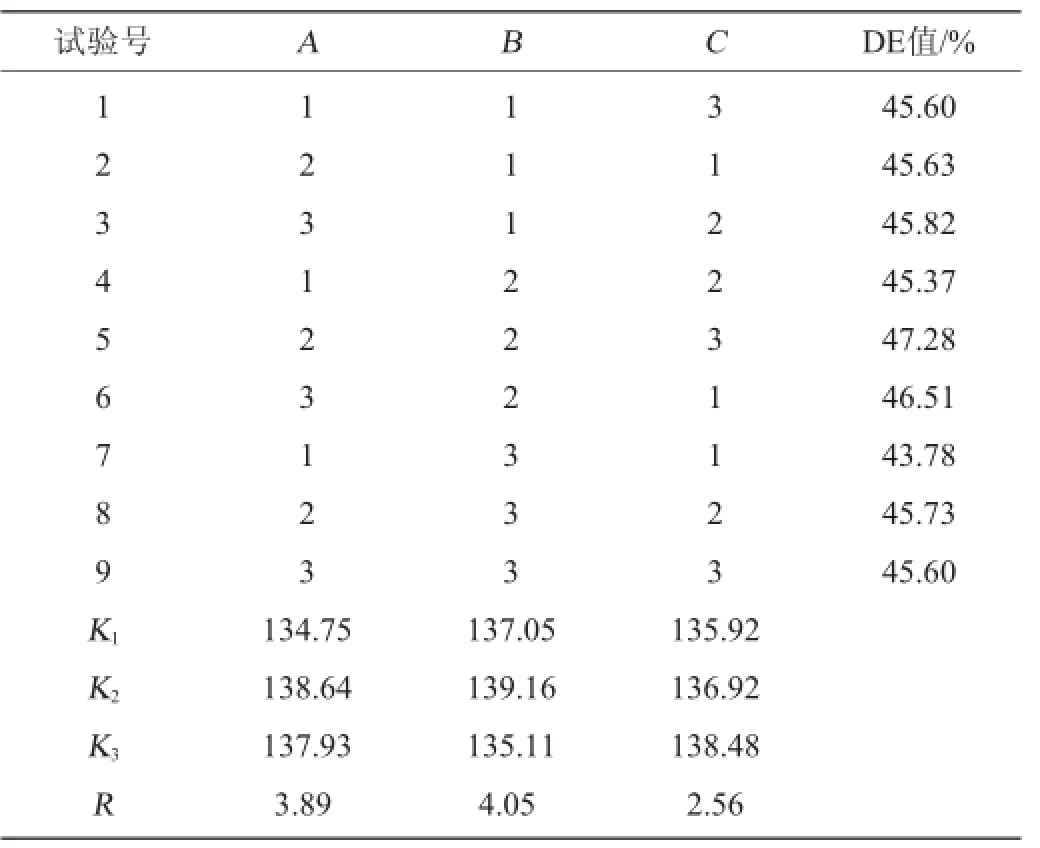
表4 糖化工艺优化正交试验结果与分析Table 4 Results and analysis of orthogonal tests for saccharification technology optimization
由表4可知,在橡子粉液化醪液的糖化试验中,对DE值影响大小顺序依次是B>A>C,即糖化温度>糖化酶添加量>糖化时间,最佳糖化工艺条件组合为A2B2C3,即糖化酶添加量300 U/g,糖化温度50℃,糖化时间120 min,此时DE值为47.28%。经验证试验,最佳工艺条件下水解橡子淀粉DE值达48.13%。
3 结论
橡子淀粉最佳的水解工艺为料液比1∶5(g∶mL),100℃煮沸30 min;冷却至70℃,控制中温α-淀粉酶添加量为30 U/g,液化温度为70℃,最佳pH 7.5,液化时间为120 min,CaCl2的添加量为0.3%;控制糖化酶添加量300 U/g,糖化温度50℃,pH 4.5,糖化时间120 min。在此工艺条件下,DE值达48.13%。利用中温α-淀粉酶和糖化酶水解橡子淀粉工艺的确定,为以橡子粉为原料采用液体发酵制备燃料乙醇提供了理论依据,为燃料乙醇的制备提供了新的原料,为橡子的深加工提供了新途径。
[1]胡芳名,李建安.湖南省主要橡子资源综合开发利用的研究[J].中南林学院学报,2000,20(4):41-40.
[2]魏练平,毛非鸿,蒋立科,等.橡子营养成分及其加工利用的初步研究[J].安徽农学通报,2007,13(9):137-138.
[3]韩伟,张全,佟明友,等.橡实粉性质及酶解条件研究[J].安徽农业科学,2013,41(14):6450-6451.
[4]李樊.橡实淀粉凝沉特性与晶体特性研究[D].长沙:中南林业科技大学博士论文,2013.
[5]王紫雅.橡实(杯状栲)淀粉的理化、凝胶性质研究[D].合肥:安徽农业大学硕士论文,2012.
[6]钟秋平.橡实淀粉加工特性的变化规律研究[D].长沙:中南林业科技大学博士论文,2007.
[7]程荷芳,卫民,蒋剑春,等.橡子与玉米、木薯的淀粉成分物理性质比较[J].林产化学与工业,2009,29(B10):183-186.
[8]杨静,蒋剑春,张宁,等.橡实与木薯、玉米淀粉理化性质的对比研究[J].安徽农业科学,2012,40(33):16362-16365.
[9]王航,黄立新,高群玉,等.橡子淀粉性质的研究[J].食品与发酵工业,2002,28(7):1-5.
[10]熊子书.橡子生长特征和酿酒研究的回顾[J].酿酒科技,1999(6):21-23.
[11]隆旺夫.橡子豆腐制作方法[J].农村新技术,2012(12):52.
[12]蔡凯凯,黄占旺,沈柱英,等.双酶法水解米糠淀粉的工艺研究[J].中国粮油学报,2013,28(5):17-23.
[13]张国权,史一一,罗勤贵,等.荞麦淀粉双酶水解工艺条件的优化研究[J].中国粮油学报,2008,23(4):86-91.
[14]张喻,谭兴和,熊兴耀,等.双酶法水解辐照改性马铃薯淀粉动力学研究[J].激光生物学报,2013,22(5):447-452.
[15]王丽娟,许婷婷,何冰芳,等.双酶法制备玉米粉水解糖液的工艺优化[J].粮食与饲料工业,2008(6):25-27.
[16]吴国峰,李国全,马永.工业发酵分析[M].北京:化学工业出版社,2006.
[17]张剑,田辉,周婷,等.Ca2+对双酶法水解玉米淀粉的影响[J].中国酿造,2008,27(11):31-33.
[18]KUNAMNENI A,SINGH S.Response optimization of enzymatic hydrolysis of maize starch for higher glucose production[J].Biochem Eng J,2005,27(2):179-190.
[19]SONI S K,KAUR A,GUPTA J K.A solid state fermentation based bacterial-amylase and fungal glucoamylase system and its suitability for the hydrolysis of wheat starch[J].Process Biochem,2003,39(2):185-192.
Hydrolysis technology for acorn starch by double enzymes
HAO Qiujuan,ZHAO Shihao*,LI Na,MA Tongsuo,LI Jing,CAO Fangyan,SUN Zhen
(College of Biological Science and Engineering,Hebei University of Economics and Business,Shijiazhuang 050061,China)
In order to perfect hydrolysis of acorn starch with the mesothermal α-amylase and glucoamylase,the hydrolysis conditions were optimized with orthogonal experiment based on single factor tests.The results showed that the optimal liquefaction process conditions were obtained as follows:mesothermal α-amylase addition 30 U/g,liquefaction temperature 70℃,pH 7.5,time 120 min,CaCl2addition 0.3%,the dextrose equivalent(DE)was 27.79%.The optimal saccharification technology conditions were obtained as follows:glucoamylase addition 300 U/g,saccharification temperature 50℃,pH 4.5,time 120 min,and DE was 48.13%.
acorn starch;hydrolysis;mesothermal α-amylase;glucoamylase
TS231
0254-5071(2016)03-0124-05
10.11882/j.issn.0254-5071.2016.03.028
2016-01-08
河北省科技支撑计划项目(14236802D-2);河北省社会科学基金项目(HB13GL036);河北经贸大学2014年大学生创新实验项目(201400052)
郝秋娟(1976-),女,讲师,硕士,主要从事发酵工程方向的教学和研究工作。
赵士豪(1966-),男,教授,硕士,主要从事食品加工技术方向的教学和研究工作。
