酶辅助超声提取紫苏迷迭香酸工艺优化及其抗氧化活性研究
2016-09-16黄丹丹朱秋劲罗自生茅林春
黄丹丹,朱秋劲,2,3*,沈 奇,彭 炜,罗自生,茅林春
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025;3.国家牛肉加工技术研发分中心,贵州 惠水 550600;4.贵州省油菜研究所,贵州 贵阳 550008;5.浙江大学馥莉食品研究院,浙江 杭州 310058)
酶辅助超声提取紫苏迷迭香酸工艺优化及其抗氧化活性研究
黄丹丹1,朱秋劲1,2,3*,沈奇4,彭炜1,罗自生5,茅林春5
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025;3.国家牛肉加工技术研发分中心,贵州 惠水 550600;4.贵州省油菜研究所,贵州 贵阳 550008;
5.浙江大学馥莉食品研究院,浙江 杭州 310058)
通过单因素试验研究超声波功率、料液比、超声时间对紫苏迷迭香酸提取量的影响,采用响应面分析法和Box-Behnken试验设计优化酶法辅助超声波提取迷迭香酸的最佳工艺参数,并通过迷迭香酸对抗猪油氧化能力和清除羟自由基的能力来研究其抗氧化活性。结果表明,迷迭香酸最佳提取工艺为纤维素酶添加量3%、超声功率320 W、超声时间10 min、料液比1∶40(g∶mL)。在此最佳条件下,迷迭香酸提取量为1.426 mg/g。迷迭香酸对羟自由基有较强的清除能力,并能有效抑制猪油氧化。
紫苏;迷迭香酸;响应面;酶辅助超声提取;抗氧化
紫苏(Perilla frutescensL.)是一年生直立草本植物,别名:赤苏、桂茬、荏子等;紫苏主要用于药用、食用、香料、油用等各方面,其紫苏叶可以生食、煲汤等[1-3]。紫苏在我国有近2 000年的种植历史,资源分布广阔。贵州独特的喀斯特地貌使得紫苏的种植有着得天独厚的优势,而且具有丰富的野生资源。紫苏叶具有味辛、归肺、脾经、散寒解表等功效,且疗效极佳,其中含较为丰富的迷迭香酸(rosmarinic acid,RosA),其具有较强的抗氧化剂[4],能阻断亚硝基类物质的作用、消除一定的自由基、防止脂质过氧化[5-9],可广泛用于化妆品、功能食品及调味品等领域。
目前,国内外提取迷迭香酸的主要方法为热水浸提法、微波和超声波辅助法等[10-13]。迷迭香酸被紫苏叶的细胞壁包裹住难于溶性,利用纤维素酶破坏紫苏叶细胞壁,加速迷迭香酸的溶出;超声波辅助提取是利用高频机械振荡波[14],促进紫苏叶中迷迭香酸的溶出,具有短时高效的特点。本试验以紫苏叶为原料,将乙醇溶液作为提取溶剂,利用纤维素酶辅助超声波法提取迷迭香酸[15],通过响应面优化提取条件,再通过对羟基自由基清除率及抗油脂氧化能力的测定,研究其抗氧化活性,为紫苏叶的开发利用提供参考。
1 材料与方法
1.1材料与试剂
紫苏叶样品(成熟期叶片,奇苏三号品种):采于贵州省油菜研究所紫苏种植基地;迷迭香酸标准品(纯度为98%):天津士兰科技有限公司;纤维素酶(酶活力≥15 000 U/g):贵州赛兰博科技有限公司;乙腈、氢氧化钠、磷酸、无水乙醇、浓盐酸、邻苯三酚、维生素C(vitamin C,VC)、维生素E(vitamin E,VE):美国Sigma公司。所有化学试剂均为分析纯或色谱纯。
1.2仪器与设备
BPCL-2-JZ-TG微弱发光仪(高压900 V):北京建新力拓科技有限公司;GT SONIC-P20型数控超声波清洗机:广东固特超声股份有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司;CP-214型电子天平:奥豪斯仪器(上海)有限公司。
1.3方法
1.3.1紫苏叶前处理
将新鲜紫苏叶洗净后放入干燥箱38℃烘干24 h。用粉碎机粉碎后用60目筛过滤,密封保存备用。
1.3.2纤维素酶法提取
称取1.00 g紫苏叶粉末样品,置于具塞锥形瓶内,加入3%的纤维素酶,体积分数为50%的乙醇溶液30 mL,调节pH至4,在45℃条件下酶解12 min,再经20 min热回流提取后过滤,残渣以同样的方法再提取1次,合并2次提取液,用蒸馏水定容至100 mL[16],每个处理重复3次。
1.3.3迷迭香酸含量测定及标准曲线绘制
迷迭香酸含量测定采用高效液相色谱法。色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm),流动相:含1%磷酸的蒸馏水∶乙腈60∶40(V/V),检测波长320 nm,进样量20 μL,流速0.5 mL/min。
迷迭香酸标准曲线绘制:精确称取迷迭香酸标准品并用蒸馏水溶解稀释质量浓度分别为20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L,由HPLC测出迷迭香酸峰面积,并以迷迭香酸质量浓度(x)为横坐标,迷迭香酸峰面积(y)为纵坐标绘制迷迭香酸标准曲线[17],按照标准曲线回归方程计算样品迷迭香酸含量。
1.3.4酶法辅助超声波提取迷迭香酸单因素试验
称取1.00 g紫苏叶粉末,加入3%纤维素酶,加入体积分数为50%的乙醇溶液30 mL,在提取温度45℃,于超声波清洗机中提取不同时间(10 min、15 min、20 min、25 min、30 min),不同功率(80 W、160 W、240 W、320 W、400 W),不同液料比(1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)),考察超声功率、料液比及提取时间对迷迭香酸提取量的影响,试验均重复3次。
1.3.5响应面试验设计
依据单因素试验结果,利用Box-Behnken试验设计,以超声功率、料液比和超声时间3个因素为自变量,以迷迭香酸提取量(Y)作为响应值,进行响应面分析,以-1、0、1分别代表自变量的低、中、高3个水平,响应面试验因素与水平设计见表1。
1.3.6迷迭香酸的抗氧化活性测定
(1)抗油脂氧化能力测定
依据照陈辉等[18]所述方法,精确称取紫苏叶中迷迭香酸提取物0.02 g,添加到50 g猪油(室温)中,充分混匀;再置入(45±1)℃培养箱中,每隔5 d测定过氧化值(peroxide value,POV),测定方法按照国标GB/T 5009.37—2003《食用植物油卫生标准的分析方法》中的碘量法,测出POV的值,POV是100 g油脂中过氧化物氧化碘化钾所析出碘的克数,它反应油脂氧化程度,POV值越大,氧化程度越大。空白组不加迷迭香酸粗提物,阳性对照组加相同质量的VE和VC。POV计算公式如下:
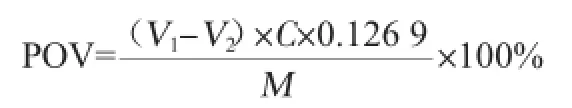
式中:POV为试样的过氧化值,mmol/L;V1为硫代硫酸钠标准滴定溶液的体积,mL;V2为试剂空白消耗硫代硫酸钠标准滴定溶液的体积,mL;C为硫代硫酸钠标准滴定溶液的浓度,mol/L;M为试样质量,g;0.126 9为与1.00 mL硫代硫酸钠标准滴定溶液{C(Na2S2O3)=0.002 0 mol/L}相当的碘的质量,g。
(2)羟自由基清除能力测定
参照李颖畅等[19]所述方法,在反应体系中加入1 mL 10mmol/L的FeSO4溶液,分别取1mL质量浓度为0.1mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL的迷迭香酸溶液进行实验,最后加入1 mL 8.8mmol/L H2O2溶液启动反应,37℃反应30 min,在510 nm波长处测定各浓度的吸光度值。空白组用水代替样品,对照组用同等质量浓度的VE和VC代替,每个样品重复3次。羟自由基清除率计算公式如下:

式中:A0为对照液的吸光度值;A1为加入迷迭香酸溶液后的吸光度值;A2为不加显色剂H2O2迷迭香酸溶液的吸光度值。
1.3.7数据分析
利用SPSS 18.0和Design-Expert V 8.0软件进行数据处理及统计分析。
2 结果与分析
2.1迷迭香酸标准曲线的建立
以迷迭香酸质量浓度(x)为横坐标,峰面积(y)为纵坐标作图,得到迷迭香酸标准曲线,结果见图1。
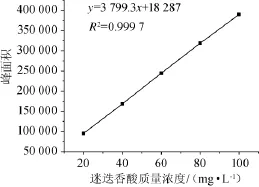
图1 迷迭香酸标准曲线Fig.1 Standard curve of rosmarinic acid
由图1可知,迷迭香酸标准曲线回归方程为y=3 799.3x+ 18 287,相关系数R2=0.999 7。结果表明,迷迭香酸含量与峰面积之间呈现良好的线性关系。
2.2酶法辅助超声波提取迷迭香酸的单因素试验结果
分别考察补充超声波功率、料液比、超声时间3个单因素对紫苏叶中迷迭香酸提取量的影响,结果见图2。
由图2A可知,当超声波功率在100~320 W,随着超声波功率的加大,迷迭香酸的提取量逐渐提高;在超声波功率为320 W,迷迭香酸的提取量达到最大值1.026 mg/g,这主要是因为迷迭香酸存在于紫苏叶的细胞壁中,通过超声波破坏紫苏叶的细胞壁,使迷迭香酸更易于被提取出来。当超声波提取量>320 W之后,随着超声波功率的增加,迷迭香酸得率开始下降。但当超声波功率>320 W时,会导致提取物中部分莽草酸结构显著破坏,导致提取物中迷迭香酸的结构会被破坏。因此,超声功率为320 W为宜。

图2 超声功率(A)、料液比(B)及超声时间(C)对迷迭香酸提取量的影响Fig.2 Effect of ultrasonic power(A),solid-liquid ratio(B)and ultrasound time(C)on extraction quantity of rosmarinic acid
由图2B可知,料液比在1∶20~1∶50(g∶mL),随着料液比的增大,迷迭香酸的提取量逐渐提高;在料液比为1∶50(g∶mL),迷迭香酸的提取量达到最大值0.931 mg/g;当料液比>1∶50(g∶mL)之后,随着料液比的增加,迷迭香酸得率开始下降,而且料液比过大,溶剂用量和下一步浓缩工艺的能耗都会增加[20]。因此,液料比在1∶50(g∶mL)为宜。
由图2C可知,提取时间在10~30 min,随着提取时间的延长,迷迭香酸的提取量随之增加;在提取时间为30 min时,迷迭香酸的提取量达到最大值1.226 mg/g,这是因为随着提取时间增加,细胞膜里越多的物质流出;提取时间>30 min之后,迷迭香酸得率反而下降,超声波作用会使提取物中部分迷迭香酸的结构受破坏。因此,提取时间以30 min左右为宜。
2.3酶辅助超声波法提取迷迭香酸的响应面优化试验结果
2.3.1回归方程的建立与方差分析
参照Box-Behnken试验设计进行响应面试验,结果见表2。
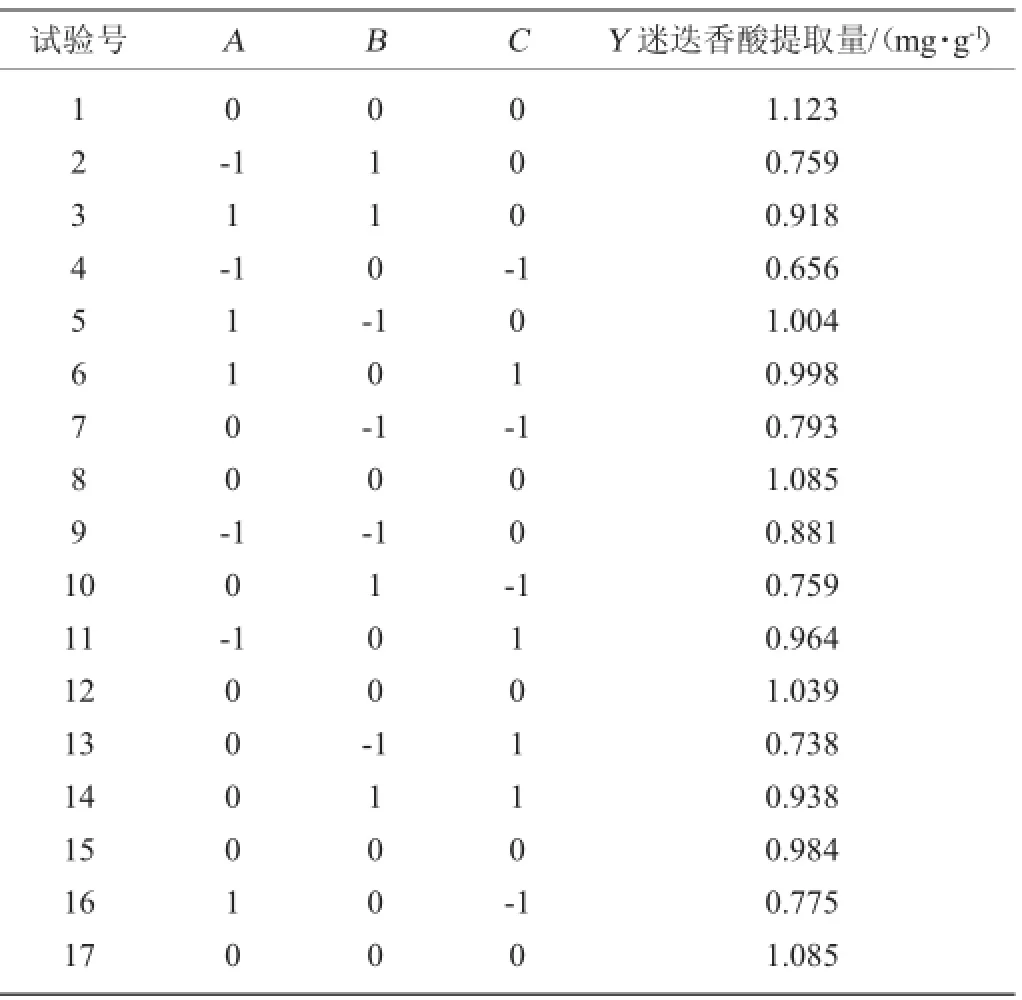
表2 响应面试验设计及结果Table 2 Design and results of response surface experiments
利用Design-Expert 8.0软件对表2的数据进行分析,得到了迷迭香酸提取量(Y)对超声波功率(A)、超声时间(B)和料液比(C)二次多项式回归方程:
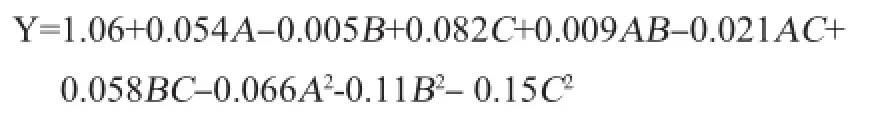
为检验方程有效性,利用分析软件对其进一步进行分析酶辅助超声波提取迷迭香酸得率,多元回归模型的方差分析及显著性结果见表3。
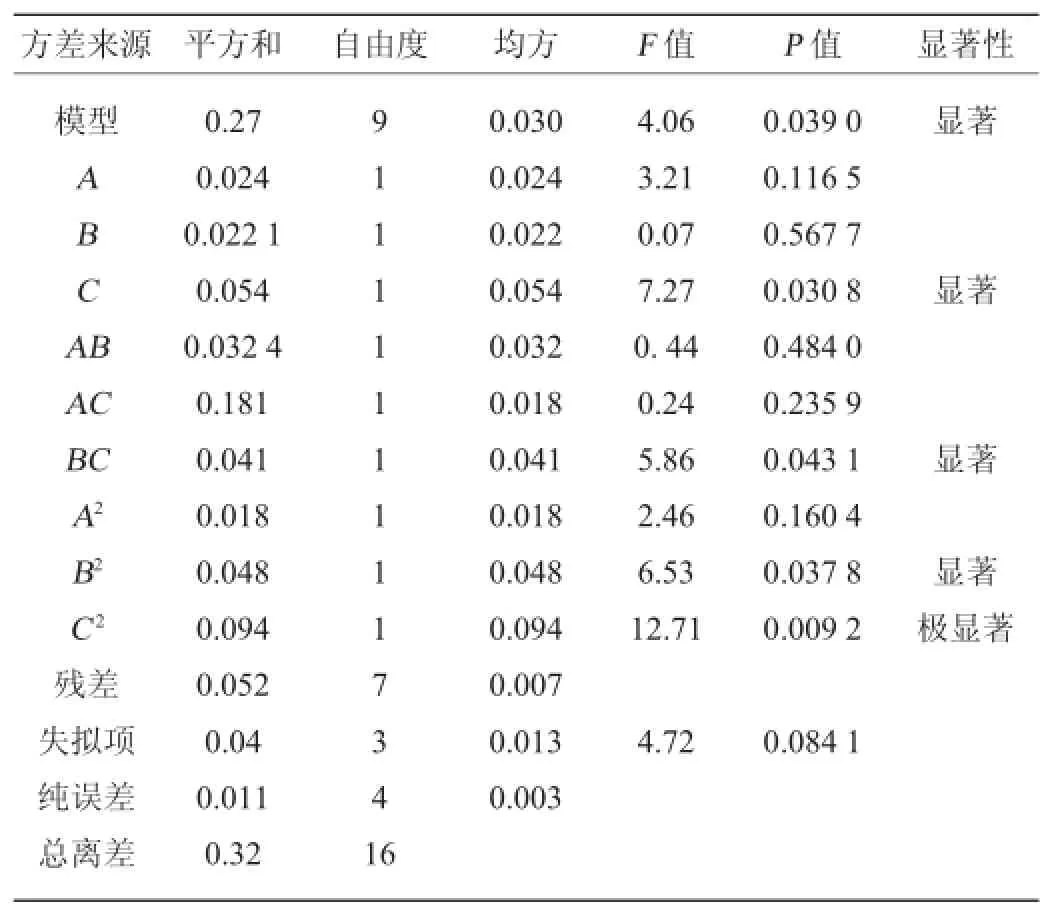
表3 回归方程方差分析Table 3 Variance analysis of regression equation
由表3可知,本试验选用的模型极显著(P<0.05),失拟项检验的P=0.0841>0.05,模型与试验值之间变化小,此模型线性相关系数R2=95.21%、调整决定系数R2Adj=91.38%,表明该模型拟合程度良好,模型可以用来分析和预测。一次项C、交互项BC及二次项B2对结果影响显著(P<0.05),二次项C2对结果影响极显著(P<0.01)。
2.3.2响应面分析与优化
利用Design-Expert8.0软件进行二次多元拟合得出响应面图及对应的等高线图,在固定其他因素水平值的情况下观察各因素间的交互作用对迷迭香酸提取量的影响,所得响应面及等高线见图3。
由图3可知,在响应面上其中每两个交互因素都有一个最高点,超声时间和功率对迷迭香酸提取量的影响较大,而超声时间的影响相对较弱。由图3a可知,随着超声功率(的增大或减弱,迷迭香酸提取量提升或降低,其曲线较为平滑,响应值变化较小;由图3b可知,迷迭香酸提取量随超声功率不变,提取量随着料液比的增加先增加后减小,而料液比不变时,迷迭香酸提取量随超声功率提高而增大但不明显,其曲线教为平滑,响应值变化小;由图3c可知,在超声波功率不变时,在试验设计范围内,料液比和超声时间交互作用显著,其曲线陡峭,响应变化值较大。
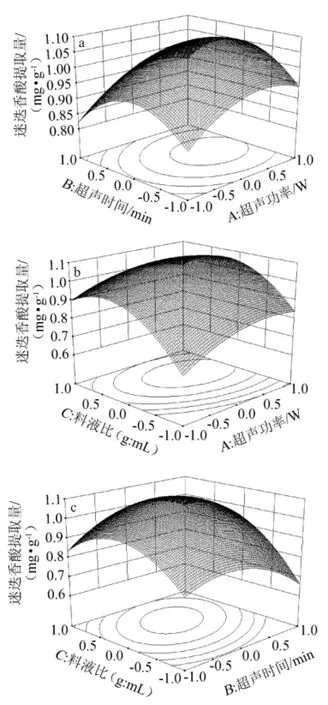
图3 超声功率、料液比及提取时间交互作用对迷迭香酸提取量影响的响应面及等高线Fig.3 Response surface plots and contour line of effects of interaction between ultrasonic power,solid-liquid ratio and extraction time on extraction quantity of rosmarinic acid
利用Design-ExpertV8.0软件分享得到紫苏叶中迷迭香酸提取最佳条件为超声功率为320W、料液比为1∶40(g∶mL)、超声时间为10 min,在此提取条件下,紫苏叶中迷迭香酸提取量的预测值为1.537 mg/g。为了验证该响应面结果的可行性,在软件分析的最佳条件下进行3次平行试验,迷迭香酸平均提取量为1.426 mg/g,标准偏差为0.079 mg/g。因此在该条件下试验结果稳定,响应面结果可靠。
2.4抗氧化分析
2.4.1抗猪油氧化能力
由图4可知,随着时间的增加,空白组猪油的POV值从0.040 mmol/L一直上至0.176 mmol/L添加迷迭香酸的猪油的POV值从0.037 mmol/L一直上升到0.120 mmol/L,说明迷迭香酸对猪油有一定的抗氧化作用。在同一时间段上,迷迭香酸对猪油的POV值大于VC,弱于VE,因此迷迭香酸抗氧化性优于VC,低于VE。在25 d时,迷迭香酸抗氧化作用的上升趋势开始减弱,这是因为迷迭香酸中的酚羟基中氧化还原电位产生变化,导致自身进行氧化作用。结果表明,迷迭香酸对猪油具有抗氧化作用。

图4 不同抗氧化剂对猪油抗氧化效果的影响Fig.4 Effect of different antioxidants on antioxidant effect of lard
2.4.2清除羟自由基能力
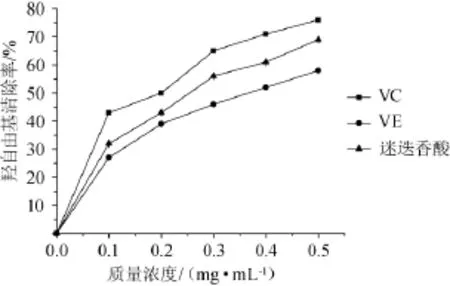
图5 不同抗氧化剂对羟自由基的清除作用的影响Fig.5 Effect of different antioxidants on scavenging effect of hydroxyl free radical
由图5可知,迷迭香酸具有一定清除羟自由基的能力,在试验浓度范围内,VC、迷迭香酸、VE三种物质对羟自由基的清除能力随浓度的上升而逐渐增强。迷迭香酸质量浓度在0~0.3 mg/mL时,羟自由基清除能力随着质量浓度的上升而较快增强,当迷迭香酸质量浓度>0.3 mg/mL时,羟自由基清除率达50%以上;比同质量浓度的VE清除率大,但比同质量浓度的VC清除率小。结果说明紫苏叶中迷迭香酸具有一定清除羟自由基能力。
3 结论
利用响应面法优化酶辅助超声波法提取迷迭香酸最佳工艺条件,结果表明,迷迭香酸最佳提取工艺为纤维素酶添加量3%、超声功率480W、超声时间10min、料液比1∶40(g∶mL),在此最佳条件下,迷迭香酸提取量为1.426 mg/g。体外抗氧化实验结果表明,紫苏叶提取迷迭香酸具有一定的抗猪油氧化能力及清除羟自由基能力。
[1]YANG S Y,HONG C O,LEE H,et al.Protective effect of extracts of Perilla frutescenstreated with sucrose ontert-butyl hydroperoxide-induced oxidative hepatotoxicityin vitroandin vivo[J].Food Chem,2012,133(2):337-343.
[2]任文彬,汪薇,黄美玲.紫苏哈密瓜酒的研制[J].中国酿造,2010,29(11):186-189.
[3]肖翔,周立平,马新.红曲菌发酵中添加紫苏叶提取物对其抗氧化活性的影响[J].中国酿造,2011,30(7):50-53.
[4]郭峰,朱炳阳,迟秀玲,等.迷迭香酸抗过氧化氢诱导血管平滑肌细胞凋亡作用的研究[J].中国药理通报,2007,23(3):365-370.
[5]PETERSEN M.Rosmarinic acid:new aspects[J].Phytochem Rev,2013,12(1):207-227.
[6]ZHEN W,HONG L,YONG Y,et al.Ultrasonic extraction optimization ofL.macranthoidespolysaccharides and its physicochemical properties[J].Int J Biol Macromol,2015,74(3):224-231.
[7]吴建章,郁建平,赵东亮.迷迭香酸的研究进展[J].天然产物研究与开发,2005,17(3):383-388.
[8]赵晓云,赵博,邢媛媛,等.荷叶多酚的微波辅助提取工艺优化及其抗氧化活性研究[J].中国酿造,2010,29(3):79-83.
[9]CHEN X M,CUI W H,SU Y U,et al.Accumulation dynamic of rosmarinic acid in different growing period ofRosmarinus officinalisL.[J]. J Mianyang Norm U,2015,3(2):182-196.
[10]王春燕,刘爱文,陈忻,等.超声波法提取紫苏中迷迭香酸条件的研究[J].广东化工,2010,37(11):41-42.
[11]周平,吕晓玲,姚秀玲.超声波辅助提取紫苏中迷迭香酸条件的优化[J].天津科技大学学报,2007,22(2):72-75.
[12]毕良武,赵振东,李冬梅,等.迷迭香抗氧化剂和精油综合提取技术研究(Ⅲ):超临界CO2萃取法[J].林产化学与工业,2007,27(6):8-12.
[13]REICHLING J,NOLKEMPER S,STINTZING F C,et al.Impact of ethanolic lamiaceae extracts on herpesvirus infectivity in cell culture[J]. Forsch Komp,2008,15(6):313-320.
[14]LEE H J,CHO H S,PARK E,et al.Rosmarinic acid protects human dopaminergic neuronal cells against hydrogenperoxide-induced apoptosis[J].Toxicology,2008,250(2/3):109-115.
[15]LIU J L,ZHENG S L,FAN Q J,et al.Optimisation of high-pressure ultrasonic-assisted extraction and antioxidant capacity of polysaccharides from the rhizome ofLigusticum chuanxiong[J].Int J Biol Macromol,2015,76(2):80-85.
[16]谭小鸿,张援虎,张荣祥.HPLC法测定草珊瑚中富马酸含量的方法学研究[J].亚太传统医药,2009,5(8):43.
[17]LI X J,ZHANG Q,ZHANG A L,et al.Metabolites fromAspergillus fumigatus,an endophytic fungus associated with melia azedarach and their antifungal and antifeedant activities and toxicity[J].J Agr Food Chem,2012,60(3):3424-3431.
[18]陈辉,李光,刘振林.迷迭香对猪油抗氧化实验[J].中国卫生检验杂志,2007,21(5):952-953.
[19]李颖畅,李冰心,孟良玉,等.圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J].食品科学,2012,33(9):105-109.
[20]韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造,2009,28(6):155-157.
Optimization of enzyme-assisted ultrasonic extraction technology of rosmarinic acid from Perilla frutescensand its antioxidant activity
HUANG Dandan1,ZHU Qiujin1,2,3*,SHEN Qi4,PENG Wei1,LUO Zisheng5,MAO Linchun5
(1.College of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Agricultural and Animal Products Store and Processing of Guizhou Province,Guiyang 550025,China;3.Branch Center of National Beef Processing Technology Research,Huishui 550600,China;4.Guizhou Rapeseed Institute,Guiyang 550008,China;5.Fuli Institute of Food Science,Zhejiang University,Hangzhou 310058,China)
The effects of ultrasonic power,solid-liquid ratio and ultrasonic time on extraction quantity ofPerilla frutescensrosmarinic acid were researched by single factor experiments.The optimum enzyme-assisted ultrasonic extraction technology parameters of rosmarinic acid were optimized by response surface methodology and Box-Behnken experiments.The antioxidant activity of rosmarinic acid on lard oil and hydroxyl radical was researched.The results showed that the optimum extraction conditions of rosmarinic acid was cellulose 3%,ultrasonic power 320 W,ultrasonic time 10 min,solid-liquid ratio 1:40(g:ml).Under the optimum conditions,extraction quantity of rosmarinic acid was 1.426 mg/g.Rosmarinic acid had a strong ability of scavenging on hydroxyl free radical,which could inhibit lard oxidation effectively.
Perilla frutescens;rosmarinic acid;response surface methodology;enzyme-assisted ultrasonic extraction;antioxidant
TS202.3
0254-5071(2016)03-0089-05
10.11882/j.issn.0254-5071.2016.03.020
2016-01-14
浙江大学馥莉食品研究院资助项目(KY201405);贵州山区畜产品系列休闲方便肉食品产业化技术成熟化与示范应用(700952142111)
黄丹丹(1990-),女,硕士研究生,研究方向为畜产品加工及贮藏。
朱秋劲(1969-),男,教授,博士,研究方向为畜产品加工及贮藏。
